
- •Конспект лекций
- •Лекция 1
- •Основные определения
- •Лекция 2
- •Лекция 3
- •Лекция 4
- •Теплотворная способность
- •Добыча, потребление и значение ископаемого топлива
- •Лекция 5
- •Лекция 6
- •Классификация вв
- •Физико-химические характеристики вв Консистенция и структура
- •Физическая стабильность вв
- •Реакции взрывчатого превращения
- •Лекция 7
- •4.2. Общие сведения о взрывчатых веществах
- •Лекция 8
- •Физико-химические характеристики вв
- •Классификация вв
- •Инициирующие вв
- •Бризантные вв
- •Бризантные вв повышенной мощности
- •Лекция 9
- •Нитроглицериновые вв нормальной мощности
- •Вв, находящееся в стадии исследований
- •Жидкие вв и жидкие смесевые вв
- •Вв жидкие смеси
- •Оксиликвиты
- •Суррогатные вв
- •Лекция 10
- •Взрывная волна
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Если нельзя применять диоксид углерода (например, при горении металлов
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Строительные материалы. Строительные конструкции. Сравнительная оценка пожарной опасности лакокрасочных покрытий. Эвакуация людей при пожаре
- •Библиографический список рекомендуемой литературы
Лекция 2
ФИЗИКО – ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ И ВЗРЫВА. ОСНОВНЫЕ ПОНЯТИЯ, ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ. ТЕОРИЯ ГОРЕНИЯ ВЕЩЕСТВ. МЕХАНИЗМ ВЫГОРАНИЯ УГЛЕРОДА. ГОРЕНИЕ КАПЕЛЬ И АЭРОЗОЛЕЙ. ГОРЕНИЕ УГЛЯ. ТЕПЛОВАЯ ТЕОРИЯ ГОРЕНИЯ ВЕЩЕСТВ, ЦЕПНАЯ, ДИФФУЗНАЯ
Под процессом горения понимается самоускоряющаяся химическая реакция окисления топлива, сопровождается выделением большого количества тепла и света.
Теплопроизводительность топлива определяет количество энергии, которое может быть выделено в процессе горения.
Понятие топлива объединяет собой вещества, выделяющие в результате тех или иных преобразований энергию, которая может быть технически использована.
Горение используется человечеством на протяжении более миллиона лет и является одной из древнейших технологий. В настоящее время около 90% всей энергии, потребляемой нашей цивилизацией (выработка электроэнергии, получение тепла, транспорт и т.д.), обеспечивается именно процессами горения. Это обстоятельство и определяет важность и актуальность исследования процессов горения.
В прошлом исследование горения было направлено главным образом на изучение механики сплошной среды, включая тепловыделение за счет химических реакций. Часто это тепловыделение описывалось при помощи термодинамики, что предполагает бесконечно быстрые химические реакции. В определенной степени подобный подход оказался продуктивным для описания стационарных процессов горения, но он недостаточен для понимания переходных процессов, таких как воспламенение и погасание, а также для объяснения образования вредных выбросов, тем более что проблема образования вредных выбросов при горении ископаемых топлив была, есть и будет одной из важнейших задач в будущем.
В настоящее время известны следующие крупные группы топлива, различающиеся по принципу высвобождения энергии – ядерное топливо, выделяющее энергию в результате ядерных преобразований, химическое топливо, которое выделяет энергию при окислении горючих элементов, входящих в состав этого топлива.
Несмотря на значительное развитие использования ядерного топлива, основной источник получения энергии в настоящее время в различных энергетических установках и ДВС – химическое топливо. А основной способ получения энергии – сжигание топлива в камере сгорания.
Наиболее распространенная химическая реакция горения – реакция органической массы природного топлива кислородом воздуха или реакция окисления в среде, обогащенной кислородом.
В настоящее время добываются и используются природные топлива – газ (метан), нефть, уголь разного состава, торф, древесина и др. Многие виды топлива получают искусственным путем в результате технологической переработки природных топлив. Все они отличаются друг от друга своим химическим составом и структурой, и это влияет на характер протекания процесса горения. Особенности различия природных топлив тесно связаны с их происхождением и геологическим возрастом. Считается, что вся гамма природных топлив от торфа – до антрацитов представляет собой различные стадии геологического старения первичных углеобразователей, основными из которых являются растительные организмы, начиная от древесных пород до мхов и планктонных образований.
Вещество отмерших клеток представляет собой полимерные углеводороды с различным соотношением С – Н – О2.
С точки зрения склонности к естественному распаду составляющие растительных организмов можно разбить на 2 группы:
1 гр. – целлюлозы, белки, гемицеллюлозы (их химическая формула (С6Н10О5)n или (С5Н8О4)n).
2 гр. – лигнин, воски, смолы, углеводороды и др. вещества.
Составляющие первой группы в процессе геологического старения (метаморфизма) превращаются в газообразные или легкорастворимые вещества и в процессе углеобразования не участвуют.
Вещества второй группы со временем полимеризуются, уплотняются и превращаются в более устойчивые соединения, в их составе увеличивается доля углерода и уменьшается доля кислорода – сюда входят горючие сланцы, угли.
Нефть и горючие природные газы также образуются в результате длительных преобразований органических остатков, которые оказались включенными в горные породы (т.е. в замкнутых объемах). Основную массу нефти составляют углеводороды различных классов – предельные, непредельные, ароматические.
Природные газы состоят также из углеводородных соединений, в основном из метана – СН4 (до 90 %).
Т.о. все виды природных топлив (кроме древесины) представляют собой горючие ископаемые – т.е. горные породы органического происхождения – каустобиолиты, которые подразделяют на: гумусовые породы (торф, каменные и бурые угли); сапропелевые породы (сапропелевые угли, горючие сланцы); петролиты (нефть, озокерит, горючие газы).
Искусственные топлива получают в результате технологической переработки твердых топлив – это коксы, полукоксы, их состав отличается значительным содержанием углерода и снижением содержания О2 и Н. В энергетических целях кокс не используется.
Искусственные горючие газы получаются либо специально (так называемые генераторные газы), либо попутно при протекании различных технологических процессов (газы коксовальных печей, доменные газы, попутные газы нефтедобычи и др.). Состав этих газов разнообразен, зависит от способа их получения, содержит значительные количества N2, СО2, СО, что снижает их теплотворную способность.
Воспламенение, сопровождающееся ударной волной, называется взрывом. От тихого воспламенения до взрыва существует непрерывный переход. Поэтому в обоих случаях процесс описывается одними и теми же уравнениями, что не позволяло провести границу между этими двумя существенно различными формами процессов.
Ударная волна возникает из-за быстрого увеличения давления газа в фронте пламени. Она имеет разрушительную способность, если в ней избыточное давление больше 0,15 атм.
Для возникновения взрыва прежде всего необходимо, чтобы длительность химического превращения в фронте пламени была очень мала, меньше 1 мксек.
Это возможно только в том случае, если процесс не тормозился недостаточным притоком вещества и тепла к месту реагирования.
Во всех взрывчатых материалах реагенты находятся в тесном смешении. При изготовлении взрывчатых материалов это достигается или механическим смешением, например при изготовлении черного пороха, или путем введения в молекулу легко окисляющегося вещества атомной группы – NО2, которая обладает большой окислительной способностью.
Из газовых систем способны взрываться только те, в которых горючий газ или горючая пыль смешаны с кислородом, причем содержание горючего в смеси должно находится в определенных количествах. Такая смесь называется гремучем газом.
Тяжелые углеводороды и их кислородные производные при менее интенсивном зажигании и при меньших концентрациях взрываются легче.
Теория горения веществ
Состав топлива – наиболее важная техническая характеристика, определяющая процесс горения и количество выделяющейся при этом энергии.
О сновные
топливообразователи – СГ,
НГ,
ОГ
Состав горючей массы.
сновные
топливообразователи – СГ,
НГ,
ОГ
Состав горючей массы.
В небольших количествах – SГ и NГ Процентное содержание
этих веществ по отношению к горючей
массе.
Все эти компоненты составляют горючую массу топлива, им присваивается индекс. Процентное содержание в топливе всех веществ (включая золу), входящих в состав одной сухой массы, называют элементарным составом сухой масс (индекс СС).
СС + НС + ОС + NС + SС + АС = 100 %
Минеральные примеси, попадающие в состав топлива, составляют золу топлива (А). Зола не принимает участия в реакции окисления (горении, снижает теплотворную способность топлива.
Во всех топливах имеется некоторое количество влаги (W).
Общая масса топлива, включая золу и влагу, называется рабочей (индекс Р)
СР + НР + ОР + NР + SР + АР + WР = 100 %
Состав горючих газов характеризуется чаще всего в виде процентов объемного содержания составляющих газов, например,
СО + Н2 + СО2 + Н2О + СН4 + СnНm + О2 = 100 %
Тепловую ценность топлива принято характеризовать его теплотворной способностью Q, выражаемой в ккал/кг (дж/кг) или ккал/м3 (дж/м3).
Т.к. в продуктах
сгорания топлив всегда содержится вода
(пары воды – из-за наличия воды в топливе
и образовании воды при сгорании водорода),
то и обращается энергия на парообразование
и конденсацию паров. В связи с этим для
расчетов обычно применяется значение
низшей теплотворной способности
![]() ,
которая учитывает тепловые потери с
парами воды.
,
которая учитывает тепловые потери с
парами воды.
Одной из основных особенностей твердых природных топлив (также древесины, композиций) является способность выделять при нагревании газообразные и жидкие продукты термического разложения их органической массы, так называемые летучие, обозначаются символом V.
Летучие играют значительную роль при воспламенении и на начальных стадиях горения, в значительной степени определяют реакционную способность горючего вещества.
Теплопроизводительность топлива органического происхождения определяется в основном степенью окисления углеродной основы топлива.
Чем больше степень окисления углеводородной основы топлива, тем меньше теплопроизводительность.
Наибольшая теплопроизводительность наблюдается у топлива, состоящего из не окисленных углеводородов, например, у нефти, природного газа.
В качестве примера рассмотрим молекулу метана, составляющего основу природного газа, СН4.
Один атом С связан, т.е. весовое содержание водорода в молекуле метана составляет 25 %, т.е. ни один углеводородный продукт не содержит в себе такого большого количества водорода. При этом следует иметь в виду, что водород по своей теплотворной способности выше углерода в 4 ряда. Т.о. метан имеет самую высокую теплотворную способность, которая составляет 13300 ккал/кг.
Химически формула метилового спирта – СН4О. В момент такого окисления уже выделилось некоторое количество энергии, теплотворная способность спирта метилового – 5340 ккал/кг.
Присоединение еще одного атома кислорода приводит к образованию нового вещества – формальдегида – СН2О + Н2О, при этом происходит отделение одной молекулы воды.
Теплотворная способность формальдегида – 2790 ккал/кг.
Если к молекуле метана прибавить 4 атома кислорода, то это разбивает молекулу СН4
СН4 + 4О СО2 + 2Н2О
Такая смесь вообще гореть не может, и ее теплотворная способность равна 0.
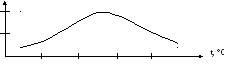
Падение теплотворной способности от наивысшего значения у чистого углерода до нулевого значения у продуктов полного окисления и иллюстрируется на рис1., где приведен случай последовательного окисления этана – С2Н6.
13000 Этан
12000 Бензол
10000
7500
4500
3000 0
25 50 75 100%
Содержание О2, % Этиловый
спирт С2Н6О
Этиленгликоль
С2Н6О2
Уксусная
кислота С2Н4О2+Н2О







Основное влияние на процесс воспламенения оказывает влияние летучих, находящихся в топливе. Чем больше летучих, тем быстрее происходит воспламенение топлива.
Влияние летучих на процесс воспламенения можно рассматривать в 2-х основных направлениях:
В период до воспламенения, в ходе воспламенения и на начальных стадиях горения летучие оказывают прямое влияние, определяя условия протекания процесса, т.к. для большинства материалов (древесина, торф, уголь бурый…) воспламенение начинается с газовой фазы уже выделившихся летучих, которые быстро выгорают и повышают температурный уровень процесса и обеспечивают условия надежного воспламенения и дальнейшего устойчивого горения материала со значительным выделением летучих при термическом поглощении.
Влияние летучих на интенсивность протекания процесса горения проявляется в повышенной реакционной способности коксового остатка (по сравнению с реакционной способностью чистого углерода) и изменением структуры частиц топлива в период выделения летучих веществ.
Твердое топливо при поджигании претерпевает нагрев от начальной температуры подачи (попадания) в зону горения (топка) до температуры близкой к теоретической температуре горения.
В процессе нагрева, еще до начала воспламенения происходит термическое разложение органической массы топлива с выделением паро- и газообразных веществ, которые в основном и определяют условия воспламенения топлива.
Условия нагрева частиц (или кусков) топлива определяются условиями теплоотдачи с учетом аэродинамических факторов – подсоса горячих газов к корню факела, концентрации кислорода и пр.
Способность твердого топлива выделять, при нагревании, продукты термического разложения органической массы. Эта способность используется на практике – термическое разложение торфа, коксующихся углей, сланец, бурые угли и др. – для получения ценных химических веществ: смол, кислот, высококалорийных газов (H2, CH4…) эти вещества могут быть использованы в народном хозяйстве (химическая промышленность – полуфабрикаты, товарные продукты).
Ориентировочный состав продуктов термолиза некоторых твердых топлив:
|
|
полукокс |
смола |
кислота |
газ |
|
Древесина |
35-25% |
14-16% |
2-6% |
27-28% |
|
Уголь бурый |
75% |
5% |
|
11% |
|
Сланец |
55% |
24% |
|
68% |
Интенсивность выделения продуктов термолиза определяется множеством факторов: темп нагрева, температурный уровень процесса, время пребывания уже образовавшихся продуктов термолиза в зоне высоких температур.
В
V
24
16
200 300 400 500 600
Механизм выгорания углерода
При гетерогенном процессе реакция горения протекает на поверхности углеродного массива, включая и внутренние поверхности больших и малых пор, рассекающих массив куска (крупной частицы).
Изучение механизма окисления занимаются более 70 лет большой круг исследователей.
В настоящее время общепризнанным является по стадийный процесс окисления углерода топлива учитывается, что взаимодействие углерода с окислителем (O2, также CO2, H2O) протекает постадийно с участием нестабильных образований, которые наблюдаются в адсорбированном состоянии на наружной поверхности углеродного массива.
Схема насыщения связей атомов на поверхности углеродного массива
= массив =
С – С – С – С –
| | | | O - адсорбированные
С – С – С – С – молекулы газа
| | | |
O – С – С – С – С – O
\ / \ / |
C – C C – O
|
O
= поверхность массива =
В объеме массива все атомы уравновешены, на поверхности, за счет их физического и химического притяжения. Может наблюдаться образование пограничного слоя газа на углеродной поверхности. Так как поверхность углерода неоднородна, пориста – доступна для адсорбции (физической адсорбции за счет физического притяжения атомов; химической адсорбции – хемосорбции (перенос электронов, объединение электронных оболочек).
Сорбционный механизм взаимодействия O2 и углеродом примерно следующий:
CO
O2 O2сорбCXOYсорб
CO2
При низкотемпературном окислении углерода сорбционный механизм процесса целиком определяет интенсивность выгорания углерода, количество и качество продуктов сгорания. Однако понятие низкотемпературного окисления весьма условно – это может быть до 600-800 °К для некоторых типов углей.
Далее при повышении температуры процесс может перейти в устойчивый стационарный характер.
При взаимодействии с CO2 воздуха и H2O в виде пара сорбционные явления протекают при температурах значительно больших, до 1000-1200 °К.
При горении организованном, например, в топке сорбционные процессы протекают практически мгновенно, механизм горения мгновенный или "ударный" характер. То есть при горении (выгорании углерода) имеют место 2 температурные области протекания горения:
Низкотемпературное окисление, при этом преобладающую роль играют сорбционные процессы. Такие процессы могут иметь место при сушке и хранении топлива.
Высокотемпературное горение, при котором скорость адсорбции и десорбции настолько велики, что нестационарностью процессов можно пренебречь. В этой области проистекают топочные процессы.
Независимо оттого, по какому механизму протекает процесс горения – первичные продукты: CO, CO2.
При высокой влажности сжигаемого топлива может образовываться также и H и CH4 (мокрая газификация).
Основным итогом химической стороны горения (процесса взаимодействия C с O2 при высоких температурах) – следующие процессы.
По реакции:
– первичные реакции
С + O2 = СO2 ; 2С + O2 = 2СO,
– вторичные реакции
Наряду с этим, у поверхности горящей углеродной частицы возможно взаимодействие уже образовавшейся СO с O2:
2СO + O2 = 2СO2,
и далее на поверхности идет восстановление образовавшейся углекислоты:
СO2 + С = 2СO,
эти реакции называют вторичными
В определенных условиях либо первичные, либо вторичные реакции могут иметь определяющую роль в процессе выгорания углерода.
При высокотемпературном процессе окисления протекают следующие процессы на внешней поверхности куска и поверхности пор
при сухой газификации при мокрой газификации
( H2O отсутствует) (окисление за счет H2O)
1. С + O2 = СO2 + q1 (+), 3`. С + H2O = СO + H2 + q3` (-),
2. 2С + O2 = 2СO + q2 (+), 3``. С + 2H2O = СO2 + 2H2 + q3`` ,
3. С + CO2 = 2СO + q3 (-); 3```. С + 2H2 = СH4 + q3``` (-);
Далее в процессе встроенной диффузии продуктов неполного горения от поверхности углеродного массива в поток окислителя, между продуктами горения и окисления проходят следующие реакции
4. 2СO + O2 = 2СO2 + q4 (+),
4`. 2H2 + O2 = 2H2O + q4` (+),
4``. CH4 + 2O2 = 2СO2 + 2H2O + q4`` (+),
4```. СO + H2O = СO2 + H2 q4``` (+).
Горение капель и аэрозолей
Горение жидких топлив обычно совершается путем впрыскивания жидкого топлива через отверстие (сопло) в газовую фазу, в которой и происходит горение. Турбулентность внутри потока жидкости (специально создаваемая за счет большого градиента скорости внутри инжектора) вызывает распад выходящего из инжектора потока жидкости на «клубок» жидких нитей, который впоследствии превращается в плотное облако капель, за счет баллистического движения проникающих сквозь газ в зону горения. Перенос тепла к каплям вызывает увеличение давления пара и, таким образом, испарение топлива в газовую фазу, пока не начнется горение в газовой фазе. Каплю или ансамбль капель окружает (хотя бы частично) пламя предварительно не перемешанной смеси. Важно отметить, что в конечном итоге горит не жидкость сама по себе, а пары этой жидкости. Совокупность всех этих одновременно протекающих процессов называется струйным горением. Обычно исследователи, изучающие модели струйного горения, сосредотачивают свое внимание на двух проблемах.
Горение отдельной капли. Если имеется возможность исследовать отдельно фундаментальные физико-химические процессы, которые происходят при струйном горении, то целесообразно сосредоточить внимание на горении отдельной капли. В этом случае можно применить очень детальные модели для описания химических реакций, испарения и молекулярного переноса (массы и энергии) в газовой фазе, в капле и на межфазной границе.
Струйное горение. При моделировании практически важных систем (таких как камера сгорания реактивного двигателя, дизельный двигатель или бензиновый двигатель внутреннего сгорания с прямым впрыском топлива) в модель должны быть включены субмодели для всех физических процессов. Как уже отмечалось, все эчти субмодели разрабатываются до определенного уровня детализации так, чтобы глобальная модель не требовала слишком больших вычислительных ресурсов. Например, разрушение струи, дробление капель, испарение капель, турбулентное перемешивание, газофазная химическая кинетика и ряд других процессов очень часто описываются при помощи упрощенных моделей, часто называемых глобальными или редуцированными моделями.
Взаимосвязь горения отдельной капли и струйного горения аналогична взаимосвязи моделей ламинарного пламени, которые внедряются в модели турбулентного горения.
Аэрозоль образуется при разрушении струи топлива (поступающей из впускного отверстия) за счет поперечных сил сдвига во время впрыска в камеру сгорания. Этот процесс аналогичен образованию турбулентных структур в слоях с поперечным градиентом скорости. Жидкие фрагменты, которые еще не имеют сферической формы, попадают в поток окислителя и продуктов сгорания (обычно турбулентный и с рециркуляцией). Распределение диаметров капель в ансамбле аэрозоля не однородно. Оказалось, весьма полезно характеризовать распределение диаметров различными нестационарными функциями распределения по размерам, моменты которых изменяются со временем. Вид функции распределения и ее последующая эволюция определяются главным образом природой инжектируемого топлива и свойствами потока в камере сгорания (например, граничными условиями).
Испарение капель и диффузия топлива в газовую фазу приводят к образованию горючей смеси, которая воспламеняется при достаточно высокой температуре. Если рассматривать разбавленный аэрозоль (когда расстояние между каплями велико), то процессы в течение воспламенения и горения можно понять, исследуя поведение отдельных капель. В плотных аэрозолях, однако, капли расположены слишком близко друг к другу для того, чтобы можно было пренебречь их взаимодействием. Горение такой системы происходит в криогенных ракетных двигателях.
Учитывая, что горение струи аэрозоля является процессом сложного взаимодействия многих самых разных процессов, таких как прогрев капель, испарение, воспламенение, горение, взаимодействие различных капель, взаимодействие горения капель с турбулентным потоком и т.д., становится очевидным, что моделирование горения струй аэрозолей представляет собой сложную, но перспективную проблему.
Горение угля
На первый взгляд, твердые топлива (например, древесина или пластик) горят во многом аналогично жидким топливам. Они нагреваются до температуры, при которой начинается выделение значительного количества газофазных продуктов, сгорающих затем точно также, как это происходит в газовой фазе вокруг капель. Разница проявляется, когда некоторые остаточные фракции твердого топлива (а для некоторых жидких топлив тяжелые масла) не испаряются. Эти твердые фракции могут содержать углерод, который может быть окислен до СО молекулами 02, или даже до СО2.
Уголь представляет собой не однородное химическое соединение, а смесь большого числа углеводородных соединений, чья структура остается во многом неизвестной. Кроме горючих летучих и нелетучих соединений, уголь также содержит негорючие соединения, которые остаются после горения в твердой фазе, образуя золу. При горении угля можно выделить три различные процесса, взаимодействующие друг с другом: пиролиз угля (в результате которого образуются летучие соединения и богатый углеродом твердый продукт, называемый коксом), горение летучих соединений и горение кокса.
Пиролиз (термический распад и дегазация) угля происходит при температурах выше 600 К. При этом наблюдается образование кокса, гудрона и летучих компонентов. Пиролиз зависит от многих физико-химических процессов и характеристик угля, таких как сжатие или разбухание частиц угля, его структура (например, размер пор), процессы переноса в порах и на поверхности частиц угля, температура во время пиролиза, вторичные реакции продуктов пиролиза.
Поскольку химический состав угля не известен, химический механизм, описывающий пиролиз угля, может и должен быть лишь приблизительным. Летучие соединения образуются путем выделения функциональных групп, которые затем образуют СН4, Н2, СО, НСN и т.д. Разрыв химических связей в угле приводит к образованию фрагментов, способных перегруппироваться и реагировать, образуя гудрон. За этими химическими процессами следуют процессы диффузии летучих компонентов к поверхности частиц угля, где они испаряются и затем сгорают.
Летучие компоненты, образующиеся во времямя пиролиза, сгорают в газовой фазе. Основные процессы, которые при этом происходят (испарение, диффузия в газовую фазу и горение), аналогичны процессам, происходящим при горении капли. Однако летучие компоненты представляют собой смесь неизвестного состава; поэтому детальное описание, основанное на элементарной кинетике, невозможно и не оправдано.
Горение твердого кокса приводит к дополнительной трудности описания процесса горения. Кокс состоит главным образом из углерода; он обладает низким давлением насыщающих паров, так что испарение с последующим окислением в газовой фазе не является основным каналом реакции. Вместо этого углерод на поверхности окисляется до СО молекулами СО2 (и О3) из газовой фазы, которые сталкиваются и/или прилипают к поверхности. Реакцию с СО2 можно записать в виде С(s) + СО2(g) = 2СО(s). Теперь углерод прочно связан с кислородом и слабо связан с поверхностью. Поэтому образующаяся окись углерода (СО) уже имеет высокое давление насыщающих паров и охотно покидает поверхность, переходя в газовую фазу, где молекулы СО окисляются дальше с образованием СО2.
Тепловая теория горения веществ, цепная, диффузная.
Диффузное пламя образуется на границе соприкосновения двух газов, способных образовывать горючую смесь. Источником горючего газа может быть отверстие, из которого он выходит, и твердая или жидкая поверхность, генерирующая газ. Фронт пламени локализуется в том месте, в котором концентрации горючего газа и кислорода находятся в стехиометрических отношениях. Это следует из того, что если бы в фронте остался неизрасходованным один из реагентов, то он диффундировал бы на встречу другому реагенту, вследствие чего фронт переместился бы в том же направлении.
Если диффузионное пламя горит в воздухе, содержащем немного горючего газа, то вокруг главного фронта пламени образуется второй фронт в виде тонкого чехла. Такое двухслойное пламя можно наблюдать, если в воздухе присутствует метан.
При малых скоростях газов пламя ламинарно. В нем горючая смесь образуется в результате молекулярной диффузии. Именно образование горючей смеси управляет скоростью горения, а не реагирование, которое идет в фронте пламени очень быстро.
Если постепенно увеличивать скорости горючего газа, то ламинарность пламени нарушится. Это начинается с верхнего конца пламени при дальнейшем увеличении скорости газа, постепенно распространяется вниз до отверстия, из которого выходит газ. Одновременно пламя укорачивается до 2/3 первоначальной длины. При еще больших скоростях начинается «отрыв» пламени от отверстия и пламя погасает. Нарушение ламинарности пламени приводит к образованию турбулентного пламени, которое не надо смешивать с турбулентным течением газа в канале, из которого выходит газ. Завихрение пламени сосредоточены в его поверхностном слое и вызываются взаимодействием его с окружающей газовой средой. В турбулентном пламени смешению реагирующих газов способствует завихрение газовой струи, так как оно увеличивает поверхность, через которую идет молекулярная диффузия. Это сильно ускоряет горение.
Внутри пламени могут идти две группы второстепенных химических превращений: 1) окисление за счет кислорода СО2 и Н2О и 2) термическое разложение. Они идут и в готовой горючей смеси, но в ней они имеют значение только для автокаталитического механизма. В диффузионном пламени их роль более значительна.
Если в горючем газе происходит термическое разложение, то с внутренней стороны фронта диффузионного пламени образуется зона, в которой идут предварительные химические превращения исходных веществ. В этой зоне вследствие термического разложения образуются свободные радикалы и сажа.
Развитие окисления обнаруживается в исчезновении сажи, которая образуется в результате термического разложения. Очевидно, что в диффузионном пламени сажа сгорит за счет кислорода СО2 и Н2О, так как свободный кислород не может проникать через фронт пламени. Если в сажевой аэросуспензии температура понижается раньше, чем сажа успеет окислиться, то пламя коптит.
