
- •Конспект лекций
- •Лекция 1
- •Основные определения
- •Лекция 2
- •Лекция 3
- •Лекция 4
- •Теплотворная способность
- •Добыча, потребление и значение ископаемого топлива
- •Лекция 5
- •Лекция 6
- •Классификация вв
- •Физико-химические характеристики вв Консистенция и структура
- •Физическая стабильность вв
- •Реакции взрывчатого превращения
- •Лекция 7
- •4.2. Общие сведения о взрывчатых веществах
- •Лекция 8
- •Физико-химические характеристики вв
- •Классификация вв
- •Инициирующие вв
- •Бризантные вв
- •Бризантные вв повышенной мощности
- •Лекция 9
- •Нитроглицериновые вв нормальной мощности
- •Вв, находящееся в стадии исследований
- •Жидкие вв и жидкие смесевые вв
- •Вв жидкие смеси
- •Оксиликвиты
- •Суррогатные вв
- •Лекция 10
- •Взрывная волна
- •Лекция 11
- •Лекция 12
- •Лекция 13
- •Лекция 14
- •Если нельзя применять диоксид углерода (например, при горении металлов
- •Лекция 15
- •Лекция 16
- •Лекция 17
- •Строительные материалы. Строительные конструкции. Сравнительная оценка пожарной опасности лакокрасочных покрытий. Эвакуация людей при пожаре
- •Библиографический список рекомендуемой литературы
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тульский государственный университет»
Кафедра «Аэрологии, охраны труда и окружающей среды»
Машинцов Е.А.
д.т.н., доцент
Конспект лекций
по дисциплине
“Теория горения и взрыва”
Направление подготовки: 280700 «Техносферная безопасность»
Профиль подготовки: «Безопасность технологических процессов и производств»
Квалификация (степень) выпускника: бакалавр
Форма обучения: очная
Тула 2012 г.
Лекция 1
ВВЕДЕНИЕ. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ. СВОЙСТВА ТВЕРДЫХ ТОПЛИВ И ПРОДУКТОВ СГОРАНИЯ. СОПРИКОСНОВЕНИЕ МЕЖДУ ТОПЛИВОМ И ВОЗДУХОМ. МЕХАНИЗМЫ ОКИСЛЕНИЯ. ПРОЦЕССЫ ГОРЕНИЯ. ГОРЕНИЕ КАПЕЛЬ И АЭРОЗОЛЕЙ. ГОРЕНИЕ ОТДЕЛЬНЫХ КАПЕЛЬ. ГОРЕНИЕ АЭРОЗОЛЕЙ. ОПРЕДЕЛЕНИЕ РАВНОВЕСНОГО СОСТАВА И ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ ПРОДУКТОВ СГОРАНИЯ
Горение используется человечеством на протяжении более миллиона лет и является одной из древнейших технологий. В настоящее время около 90% всей энергии, потребляемой нашей цивилизацией (выработка электроэнергии, получение тепла, транспорт и т. д.), обеспечивается именно процессами горения. Это обстоятельство и определяет актуальность исследования процессов горения.
Основные определения
Для количественного описания процессов горения необходимо знать основные определения и понятия.
Химическую реакцию можно рассматривать как процесс обмена и перераспределения атомов между сталкивающимися молекулами. В ходе химической реакции, например:
HCN + OH CN + H2O,
атомы (важнейшие для горения: C, H, O, N) сохраняются (т. е. создаются и не разрушаются). С другой стороны, молекулы (HCN, OH, CN, H2O) не сохраняются. Молекулы исходного вещества в ходе химической реакции превращаются в продукты реакции с одновременным выделением тепла.
Количество атомов и молекул удобно выражать в терминах количества вещества либо количества молей вещества. Один моль вещества соответствует 6,0231023 частиц (атомов и молекул). Число NA=6,0231023 моль-1 носит название числа Авогадро. Мольная доля xi компонента i к полному числу молей n=ni смеси (xi=ni/n).
Масса m является фундаментальным свойством вещества (кг). Массовая доля wi –это отношение массы mi компонента i к полной массе смеси m=mi (wi=mi/m).
Молекулярная масса (или молекулярный вес) Mi (г/моль) компонента i –это масса одного моль данного компонента. Средняя молярная масса смеси М может быть выражена через мольные доли компонентов (М=хМi).
Часто массовые доли выражаются в процентах (массовых и мольных). Можно показать, что выполняются следующие соотношения между приведенными выше величинами (S обозначает число различных компонентов):
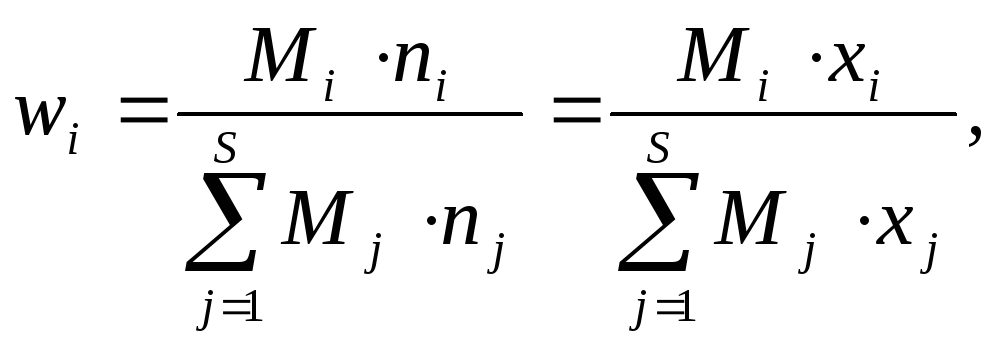 (1)
(1)
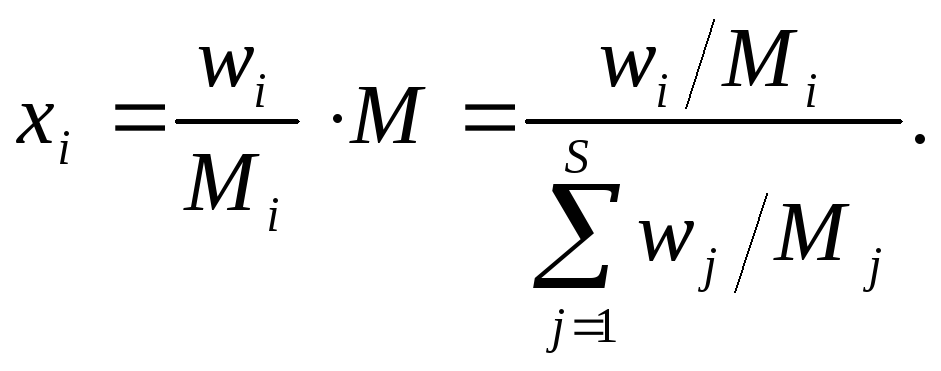 (2)
(2)
Плотности не зависят от размеров системы. Такие переменные называются интенсивными и определяются как отношение соответствующих экстенсивных переменных (которые зависят от размера системы) к объёму системы V. Примером интенсивных переменных являются:
массовая плотность (плотность) =m/V (кг/м3),
молярная плотность (концентрация) c=n/V (моль/м3).
Средняя молекулярная масса выражается соотношением
![]() (3)
(3)
Для газов и газовых смесей , участвующих в процессах горения, уравнение состояния связывает температуру, давление и плотность газа. Для многих условий вполне оправдано использование уравнения состояния идеального газа:
рV=nRT,
где р –давление
(Па), V
– объём (м3),
п – число молей (моль), Т – абсолютная
температура (К), R
– универсальная газовая постоянная,
равная 8,314 Дж/(моль К). из этого уравнения
следует, что
![]()
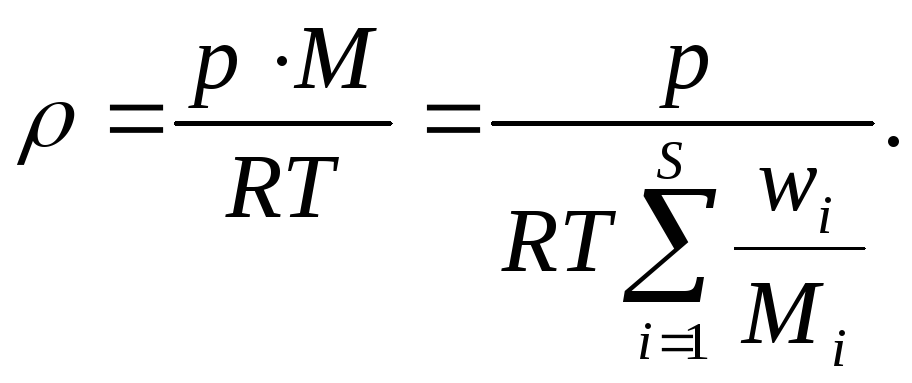
Свойства твердых топлив и продуктов сгорания
При оценке твердых веществ, использование которых в качестве топлив наиболее вероятно, важными характеристиками являются количество энергии, выделяемой в результате химической реакции, температура пламени, а также природа продуктов сгорания, так как тяга двигателя зависит от количества движения потока выбрасываемых газов.
Тепло, выделяемое при сгорании топлива, является мерой наибольшей энергии, которая может быть сообщена рабочему телу. Получение высоких температур и, таким образом, больших количеств движения зависит от количества тепла, выделяемого в экзотермической реакции, а также от термической устойчивости продуктов сгорания. Леонард и Гроссе составили список веществ, обладающих высокими теплотами горения. В таблице 1 производится сравнение этих веществ с обычным углеродным и типичным жидким топливом. Приводятся также плотности топлив, так как при использовании их в двигателях оказывается важным не только количество тепла на единицу веса топлива, но и объем, занимаемый топливом. Как видно, некоторые твердые топлива обладают высокой весовой и объемной теплотворностью.
Для создания пламени с высокой температурой необходимо иметь большое тепловыделение в реакции с устойчивыми продуктами сгорания. Для веществ, образующих при обычной температуре только газообразные продукты, основной процесс поглощения энергии состоит в термической диссоциации. Существование несконденсировавшихся продуктов реакции также вызывает значительное уменьшение величин тепловыделения при горении, приведенных в таблице 1.
Таблица 1
|
Топливо |
Продукт сгорания |
Плотность топлива, г/см3 |
Теплотворность | |
|
Ккал/г |
Ккал/см3 | |||
|
Уголь |
CO |
1.3-1.7 |
1.8-2.3 |
2.3-3.9 |
|
CO2 |
6.4-8.1 |
8.3-13.8 | ||
|
Керосин |
H2O,CO2 |
0.74 |
11.5 |
8.5 |
|
Литий |
Li2O |
0.53 |
10.3 |
5.5 |
|
Бериллий |
BeO |
1.84 |
16.2 |
29.8 |
|
Бор |
B2O3 |
2.34 |
13.8 |
32.3 |
|
Магний |
MgO |
1.74 |
5.88 |
10.2 |
|
Алюминий |
Al2O3 |
2.70 |
7.35 |
19.7 |
|
Кремний |
SiO2 |
2.35 |
7.22 |
16.9 |
|
Кальций |
CaO |
1.55 |
3.79 |
5.9 |
|
Цирконий |
ZrO2 |
6.44 |
2.83 |
18.2 |
|
Лантан |
La2O3 |
6.16 |
1.65 |
10.2 |
|
Гафний |
HfO2 |
13.3 |
1.52 |
20.2 |
|
Торий |
ThO2 |
11.3 |
1.26 |
14.2 |
В таблице 2 приведены температуры фазовых переходов для продуктов горения некоторых топлив, помещенных в таблице 1. Величина теплоты
испарения В2О3, равная 77 ккал/молъ, и величина теплоты возгонки ВеО, равная 145,4 ккал/молъ, указывают на то, что эти процессы требуют значительно больших энергий, чем процесс плавления. Вольфгард и Паркер приводят температуру кипения для окиси алюминия 2980°С, а для окиси магния 2800°С.
Ввиду трудностей измерения высоких температур пламени и отсутствия термодинамических данных, необходимых для вычисления этих температур, рассматриваемые топлива мало исследованы. Были проведены некоторые измерения температур пламени алюминия и магния. Скартаццини получил температуры: 3200°С для алюминия и 2500°G для магния. Вольфгард и Паркер определяли «истинные» температуры методом обращения спектральных линий и путем построения кривых абсолютной интенсивности излучения, которые сравнивались с теоретическими кривыми излучения черного тела. По их данным «истинная» температура пламени для алюминия составляет 3000°С, а для магния 2800°С.
Таблица 2
|
Соединение |
Молекулярный вес |
Температура плавления, оС |
Температура кипения, оС |
Теплота плавления, ккал/моль |
|
Li2O |
29,88 |
1700 |
|
|
|
BeO |
25,02 |
2550 |
3900 |
|
|
B2O3 |
69,64 |
450 |
1250 |
5,27 |
|
MgO |
40,32 |
2800 |
|
18,5 |
|
Al2O3 |
101,94 |
2040 |
2250 |
26 |
|
SiO2 |
60,06 |
1700 |
2230 |
2 |
|
CaO |
56,08 |
2600 |
2850 |
12 |
|
ZrO2 |
123,22 |
2677 |
4300 |
20,8 |
|
La2O3 |
325,84 |
2305 |
4200 |
|
|
HfO2 |
210,60 |
2777 |
|
|
|
ThO2 |
264,12 |
3050 |
4400 |
|
Соприкосновение между топливом и воздухом.
Первая стадия процесса горения состоит в том, что топливо приводится в соприкосновение с воздухом так, чтобы могла осуществиться реакция. В случае дисперсных топлив этот процесс включает в себя распиливание и перемешивание. Для летучих топлив испарение может происходить так, что часть процесса перемешивания идет в газообразной фазе.
Очевидно, что те твердые топлива, у которых температуры кипения ниже температуры пламени, могут быть расплавлены и рассматриваться как жидкие топлива. Один из методов распыливания твердых топлив указанным образом был применен для алюминия. Алюминиевая проволока проходила через углеводородное пламя, и жидкий металл распиливался струей воздуха..
Твердые топлива могут применяться вместе с жидким топливом-носителем. Горение угольных эмульсий было рассмотрено в работе, а также Бауманом и Леонардом, которые предложили применять в таком виде некоторые твердые ракетные топлива. Если судить по поверхностному натяжению, вязкости и плотности топлив, то распыливание таких эмульсий должно происходить так же, как и распыливание обычных жидких топлив.
Процессы дробления топлива могут быть полностью устранены, если твердое вещество вводится в камеру сгорания в виде пыли. Так использовался уголь в камере сгорания высокой теплопроизводительности для газовой турбины. Если струя воздуха направлена снизу вверх через облако частиц различных размеров и конечная скорость этих частиц (измеренная при свободном падении в покоящемся воздухе) меньше, чем скорость воздуха, то они переносятся газовым потоком. Конечная скорость w для ламинарного потока рассчитывается по формуле (1):
![]() (1)
(1)
где dр – диаметр частицы, р – её плотность, g –плотность воздуха, vg – кинематическая вязкость воздуха, Клам – постоянная, зависящая от формы частицы.
Для турбулентного потока:
 (2)
(2)
Для сфер Клам = 54,5, а КТ = 25,4, если диаметр частицы d выражен в сантиметрах, а скорость w — в см/сек.
При действительном переносе по трубе частицы будут сталкиваться друг с другом и со стенками трубы, поэтому требуемая скорость потока должна превышать конечную скорость оседания частиц. Далла Балле получил следующее уравнение переноса частицы:
![]() (3)
(3)
В случае воздуха постоянные горизонтального переноса равны К=2,10*103 и n=0,4, а постоянные вертикального переноса равны К=3,86*103 и n=0,6 (скорость воздуха u выражена в см/сек, а диаметр d – в сантиметрах).
Если в результате распыления частицы уже распределены в воздушном потоке, то затем они подвергаются турбулентному перемешиванию. Движение твердых частиц в турбулентном потоке подчиняется закону для жидких частиц. Уравнения являются более точными для твердых частиц, чем для жидких, так как при определении траектории предполагалось, что частицы являются твердыми и не испаряются.
Проблемы распыления и перемешивания исключаются, если применяются шашки твердого топлива.
Испарение твердого топлива обычно рассматривается как часть процесса горения. В большинстве случаев испарение играет пренебрежимо малую роль в стадиях распиливания и перемешивания, так как для этих топлив температура недостаточно высока, чтобы вызвать заметное повышение давления паров.
Механизмы окисления
Испарением твердых топлив до процесса горения во многих случаях можно пренебречь. Вследствие этого первые стадии реакции, особенно те, которые приводят к воспламенению, будут зависеть от механизма и скорости поверхностных реакций. Эти реакции поднимают температуру поверхности до такой величины, при которой сможет происходить горение и испарение топлива. При этом существует большое различие между твердыми и жидкими топливами, так как, очевидно, все процессы окисления углеводородных топлив происходят в паровой фазе.
Имеется большое количество работ, посвященных исследованию механизма горения угля и низкотемпературного окисления металлов, которые будут здесь рассматриваться как твердые топлива. Очень мало результатов получено о механизме высокотемпературного окисления любых твердых топлив, за исключением угля. Проведены некоторые исследования реакций металлов с азотом, в результате которых возникают нитриды, возможно, играющие большую роль при горении металлических топлив в воздухе.
Изучение горения углерода при атмосферном давлении, ближе связанное с условиями, имеющими место в реактивных двигателях, показало, что образуются и окись, и двуокись углерода. Их отношение зависит от состава топлива и условий, в которых происходит горение. Имеется несколько возможных реакций:
1) образование СО и СО2 в результате поверхностной реакции между С и О2;
2) образование СО2 из С и О2 на поверхности и частичное преобразование СО2 в СО;
3) образование СО на поверхности из С и Оа или из С и СО2, а затем окисление СО в СО2 путем реакции, происходящей в газовой фазе.
При теоретическом изучении горения частиц топлива Сполдинг учитывает влияние диффузии на горение частиц и приводит экспериментальные данные, подтверждающие наличие такого процесса, когда на поверхности происходит реакция между С и СО2 при высокой температуре с последующим окислением СО в газовой фазе. Артур, Бангхэм и Бауринг и Мертенс с определенностью показали, что третий процесс, в котором происходит окисление углерода до окиси углерода, является преобладающим. Наблюдается согласование результатов исследований при высоком и низком давлениях, полученных Стриклендом-Констэблем, в том, что окись углерода является первичным продуктом при поверхностном окислении углерода. В каком виде кислород подходит к поверхности — как-свободный кислород или двуокись углерода,— еще не известно; по-видимому, могут происходить оба процесса, в зависимости от условий горения.
Хотя достигнуты значительные успехи, точная природа деталей механизма горения углерода еще не известна, особенно в отношении количественной стороны процесса окисления.
Широко изучалось медленное (без горения) окисление металлов, но большинство исследований проводилось при низких температурах с целью изучения коррозии. Лейдлер описал механизм некоторых одностадийных поверхностных процессов. Гульбрансен изложил некоторые теоретические и экспериментальные работы о росте оксидных пленок, применив к этой проблеме теорию переходного состояния диффузии. Относительные физические и кристаллографические свойства металла и его окисла определяют скорость окисления. Так как эти свойства зависят от температуры, то последняя может влиять на закон, управляющий ростом пленки.
Процессы горения
Когда частица уже воспламенилась, скорость горения определяет скорость выделения энергии. Многие теоретические и экспериментальные работы были посвящены вопросу горения единичных частиц твердого топлива. Горение пылевых облаков или слоев топлива представляет собой более сложную проблему. Работы по горению единичных частиц дают основу для определения скоростей горения в более сложных системах.
Нуссельт, рассматривая процесс диффузии кислорода к поверхности сферической частицы и предполагая, что на поверхности происходит непосредственное преобразование углерода в двуокись углерода, а располагаемый запас воздуха ничем не ограничен, вывел следующее выражение для времени горения частицы:
![]() (4)
(4)
где r0 — начальный радиус частицы, Vmin — объем воздуха, необходимый для сжигания единицы веса частицы, а Tm — средняя температура реакции, определяемая уравнением:
![]() (5)
(5)
где (ТS)р — температура поверхности частицы, а То — начальная температура воздуха. Согласно уравнению (5) время горения пропорционально квадрату радиуса частицы. Если предположить, что запас воздуха ограничен, то концентрация кислорода уменьшается по мере выгорания частицы. Нуссельт учел это изменение концентрации кислорода в течение процесса горения и получил выражение (5), умноженное на функцию концентрации кислорода. Для системы, содержащей на 20% больше воздуха, чем стехио-метрическое количество, время горения по Нуссельту в 2,67 раза больше, чем при неограниченном запасе воздуха. Другие исследования скорости горения угольных частиц в неподвижном газе, в котором диффузия рассматривается как процесс, определяющий скорость. Харлей также подсчитал время горения угольных частиц при сильно упрощающих предположениях, полагая, что диффузия является определяющим процессом. Его вычисления во всех случаях давали результаты, превышающие измеренные времена горения угольных частиц. Харлей указывает, что в отличие от углерода или графита при горении угля, содержащего летучие вещества, испарение этих веществ может расщепить угольную частицу на более мелкие частицы, имеющие большую скорость горения, или создать сферу с дырчатой структурой, известную под названием «ценосферы». Рассматривая такие сферы, Харлей подсчитал, что время их горения составляет 1/50 времени горения первоначальной угольной частицы, и, таким образом, привел свои результаты в согласие с экспериментом. Орнинг подтвердил существование ценосфер при горении угля.
Хотя уравнения для скоростей горения отдельных частиц твердого топлива дают результаты, хорошо согласующиеся с экспериментальными данными, эти уравнения нельзя строго применить для описания более сложного процесса, который происходит в камере сгорания реактивного двигателя.
Увеличение времени пребывания частиц играет большую роль для увеличения доли сгорающего топлива в камерах сгорания вихревого типа, в которых воздух циркулирует так, что большие частицы остаются в камере длительное время и лишь очень малые частицы определённого размера быстро покидают её, благодаря чему уменьшается потеря эффективности, вызванная несгоревшим топливом. Мелкость угля и время пребывания являются важными характеристиками, от которых зависит полнота сгорания топлива.
Горение капель и аэрозолей
Горение жидких топлив совершается путём впрыскивания жидкого топлива через отверстие (сопло) в газовую фазу, в которой и происходит горение. Турбулентность внутри потока жидкости (специально создаваемая за счёт большого градиента скорости внутри инжектора) вызывает распад выходящего из инжектора потока жидкости на «клубок» жидких нитей, который впоследствии превращается в плотное облако капель, за счёт баллистического движения проникающих сквозь газ в зону горения. Перенос тепла к каплям вызывает увеличение давления пара и, таким образом, испарение топлива в газовую фазу, пока не начнется горение в газовой фазе. Каплю или ансамбль капель окружает (хотя бы частично) пламя предварительно не перемешанной смеси. Важно отметить, что в конечном итоге горит не жидкость сама по себе, а пары этой жидкости. Совокупность всех этих одновременно протекающих процессов называется струйным горением. Обычно исследователи, изучающие модели струйного горения, сосредотачивают свое внимание на двух проблемах.
1. Горение отдельной капли. Если имеется возможность исследовать отдельно фундаментальные физико-химические процессы, которые происходят при струйном горении, то целесообразно сосредоточить внимание на горении отдельной капли. В этом случае можно применить очень детальные модели для описания химических реакций, испарения и молекулярного переноса (массы и энергии) в газовой фазе, в капле и на межфазной границе.
2. Струйное горение. При моделировании практически важных систем (таких как камера сгорания реактивного двигателя, дизельный двигатель или бензиновый двигатель внутреннего сгорания с прямым впрыском топлива) в модель должны быть включены субмодели для всех физических процессов. Как уже отмечалось, все эти субмодели разрабатываются до определенного уровня детализации так, чтобы глобальная модель не требовала слишком больших вычислительных ресурсов. Например, разрушение струи, дробление капель, испарение капель, турбулентное перемешивание, газофазная химическая кинетика и ряд других процессов очень часто описываются при помощи упрощенных моделей, часто называемых глобальными или редуцированными моделями.
Взаимосвязь горения отдельной капли и струйного горения аналогична взаимосвязи моделей ламинарного пламени, которые внедряются в модели турбулентного горения.
Горение отдельных капель
При исследовании процесса горения отдельной капли неявно предполагается, что горение плотного облака, состоящего из множества капель, которые образуются из струи жидкого топлива, можно рассматривать как горение ансамбля отдельных капель. Это неявное предположение аналогично предположению о том, что турбулентные пламена можно моделировать, если рассматривать их как ансамбль ламинарных пламен. Оба предположения привели к лучшему пониманию процессов горения. Таким образом, детальное понимание процессов горения отдельной капли является необходимым для лучшего понимания горения ансамблей капель, т.е. струйного горения.
Модель можно в значительной степени упростить, если принять сферическую симметрию капель, поскольку после этого математическая модель становится одномерной. Первым шагом на пути построения модели горения капли является моделирование ее испарения. Такие модели легко обобщаются на случай горения капель путем введения дополнительного условия о возникновении сферического пламени предварительно не перемешанной смеси, окружающего каплю. Эти «прозрачные» аналитические модели удается построить ценой следующих вынужденных предположений: квазистационарность (т.е. процессами начального прогрева и перехода к воспламенению пренебрегается); быстрые химические реакции; идентичность процессов переноса тепла и массы (число Льюиса равно единице); постоянство таких параметров, как коэффициент теплопроводности А, удельная теплоемкость ср и произведение pD, и их независимость от температуры Т. Анализ дает для массы mf, испаряющейся в единицу времени:
![]() при
при
![]() (7)
(7)
где d — диаметр капли, г — коэффициент теплопроводности в газовой фазе, cP,г — удельная теплоемкость газовой фазы, hкомб/v— удельная энтальпия процесса горения, деленная на стехиометрическое отношение массы окислителя и топлива, Т — Ts — разность температур в газовой фазе вдали от капли и на поверхности капли, hf,г— энтальпия образования газовой фазы. Параметр В называют числом Сполдинга. Поскольку скорость испарения дается выражением:
![]() (8)
(8)
получаем
![]() (9)
(9)
Интегрирование приводит к хорошо известному d2 - закону для времени жизни капли:
![]() при
при
![]() (10)
(10)
Можно видеть, что массовая скорость горения лишь слабо (логарифмически) зависит от свойств топлива (энтальпии процесса горения hкомб, энтальпии испарения hf,г) и прямо связана со свойствами окружающего каплю газа и начальным диаметром капли. Удвоение начального диаметра увеличивает время сгорания капли в четыре раза и, следовательно, камера сгорания должна быть длиннее. В пределе hкомб = 0 и происходит только испарение капли.
Эта информация получена из аналитических моделей. Однако в случае численных моделей все перечисленные выше предположения могут быть в значительной степени ослаблены. Если включить детали для всех субмоделей, то вычисления по такой схеме называют компьютерным моделированием.
Моделирование включает решение уравнений сохранения в газовой фазе, в капле и на межфазной границе. Эта система может быть реализована экспериментально, когда отдельные капли инжектируются в камеру сгорания, наполненную горячими продуктами сгорания. Для того чтобы избежать в эксперименте гравитационных эффектов, которые возмущают сферическую симметрию, газообразные продукты сгорания отводятся вниз со скоростью капли; еще лучше, если камера сгорания располагается в башне на специальной падающей опоре, когда гравитация равна нулю на короткое время проведения эксперимента. (Отметим, что в численной модели эффект гравитации легко вводится; для аналитических моделей учет этого эффекта — гораздо более трудная проблема.)
Различают три фазы горения капли, которые характеризуются различными физическими явлениями.
I. Фаза прогрева. Тепло из газовой фазы вызывает нагрев поверхности капли. Энергия передается в каплю до тех пор, пока вся капля не достигнет температуры кипения; после этого она начинает терять значительную часть своей массы.
И. Фаза испарения топлива. Топливо испаряется в газовую фазу и образуется горючая смесь; размер капли уменьшается со временем пропорционально квадрату диаметра капли (d2-закон).
III. Фаза горения. Смесь воспламеняется и горит как ламинарное сферически симметричное пламя предварительно не перемешанной смеси; диаметр капли теперь; опять уменьшается со временем по d2-закону, но с другим параметром К (см. уравнение (10)).
Расчеты показывают, что предположение об установлении квазистационарного состояния, необходимое для аналитического решения, является слишком большим упрощением; оно ведет к недооценке времени жизни капли приблизительно на 50%; если бы в качестве критерия для конструирования камеры сгорания использовалась аналитическая модель, то камера сгорания была бы слишком короткой. Со временем температура капли достигает стационарного состояния, когда теплопроводность к ней уравновешивается процессом испарения жидкости с поверхности капли. Этот временный баланс приводит к временно постоянной скорости испарения. На основании упрощенной трактовки процесса испарения, было показано, что квадрат диаметра капли линейно уменьшается со временем: d(d2)/dt=const, где величина константы зависит от различных свойств капли и окружающей каплю газовой фазы. Из-за большого разнообразия физико-химических процессов, вовлеченных в процесс горения, некоторые аспекты горения капель зависят почти от всех субмоделей сразу. Например, для практических приложений важно знать величины задержек воспламенения. Самовоспламенение происходит, когда температура достаточно высока и когда в том же месте испарение локально поддерживает состав горючей смеси в течение времени, достаточного для довольно длинной последовательности химических реакций, чтобы преодолеть период индукции и привести смесь к воспламенению. Для предсказания таких эффектов необходимо численное моделирование, поскольку аналитические модели просто не содержат в себе деталей, необходимых для таких предсказаний.
Обычно задержки воспламенения увеличиваются с ростом радиуса капель. Это вызвано тем обстоятельством, что для испарения капель тепло отбирается из газовой фазы. Отклонения от такого поведения наблюдаются для очень мелких капель с малым диаметром, поскольку они полностью испаряются еще до момента воспламенения горючей смеси.
На практике капли обычно движутся с определенной скоростью относительно окружающего газа. Это может быть вызвано, например, впрыском аэрозоля топлива или турбулентностью потока. Поэтому важно понять, как влияет поле скоростей потока на воспламенение и горение капель.
Большинство жидких топлив получают перегонкой нефти, и они состоят из сотен компонентов с различными температурами кипения. Когда капля нагревается, вначале испаряются наиболее летучие жидкие фракции, за ними — фракции со средней летучестью (и поэтому с более высокой температурой кипения). Наконец, испаряются фракции с низкой летучестью (как, например, вязкие масла). К счастью, самовоспламенение происходит на ранних стадиях указанной последовательности событий, так что испарение труднолетучих фракций стимулируется пламенем, которое к этому времени уже охватывает оставшуюся часть капли.
Горение аэрозолей
Первым шагом на пути моделирования горения струй аэрозолей является предположение, что горящая струя аэрозоля представляет собой просто ансамбль отдельных невзаимодействующих горящих капель. Капли образуются из струи в виде плотного облака с широким диапазоном размеров. Однако неизвестно, как эти капли различных размеров взаимодействуют друг с другом и с окружающим турбулентным потоком газов. Для ответа на эти вопросы необходимо разделить весь процесс горения на стадии образования ансамбля аэрозольных частиц, движения капель, испарения капель и собственно горения.
Аэрозоль образуется при разрушении струи топлива (поступающей из впускного отверстия) за счет поперечных сил сдвига во время впрыска в камеру сгорания. Этот процесс аналогичен образованию турбулентных структур в слоях с поперечным градиентом скорости. Жидкие фрагменты, которые еще не имеют сферической формы, попадают в поток окислителя и продуктов сгорания (обычно турбулентный и с рециркуляцией). Распределение диаметров капель в ансамбле аэрозоля не однородно. Оказалось весьма полезно характеризовать распределение диаметров различными нестационарными функциями распределения по размерам, моменты которых изменяются со временем. Вид функции распределения и ее последующая эволюция определяются главным образом природой инжектируемого топлива и свойствами потока в камере сгорания (например, граничными условиями).
Испарение капель и диффузия топлива в газовую фазу приводят к образованию горючей смеси, которая воспламеняется при достаточно высокой температуре. Если рассматривать разбавленный аэрозоль (когда расстояние между каплями велико), то процессы в течение воспламенения и горения можно понять, исследуя поведение отдельных капель. В плотных аэрозолях, однако, капли расположены слишком близко друг к другу для того, чтобы можно было пренебречь их взаимодействием. Горение такой системы происходит в криогенных ракетных двигателях. Последние весьма эффективны, что очень важно для запуска космических спутников связи. Надежное моделирование в этом случае помогает сократить количество очень дорогостоящих экспериментов в криогенных условиях, которые характерны для ракетных двигателей (Т100 К и р = 400 бар).
Капли жидкого кислорода с начальным диаметром 50 мкм и начальной температурой 85 К попадают в ламинарный однородный поток горячего водорода с температурой 1500 К, давлением 10 бар и скоростью потока газа 25 м/с. Если расстояние между двумя каплями достаточно мало, то обе они окружены одной общей зоной пламени предварительно не перемешанной смеси. В противном случае две капли образуют две отдельные зоны пламени. Эти численные эксперименты количественно показали увеличение времени полного выгорания капли и, таким образом, могут помочь в процессе конструирования ракетных двигателей.
Учитывая, что горение струи аэрозоля является процессом сложного взаимодействия многих самых разных процессов, таких как прогрев капель, испарение, воспламенение, горение, взаимодействие различных капель, взаимодействие горения капель с турбулентным потоком и т.д., становится очевидным, что моделирование горения струй аэрозолей представляет собой сложную, но перспективную проблему. Как и в случае турбулентного горения одной единственной фазы, вычисление из первых принципов (т.е. с использованием прямого численного моделирования) невозможно, но, как и в случае газофазных процессов горения, информация, полученная путем прямого численного моделирования о горении отдельных капель и ансамбля капель, может быть уточнена и затем включена в модели горения струй аэрозолей.
Если облако аэрозолей очень плотное, плотность топлива в его внутреннем ядре столь высока, что имеет место насыщение и капли не испаряются. Ближе к окружающему воздуху происходит испарение и образуется облако пара топлива, которое затем диффундирует в окислитель, образуя пламя предварительно не перемешанной смеси. Этот режим горения называется «внешнее горение с испарением оболочки». При более низких плотностях облака аэрозоля все капли испаряются, но зона пламени все еще располагается на границе между паром топлива и окружающим окислителем («внешнее горение с отошедшим пламенем»). Если облако аэрозоля разбавлено сильнее, некоторые капли оказываются в окружении избытка окислителя. Эти капли будут окружены фронтами индивидуальных пламен, но, тем не менее, все еще будет существовать зона пламени на границе плотного облака капель и окислителя («внутреннее горение» с основным пламенем внутри границы аэрозоля). В разбавленных аэрозолях происходит горение отдельных капель. Конечно, перечисленные четыре различные режима представляют собой лишь грубую характеристику, и между этими предельными случаями существует много промежуточных режимов. При переходе от внешнего к внутреннему режиму горения можно наблюдать зоны пламени вокруг небольших групп капель.
Также как и в случае горения в газовой фазе, исследования капель в пламенах с противотоком позволяют понять различные взаимодействия капля-пламя. Уже отмечавшаяся выше простота одномерной конфигурации позволяет включить в модель детальную химическую кинетику и процессы переноса.
Поскольку горение аэрозолей, как и горение капель, является типичным процессом горения предварительно не перемешанной смеси, использование моделей суперпозиции очагов ламинарных пламен является оправданным. Эти очаговые модели могут быть объединены с моделями испарения капель. Такая модель использовалась, например, для моделирования двигателя, работающего на н-октане.
Двигатели с прямым впрыском топлива объединяют преимущества дизельных двигателей и двигателей внутреннего сгорания (двигателей Отто). Топливо инжектируется непосредственно в цилиндр в течение фазы сжатия. Воспламенение инициируется свечой зажигания вблизи зоны перемешивания горючего и воздуха. В зоне воспламенения смесь богатая, что поддерживает процесс воспламенения. С другой стороны, состав всей смеси бедный, что снижает образование окислов азота. Результирующие температуры и массовые доли окислов азота показаны на рис. 15.8 для двух характерных случаев (частичной и полной нагрузки для угла поворота коленчатого вала, равного 5° до верхней мертвой точки). Эти расчеты оказались очень успешными.
Несмотря на упрощения во многих субмоделях (включая динамику потока аэрозоля, испарение капель, искровое зажигание, распространение и тушение пламени), описанные модели содержат достаточно существенных элементов для того, чтобы оказать неоценимую помощь при конструировании новых двигателей, таких как двигатели с прямым впрыском топлива, и даже новой концепции управляемого стука в двигателе с гомогенной смесью, воспламеняемой сжатием.
Определение равновесного состава и термодинамических свойств продуктов сгорания
Состав и термодинамические свойства равновесных продуктов горения однозначно зависят от элементарного состава, температуры и давления (или объёма системы). В частности, при определённых температуре и давлении они не будут зависеть от теплоты образования горючих веществ или от их теплоты реакции. (однако эти величины будут определять тот диапазон температур, в котором вычисляются состав и термодинамические свойства продуктов сгорания, так как они определяют начальную энергию системы.)
Например, равновесный состав и термодинамические свойства продуктов горения горючей смеси: 6С+3Н2+4О2, 3С2Н2+4О2 и С6Н6+4О2 – для любых выбранных температур и давлений являются идентичными. Температуры пламени, количества выделяющегося тепла или соответствующие значения работы сильно отличаются вследствие различных начальных энергий этих систем. Величины этих энергий определяются из основных уравнений сохранения энергии.
Равновесный состав продуктов сгорания. Условия равновесия для продуктов горения могут быть получены из термодинамических данных и суммарного содержания элементов. Для многих реакций величины констант равновесия могут быть вычислены либо из результатов опытов, либо по данным спектроскопических измерений. В некоторых случаях константы равновесия можно вычислить, исходя из величин свободной энергии.
При выборе компонентов, которые считаются существенными и соответствуют данному равновесному состоянию, всегда имеется элемент произвола.
