
- •Раздел I общие сведения об атмосфере Лекция № 1 Строение и химический состав атмосферы План
- •1.1.Введение
- •1.2. Строение атмосферы
- •1.3. Природный химический состав атмосферы
- •Раздел II техногенные изменения состава атмосферы и их значения Лекция №2 Основные загрязнители атмосферного воздуха План
- •2.1. Твердые частицы
- •2.2. Оксиды серы
- •2.3. Оксиды азота
- •2.4. Оксид углерода и другие продукты неполного сгорания
- •2.5. Предельные допустимые концентрации вредных веществ
- •Раздел III. Образование токсичных веществ
- •32. Оксиды серы
- •3.3. Оксид углерода и другие продукты неполного сгорания топлива
- •Лекция №4 Образование оксидов азота и канцерогенных веществ План
- •4.1. Влияние режимных параметров работы теплогенераторов на образование оксида азота
- •4.2. Превращения оксидов азота в атмосфере
- •4.3. Канцерогенные вещества
- •Лекция №5 Механизм образования оксидов азота в процессе горения топлива План
- •5.3. Образование "топливного" оксида азота
- •5.4. Образование оксидов азота во фронте пламени
- •Лекция №6 Подавление образования твердых частиц, оксидов углерода, оксидов серы и оксидов азота План
- •6.1. Подавление образования твердых частиц
- •6.2. Подавление образования оксидов серы
- •6.3. Подавление образования оксидов азота
- •Лекция № 7 Методы снижения концентрации образующегося оксида азота План
- •7.1. Рециркуляция дымовых газов
- •7.2. Двухстадийное сжигание топлива
- •7.3. Подача воды или пара в зону горения
Лекция №5 Механизм образования оксидов азота в процессе горения топлива План
5.1. Образование <<термического>> оксида азота
5.2. Образование <<быстрого>> оксида азота
5.3. Образование <<топливного>> оксида азота
5.4. Образование оксидов азота во фронте пламени
5.1. Образование <<термического>> оксида азота
В зависимости от механизма образования оксида азота в процессе горения топлива различают "термические", "быстрые" и "топливные" оксиды азота.
Термин "термический" оксид азота получил за то, что в основе механизма его образования лежит зависимость концентрации NOот температуры в зоне горения.
Наиболее полно совокупность явлений, происходящих при окислении азота в топках теплогенераторов может быть описана на основании теории Н.Н. Семенова, Я.Б. Зельдовича и Д.А. Франк - Каменецкого.
Условием окисления азота воздуха является диссоциация молекулы кислорода воздуха под воздействием высоких температур, идущая с поглощением теплоты:
O2О + О - 495 кДж/моль (5.1)
Атомарный кислород реагирует с молекулой азота, а образовавшийся в результате эндотермической реакции атомарный азот вступает в экзотермическую реакцию с молекулярным кислородом
N2 + O NO + N - 314 кДж/моль (5.2)
O2 + N NO + O + 134 кДж/моль (5.3)
N2 + O2 2 NO - 180 кДж/моль (5.4)
Изменение концентрации оксида азота в единицу времени определяется
dCNO/dt k1CN2CO2 - k2CNO2 (5.5)
где CN2,CO2- соответственно концентрацииN2иO2, об. %;CNO- равновесная концентрацияNO, об. % (т.е. концентрация, получающаяся при неограниченного долгом протекании реакции);k1,k2- константы скорости прямых и обратных реакций.
k1= 6106e[-E1/(RT)],E1= 565 кДж/моль (5.6)
k2= 3106e[-E2/(RT)],E2= 385 кДж/моль (5.7)
Равновесная концентрация NOполучается из выражения (5.5) приdCNO/dt= 0 при известных константах скоростей реакций
![]() (5.7)
(5.7)
Из анализа этой формулы следует, что равновесная концентрация оксида азота возрастает с увеличением температуры и концентрации кислорода (концентрация азота меняется мало). Равновесная концентрация NOсвыше 1 г/м3имеет место при температуре более 1600оС и удваивается при повышении температуры на каждые 200...250оС.
В топках теплогенераторов вместо концентрации кислорода принимается величина коэффициента избытка воздуха (). Между коэффициентом избытка воздуха и концентрацией кислорода, г/м3 имеет место следующее соотношение
![]() (5.8)
(5.8)
где Vв.о,Vп.с.о- соответственно теоретические объемы воздуха, необходимого для горения и продуктов сгорания, м3/кг или м3/м3.
Время достижения равновесной концентрации оксида азота определяется как
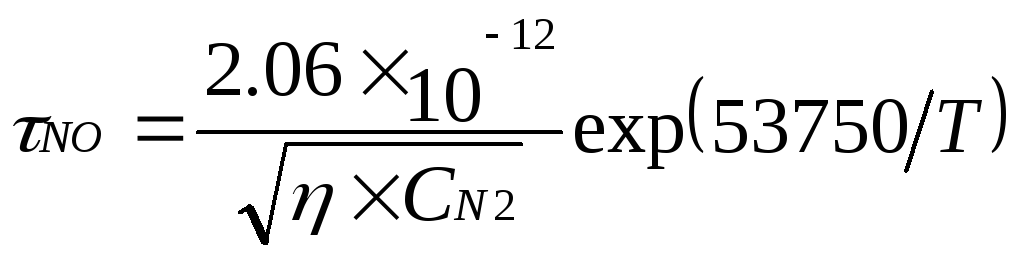 (5.9)
(5.9)
При различных температурах NOимеет следующие значения
|
T, K |
1600 |
1700 |
1800 |
1900 |
2000 |
2100 |
2300 |
2600 |
|
NO, c |
910 |
140 |
22,9 |
4,07 |
1,00 |
0,27 |
0,0031 |
0,0022 |
Время же пребывания продуктов сгорания в топочной камере, а следовательно и в зоне реакции всегда значительно меньше времени достижения равновесной концентрации. Поэтому и концентрация оксида азота в продуктах сгорания в 5...10 раз меньше равновесной.
5.2. Образование <<быстрого>> оксида азота
Для получения равновесных концентраций NOпри горении стехиометрической метановоздушной смеси требуется период времени около 10-2...10-3с, а время протекания реакции горения составляет 10-4с. В результате многочисленных исследований было установлено, что в начальной области пламени имеет место образование значительного количества (40...120 мг/м3) оксида азота, хотя температура в этой зоне не превышает 1500оK.
Вследствие того, что этот оксид азота образовался как бы быстрее, чем это следует из теории Н.Н. Семенова, он получил название "быстрого".
С. Фенимором на основании анализа ряда реакций сделано предположение, что быстрое образование NOобъясняется связыванием молекул азота радикалами СН и С2в реакциях с очень малыми энергетическими затратами:
CH+N2HCN+N- 8,38 кДж/моль (5.10)
2C+N22CN- 16,72 кДж/моль (5.11)
CH2+N2CN+NH- 37,6 кДж/моль (5.12)
Обнаруженные в начальных зонах факела радикалы HCNподтверждают возможность образования некоторого количестваNOс участием выше приведенных реакций.
Кроме того Р. Гаррис зарегистрировал сверхравновесные концентрации ОН в зоне горения и предложил дополнительные реакции, объясняющие появление "быстрого" оксида азота
CN + O2 CO + NO (5.13)
CN + OH CO + NH (5.14)
NH + OH NO + H2 (5.15)
NH + NO N2 + OH (5.16)
Быстрое образование оксида азота во фронте пламени - явление органически связанное с горением и присуще только пламени углеводородов и углерод содержащих топлив. Наиболее характерными признаками быстрого окисления азота в пламени служат:
- кратковременность процесса, в результате чего зона образования NOлокализована на сравнительно небольшом участке фронта пламени;
- слабая зависимость выхода NOот температуры горения;
- сильная зависимость выхода NOот соотношения топливо-воздух и смещение пика концентрацийNOв область богатых горючих смесей.
"Быстрые" оксиды азота образуются непосредственно во фронте ламинарного пламени, на участке составляющем около 10 % ширины фронта пламени. Причем процесс образования начинается уже у передней границы фронта пламени в области температур около 1000 оK.
Выход “быстрых” NOxпри горении природного газа составляет 100...120 мг/м3и не может быть снижен “ступенчатым” (двухстадийным) горением.
