
- •Белки: строение, свойства и функции
- •I.I. Биологические функции белков
- •I.2. Белки и их основные признаки
- •I.3. Аминокислоты – структурные мономеры белков Все аминокислоты, входящие в состав белков, относятся к l-аминокислотам, содержащим аминогруппу (– nh2) в -положении.
- •1) Классификация протеиногенных аминокислот по характеру бокового радикала
- •Ациклические аминокислоты
- •2) Классификация аминокислот в соответствии с полярностью их r-групп (при рН 7)
- •I.4. Физико-химические свойства аминокислот
- •I.4.I. Амфотерные свойства аминокислот
- •I.4.2. Cтереоизомерия аминокислот
- •I.5. Аминокислотный состав белков
- •2. Классификация белков
- •2.I.По растворимости
- •2.2. По форме молекул
- •3. Физические свойства белков
- •4. Структурная организация белковых молекул
- •4.1. Первичная структура белков
- •4.2. Конформация (пространственное расположение) полипептидных цепей в белках
- •4.2.1. Вторичная структура белков
- •4.2.2. Третичная структура белков
- •4.2.3. Способность к специфическим взаимодействиям как основа биологической активности белков
- •4.2.4. Ингибиторы функций белков
- •4.2.5. Четвертичная структура белка.
- •Кинетика оксигенирования миоглобина и гемоглобина
- •5. Изофункциональные белки
- •6. Изменения белкового состава организма
4.2.1. Вторичная структура белков
─ это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют три типа вторичной структуры: -спираль и - структуру (слоисто-складчатый слой) и беспорядочный клубок.
-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. -Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами кислорода одной пептидной связи и атомами водорода четвертой по счету пептидной связи.
![]()
Боковые заместители расположены перпендикулярно плоскости -спирали.
В слоисто-складчатом слое пептидные цепи (или участки одной и той же пептидной цепи) располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
Ч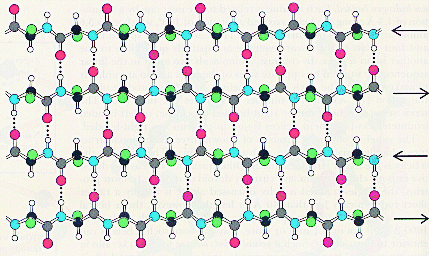 ем
больше пептидных цепей входит в состав
слоисто-складчатого слоя, тем прочнее
молекула белка.
ем
больше пептидных цепей входит в состав
слоисто-складчатого слоя, тем прочнее
молекула белка.
Аминокислоты различаются по способности участвовать в образовании -спиралей и -структур. Редко встречаются в -спиралях глицин, аспарагин, тирозин. Пролин дестабилизирует -спиральную структуру. Объясните, почему? В состав -структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспарагин, гистидин, лизин, серин.
Не вся пептидная цепь имеет правильную структурную организацию, т.е. уложена в -структуры и -спирали. Некоторые участки не имеют какой-либо правильной структурной организации – их обозначают как беспорядочный клубок. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание -структур и -спиралей в разных белках неодинаково.
4.2.2. Третичная структура белков
это трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в пептидной цепи. Гидрофобные радикалы аминокислот имеют тенденцию к объединению внутри глобулярной структуры белков с помощью так называемых гидрофобных взаимодействий и межмолекулярных Ван-дер-ваальсовых сил, образуя плотное гидрофобное ядро. Гидрофильные ионизированные и неионизированные радикалы аминокислот в основном расположены на поверхности белка и определяют его растворимость в воде.
Гидрофильные аминокислоты, оказавшиеся внутри гидрофобного ядра, могут взаимодействовать друг с другом с помощью ионных и водородных связей.
Ионные, водородные и гидрофобные связи относятся к числу слабых: их энергия ненамного превышает энергию теплового движения молекул при комнатной температуре.
Конформация белка поддерживается за счет возникновения множества таких слабых связей.
Третичная структура некоторых белков стабилизирована дисульфидными связями, образующимися за счет взаимодействия SH-групп двух остатков цистеина.
Большинство внутриклеточных белков не имеет ковалентных дисульфидных связей. Их наличие характерно для секретируемых клеткой белков, например дисульфидные связи имеются в молекулах инсулина и иммуноглобулинов.
Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями.
Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре.
Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
