
Новиков Д.К. Медицинская микробиология
.pdfтолько с помощью аэрогенного механизма передачи (респираторная группа инфекций).
Из входных ворот возбудитель распространяется различными путями. В одних случаях он попадает в лимфатические сосуды и током лимфы разносится по органам и тканям (лимфогенный путь распространения). В других случаях возбудитель распространяется с током крови (гематогенный путь распространения). От места входных ворот зависит клиническая картина заболевания. Например, если чумный микроб проникает через кожу, развивается бубонная или кожнобубонная форма, через дыхательные пути – легочная.
Многие возбудители инфекционных заболеваний размножаются внутриклеточно и способны распространяться в межклеточном пространстве различных органов , в связи с чем очень важными компонентами вирулентности являются пенетрация и инвазия, которые, как правило, связаны со способностью микроорганизмов продуцировать ферменты, вызывающие повреждение мембран живых клеток и волокон тканей: гиалуронидазу, нейраминидазу, протеиназы и др.
Инвазия в ткани для многих бактерий – ведущий механизм вирулентности. Некоторые виды сальмонелл проникают в стенку кишечника через контакты эпителиальных клеток.
Агрессия – собирательный фактор вирулентности, определяется способностью микроорганизмов подавлять неспецифическую и иммунную защиту организма с помощью специальных веществ различной природы, встроенных в поверхностные структуры стенки (белок А стафилококка, белок М гемолитического стрептококка, липополисахариды грамотрицательных бактерий, корд-фактор возбудителя туберкулеза, Н-, О- и Vi-антигены энтеробактерий и др.), а также специальных ферментов или токсических метаболитов, которые разрушают и инактивируют иммуноглобулины, комплемент, лизоцим, интерфероны и другие гуморальные и клеточные компоненты иммунитета.
Уклонение от переваривания фагоцитами – распространенный механизм. Одни бактерии, подобно шигеллам в клетках, «скрываются» от макрофагов в клетках, которые их не переваривают. Другие «обходят» механизмы переваривания в самих макрофагах. Так, Legionella pneumophila проникает в альвеолярные макрофаги и индуцирует пневмонии. Прилипание их к макрофагам вызывает появление длинных псевдоподий, которые образуют вокруг легионеллы кольца, формирующие затем пузырьки (кольцевой или спиральный фагоцитоз). Фаголизосомы ингибируются и бактерии размножаются в пузырьках. Микобактерии туберкулеза и бруцеллы живут в цитоплазме вне фагосом, а другие бактерии могут быть резистентны к ферментам фаголизосом. Существуют и иные антифагоцитарные механизмы, в частности, связывание белков хозяина. Стафилококк имеет белок А,
141
который взаимодействует с Fc-фрагментом IgG. Фагоцит может не распознавать такой стафилококк, покрытый IgG.
8.6. Изменение патогенности и вирулентности
Патогенность и вирулентность микробов не постоянна и может изменяться спонтанно или целенаправленно.
Механизмы снижения или утраты вирулентности:
 Мутации генов при воздействии мутагенов различной природы.
Мутации генов при воздействии мутагенов различной природы.
 Утрата плазмид с генами токсинов.
Утрата плазмид с генами токсинов.
Способы понижения вирулентности:
 Длительное культивирование на голодных средах (например, получение вакцины БЦЖ).
Длительное культивирование на голодных средах (например, получение вакцины БЦЖ).
Культивирование в маловосприимчивом организме. Культивирование в восприимчивом организме (антирабиче-
ская вакцина).
 Генно-инженерные манипуляции.
Генно-инженерные манипуляции.
Механизмы индукции или увеличения патогенности и вирулентности:
Спонтанный или индуцированный мутагенез.
Действие умеренных лизогенизирующих фагов (например, у коринебактерий дифтерии).
Приобретение плазмид (энтеробактерии и др.) R-S-диссоциация.
Способы повышения вирулентности:
Пассажи через восприимчивый организм. Генно-инженерные манипуляции.
8.7. Экзотоксины, эндотоксины
Токсическое действие микробов обусловлено синтезом ими экзо- и эндотоксинов. Экзотоксины продуцируются в основном грамположительными микробами (возбудителями дифтерии, столбняка, ботулизма, газовой гангрены и др.) Они выделяются микробами во внешнюю среду. По химической природе они обычно являются термолабильными белковыми веществами, обладающими ферментативными свойствами и избирательно поражающими отдельные органы и ткани. Высокотоксичны, 5 нг/кг ботулинического токсина – смертельны для человека. Экзотоксины изменяют обмен веществ, вызывают выраженные явления интоксикации, сопровождающиеся нарушением деятельности физиологических систем: нервной, эндокринной, дыхательной, сердечно-сосудистой. Они органотропны, напри-
142

мер, экзотоксин возбудителя столбняка избирательно блокирует холинергические структуры двигательных центров спинного и продолговатого мозга, а холероген и некоторые энтеротоксины взаимодействуют с G-белками энтероцитов, что приводит к увеличению выхода жидкости в просвет кишечника и диарее.
По механизму действия токсины делятся на несколько типов. Часть из экзотоксинов прямо повреждает мембраны клеток-
мишеней (порообразующие токсины). Типичным примером такого токсина является -токсин золотистого стафилококка (гемолизин). Он представляет собой грибовидной формы гептамер (7 мономеровсубъединиц) с молекулярной массой 33 кДа, состоящий из трех доменов. Его литическое действие на мембраны клеток-мишеней (моноцитов, лимфоцитов, эритроцитов, эндотелиоцитов) протекает в 3 стадии. На первой стадии мономеры токсина связываются с фосфатидилхолином или холестерином, которые входят в состав клеточных мембран. На второй стадии происходит полимеризация токсина. На заключительной стадии образовавшийся гептамер претерпевает конформационные изменения. Образуется «ножка гриба», которая проходит сквозь клеточную мембрану. В результате в мембране возникает пора, через которую проходят ионы, небольшие молекулы и вода, что приводит к разрушению ядра в ядросодержащих клетках и осмотическому лизису эритроцитов.
Другие экзотоксины нарушают синтез белков. Они блокируют факторы элонгации или связываются с РНК рибосом. В частности, дифтерийный экзотоксин, а также экзотоксин синегнойной палочки вызывают АДФ-рибозилирование фактора элонгации II. Энтеробактерии (шигеллы, кишечные палочки) вырабатывают веротоксины, связывающие рибосомальную РНК, что приводит к расстройству белкового синтеза.
Следующая группа токсинов вмешивается в работу медиаторов и мессенджеров, передающих внутриклеточные сигналы. Примером действия данных токсинов является холероген – экзотоксин холерного вибриона. Подобные токсины состоят из субъединиц двух типов. Субъединица А ответственна за токсичность. У холерогена она представляет собой фермент АДФ-рибозилазу. В результате ее действия происходит АДФ-рибозилирование G-белков энтероцитов с последующей активацией аденилатциклазы. В результате нарастает концентрация внутриклеточного цАМФ, что приводит к диарее. В свою очередь, субъединица В обеспечивает прикрепление токсина к клеточным рецепторам и транспорт его в клетку. Сходным образом через активацию гуанилатциклазы действуют термостабильные экзотоксины энтеротоксигенной кишечной палочки.
143
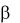
Еще одна группа токсинов выступает в роли ферментов агрессии
иинвазии. Многие бактериальные экзотоксины, такие, как гиалуронидаза, коллагеназа, -гемолизин золотистого стафилококка (сфингомиелиназа) и др., повреждают экстрацеллюлярные структуры или мембраны клеток путем ферментативного гидролиза, что обеспечивает быстрое проникновение и распространение возбудителя.
Часть токсинов-ферментов способна вмешиваться в метаболические процессы, протекающие в тканях. Наиболее сильные из известных биологических ядов, нейротоксины возбудителя ботулизма (ботулотоксин) и столбняка (тетаноспазмин), представляют по механизму действия Zn-зависимые металлопротеазы. Непосредственными мишенями-субстратами для их действия является группа белков, локализованных в пресинаптических мембранах и синаптических пузырьках нервных окончаний. Ботулотоксин связывается с пресинаптической мембраной мотонейронов периферической нервной системы
ивызывает протеолиз белков синаптобревина, синтаксина, везикулоассоциированного протеина и др. Это приводит к блокаде высвобождения ацетилхолина из пресинаптической мембраны и нарушению нервно-мышечной передачи.
Тетаноспазмин повреждает два вида нейронов. Он первоначально связывается с рецепторами пресинаптической мембраны мотонейронов, но далее путем обратного везикулярного транспорта перемещается в спинной мозг, где проникает в тормозные и вставочные нейроны. Мишенями для этого токсина с протеазной активностью являются те же белки (синаптобревин, везикулоассоциированный протеин). Их протеолиз приводит к высвобождению нейромедиаторов (глицина и гамма-аминомасляной кислоты), что в свою очередь, приводит к клоническим и тоническим мышечным судорогам. Протеолитической активностью обладает также экзотоксин возбудителя сибирской язвы (летальный фактор). Он повреждает ферменты внутриклеточного метаболизма, обладающие киназной активностью.
Наконец, некоторые экзотоксины (энтеротоксины, эксфолиатины, токсин синдрома токсического шока золотистого стафилококка, пирогенные токсины гноеродного стрептококка и др.) являются суперантигенами и вызывают поликлональную активацию лимфоцитов с выделением цитокинов. Они обладают выраженным пирогенным действием. Механизм действия данных токсинов заключается в связывании их молекул с вариабельным участком Т-клеточного рецептора к антигену с последующей активацией Т-лимфоцитов. При обычном иммунном ответе антиген прочно связывается лишь с теми Т- лимфоцитами, рецептор которых высокоспецифичен к данному антигену. Вследствие этого в пролиферацию и дифференцировку вступает всего около 0,01-0,1% от общего числа Т-лимфоцитов. Суперантиге-
144

ны же связываются с целой популяцией Т-клеток, у которых имеется 2-субъединица в вариабельном участке Т-клеточного рецептора. В результате в пролиферацию вступает до 20-30% от общего числа Т- лимфоцитов, что приводит к массивному выделению провоспалительных цитокинов клетками иммунной системы (ИЛ-1, ИЛ-2, фактора некроза опухолей, -интерферона). Клинически это проявляется токсическим шоком с лихорадкой, падением давления и диффузной
эритематозной сыпью.
Описано около ста бактериальных токсинов, которые отличаются друг от друга по молекулярной массе, химической структуре, рецепторам к различным клеткам макроорганизма, биологической активности и др. Некоторые из них приведены в табл. 8.
|
|
|
|
Таблица 8. |
|
Основные токсины и механизмы их действия |
|||
|
|
|
|
|
Микроорга- |
Токсин |
Механизм |
Мишень |
Заболевание |
низм |
|
действия |
|
или синдром |
|
Мембраноатакующие |
|
||
|
|
|
|
|
Aeromonas |
Аэролизин |
Образование |
Гликофорин |
Диарея |
hydrophila |
|
пор |
|
|
|
|
|
|
|
Clostridium |
О-перфринголизин |
«-« |
Холестерин |
Газовая гангрена |
perfringens |
|
|
|
|
Escherichia |
Гемолизин |
«-« |
Плазматическая |
Инфекции моче- |
coli |
|
|
мембрана |
выводящих путей |
Listeria mon- |
О-листериолизин |
«-« |
Холестерин |
Пищевые си- |
ocytogenes |
|
|
|
стемные инфек- |
|
|
|
|
ции, менингит |
Staphylococcu |
альфа-токсин |
«-« |
Плазматическая |
Абсцессы |
s aureus |
|
|
мембрана |
|
Streptococcus |
Пневмолизин |
«-« |
Холестерин |
Пневмония |
pneumoniae |
|
|
|
|
Sreptococcus |
О-стрептолизин |
«-« |
«-« |
Тонзилло- |
pyogenes |
|
|
|
фарингит. Скар- |
|
|
|
|
латина |
|
Ингибиторы белкового синтеза |
|
||
|
|
|
|
|
Corynebacteri |
Дифтерийный ток- |
АДФ- |
Фактор элонга- |
Дифтерия |
um difhtheriae |
син |
рибозил- |
ции 2 |
|
|
|
трансфераза |
|
|
145
E. coli, |
Токсин Шига |
N- |
28S pРНК |
Геморрагический |
Shigella dys- |
|
гликозидаза |
|
ко- |
enteriae |
|
|
|
лит,гемолитико- |
|
|
|
|
уремический |
|
|
|
|
синдром |
Pseudomonas |
Экзотоксин А |
АДФ- |
Фактор элонга- |
Пневмония |
aeruginosa |
|
рибозил- |
ции 2 |
|
|
|
трансфераза |
|
|
|
|
|
|
|
|
Активаторы вторичных мессенджеров |
|
||
|
|
|
|
|
E. coli |
Цитотоксический |
Деамидаза |
G-белки- |
Инфекции моче- |
|
некротизирующий |
|
регуляторы ци- |
выводящих путей |
|
фактор |
|
тоскелета |
|
E. coli |
Термолабильный |
АДФ- |
G-белки |
Диарея |
|
токсин |
рибозил- |
|
|
|
|
трансфераза |
|
|
E. coli |
Термостабильный |
Стимулирует |
Рецептор гуа- |
Диарея |
|
токсин |
гуанилат- |
нилатциклазы |
|
|
|
циклазу |
|
|
Bacillus |
Отечный фактор |
Аденилат- |
АТФ |
Сибирская язва |
anthracis |
|
циклаза |
|
|
Bordetella |
Дермонекротиче- |
Деамидаза |
G-белки (регуля- |
Ринит |
pertussis |
ский токсин |
|
торы цитоскеле- |
|
|
|
|
та) |
|
|
Коклюшный ток- |
АДФ- |
|
Коклюш |
|
син |
рибозил- |
G-белки |
|
|
|
трансфераза |
|
|
Clostridium |
Токсин С2 |
АДФ- |
G-актин |
Ботулизм |
botulinum |
|
рибозил- |
|
|
|
|
трансфераза |
G-белки |
|
|
|
|
|
|
|
Токсин С3 |
«-« |
(регуляторы ци- |
Ботулизм |
|
|
|||
|
|
|
тоскелета) |
|
Clostridium |
Токсин А |
Гликозил- |
G-белки |
Диарея/псев- |
difficile |
Токсин В |
трансфераза |
(регуляторы ци- |
домембранозный |
|
|
|
тоскелета) |
колит |
Vibrio |
Холерный токсин |
АДФ- |
G-белки |
Холера |
cholerae |
|
рибозил- |
|
|
|
|
трансфераза |
|
|
|
|
Суперантигены |
|
|
|
|
|
|
|
S. aureus |
Энтеротоксины |
Суперантиген |
Рецептор Т- |
Пищевые инток- |
|
|
|
клеток и HLA II |
сикации |
|
|
|
класса |
|
|
|
|
|
|
|
|
|
|
146 |
S. aureus |
Эксфолиатины |
«-« |
«-« |
Синдром «ошпа- |
|
|
|
|
ренной кожи» |
|
|
|
|
|
S. aureus |
Токсин синдрома |
«-« |
«-« |
Синдром токси- |
|
токсического шока |
|
|
ческого шока |
|
|
|
|
|
S. pyogenes |
Пирогенные экзо- |
«-« |
«-« |
Скарлатина/ син- |
|
токсины |
|
|
дром токсическо- |
|
|
|
|
го шока |
|
|
|
|
|
|
|
Протеазы |
|
|
|
|
|
|
|
B. anthracis |
Летальный фактор |
Металло- |
Митоген- |
Сибирская язва |
|
|
протеаза |
активируемая |
|
|
|
|
киназа протеин- |
|
|
|
|
киназ (MAPKK) |
|
C. botulinum |
Нейротоксины |
Zn-металло- |
Везикуло- |
Ботулизм |
|
A-G |
протеаза |
ассоциирован- |
|
|
|
|
ный мембран- |
|
|
|
|
ный белок, си- |
|
|
|
|
наптобревин, |
|
|
|
|
синтаксин |
|
C. tetani |
Столбнячный ток- |
Zn-металло- |
Везикуло- |
Столбняк |
|
син |
протеаза |
ассоциирован- |
|
|
|
|
ный мембран- |
|
|
|
|
ный белок, си- |
|
|
|
|
наптобревин |
|
Эндотоксины тесно связаны с микробной клеткой и освобож-
даются только при ее гибели или при разрушении. Они содержатся преимущественно в грамотрицательных микробах. По химической природе относятся к липополисахаридам (ЛПС), обладают выраженными антигенными свойствами (О-антиген). Эндотоксины, в отличие от белковых экзотоксинов, более устойчивы к повышенной температуре. При попадании в организм они вызывают сходные патологические процессы, независимо от того, из каких грамотрицательных бактерий они происходят.
После освобождения из бактериальной клетки эндотоксин связывается с липополисахаридсвязывающим белком LBP
(lipopolysaccharide-binding protein). Этот комплекс взаимодействует с рецептором СD14 на поверхности макрофага, что и вызывает выброс медиаторов (рис. 13).
Эндотоксины стимулируют образование макрофагами трех групп мощных медиаторов – белков, липидов и свободных кислородных радикалов. Действуя совместно, они могут приводить к различным эф-
147
фектам. Фактор некроза опухоли также усиливает синтез медиаторов, а простагландин Е2 подавляет.
При выделении небольшого количества эндотоксина, производимые макрофагами биологически активные вещества способствуют уничтожению инфекции, инициируя локальный регулируемый иммунный ответ. Типичные эффекты, которые при этом наблюдаются (повышение температуры тела, мобилизация специфического и неспецифического иммунитета в ответ на микроорганизмы) обеспечивают в норме выздоровление. При тяжелой инфекции, вызванной грамотрицательными микроорганизмами, с освобождением огромного количества эндотоксина происходит системное избыточное выделение медиаторов и, например, за счет вазодилятации сосудов под действием окиси азота и резкого падения артериального давления наблюдается опасный для жизни бактериальный эндотоксический шок. Эндотоксины, в отличие от экзотоксинов, не вызывают сильного специфического иммунного ответа и синтеза нейтрализующих антител. Эндотоксический шок значительно усугубляется при одновременном воздействии на организм эндотоксина и экзотоксиновсуперантигенов.
Иммунодепрессивное действие экзо-, эндотоксинов, других фак-
торов патогенности -- важный фактор преодоления защитных барьеров. Многие вещества микробов подавляют активность фагоцитов, метаболизм нейтрофилов, угнетают активность Т-хелперов и, наоборот, активируют супрессивные механизмы иммунного ответа. К факторам вирулентности относится также «антигенная мимикрия» – наличие у возбудителей общих антигенов с антигенами человека. Белки теплового шока hsp 60 и 70 кДа имеются у микобактерий туберкулеза, сальмонелл и в клетках человека, что приводит к уклонению бактерий от иммунологического ответа хозяина. С одной стороны, макроорганизм толерантен, не отвечает на антигены микроба, сходные по строению с его собственными, с другой стороны, в случае возникновения такого ответа развивается аутоиммунная реакция на свои макромолекулы.
Тяжелое течение инфекционного процесса или фатальный для хозяина исход может наблюдаться при снижении уровня неспецифической защиты и иммунологической реактивности хозяина, большой дозе и высокой вирулентности возбудителя, а также при неестественных путях его проникновения. Хронизация инфекционного процесса, как правило, определяется несостоятельностью иммунологического ответа к возбудителю.
148
РАЗДЕЛ II. ЧАСТНАЯ МИКРОБИОЛОГИЯ
A. ЧАСТНАЯ БАКТЕРИОЛОГИЯ
IX. ГРАМПОЛОЖИТЕЛЬНЫЕ КОККИ
9.1 Семейство Staphylococcaceae
Среди грамположительных кокков имеется два семейства, включающие представителей, патогенных для человека: Staphylococcaceae, Streptococcaceae.
В эти семейства входят патогенные, условно-патогенные и сапрофитические кокки, объединенные общими морфологическими, генетическими и биологическими свойствами. Кроме того, их объединяет способность вызывать гнойно-воспалительные процессы.
Семейство Staphylococcaceae включает роды Staphylococcus, Gemella.
Основными признаками дифференцировки их представителей является наличие или отсутствие цитохромов и каталазная активность.
Общие свойства этого семейства: по морфологии представляют собой кокки, делящиеся более, чем в одной плоскости, грамположительны, имеют положительный каталазный тест.
9.1.1. Род Staphylococcus
Род Staphylococcus состоит из 27 видов, из них 3 основных:
S. aureus, S. еpidermidis, S. saprophyticus.
Впервые стафилококки обнаружены Р. Кохом в 1878 г., выделены Л. Пастером из гноя в 1880 г. и изучены Ф. Розенбахом в 1884 г.
Морфология и свойства. Стафилококки имеют шаровидную форму, располагаются в виде гроздей винограда. В мазке из патологического материала они находятся на разных стадиях деления: одиночные, парные, цепочки, но чаще в виде гроздей; неподвижны, спор не образуют. Некоторые имеют капсулу, изменяются под действием антибиотиков и превращаются из типичных S-форм в L-формы, G- формы – карликовые, в фильтрующиеся формы. Факультативные анаэробы, хемоорганотрофы с окислительным и бродильным типом метаболизма, каталазоположительны, содержат цитохромы, чувствительны к лизостафину.
Температурный диапазон роста от 4°С до 43°С, pH 7,2-7,4; Г+Ц – 30-39 моль%. Неприхотливы к питательным средам. Колонии S.aureus круглые, гладкие, имеют пигмент золотистого цвета; S. epidermidis образует более мелкие белые колонии; S. saprophyticus – крупные,
149
эмалевые, белого, реже лимонно-желтого цвета. Признак пигментообразования лучше проявляется на МЖСА (молочно-желточно- солевом агаре) или ЖСА – элективных и дифференциальнодиагностических средах. Повышенная концентрация NaCl подавляет рост других микробов; в среде с яичным желтком выявляется фермент лецитиназа – вокруг колоний появляются радужные венчики помутнения. Добавление молока стимулирует образование пигмента. На кровяном агаре выявляют гемолитическую активность стафилококка.
Стафилококки хорошо растут на средах с добавлением 40% желчи. В МПБ дают диффузное помутнение всей питательной среды. При посеве в столбик желатина разжижают его в виде воронки, свертывают молоко, белок расщепляют до H2S, восстанавливают нитраты в нитриты, индола не образуют. Биохимически активны, расщепляют многие углеводы до кислоты. Дифференциально-диагностическое значение имеет тест на сбраживание глюкозы в анаэробных условиях. Из ферментов, участвующих в патогенезе стафилококковых инфекций, только плазмокоагулаза и частично ДНКаза характерны для S.aureus. Стафилококки синтезируют бактериоцины.
Антигены. Антигенными свойствами обладают вещества клеточной стенки: пептидогликан, тейхоевые кислоты, белок А, типоспецифические агглютиногены, капсула.
Пептидогликан имеет общие антигены с пептидогликанами стрептококков. Видоспецифическими антигенами являются тейхоевые кислоты: для S. aureus – рибитолтейхоевые, для S. epidermidis – глицеринтейхоевые, S. saprophyticus имеет оба типа кислот.
Факторы патогенности. Факторами патогенности стафилококка служат: токсические субстанции, микрокапсула, компоненты клеточной стенки, мембраноповреждающие токсины. Наибольшее значение имеют эксфолиатины А и В (суперантигены). Эксфолиатины А и В вызывают синдром «ошпаренной кожи»: образуются большие очаги эритемы на коже и пузыри. Эксфолиатины различаются по антигенным свойствам и отношению к температуре: А – термостабилен, контролируется хромосомным геном, В – термолабилен, зависит от плазмидного гена.
Эндотоксин синдрома токсического шока (TSST-суперантиген) вызывает синдром токсического шока за счет резкой стимуляции выделения ФНО- и интерлейкина I. Синдром встречается у женщин, использующих сорбирующие тампоны в период менструации, в которых могут размножаться стафилококки. Клинически проявляется температурой тела выше 38,8оС, рвотой, диареей, скарлатиноподобной сыпью, снижением артериального давления. Лейкоцидин оказывает цитотоксическое действие на полиморфноядерные нейтрофилы,
и интерлейкина I. Синдром встречается у женщин, использующих сорбирующие тампоны в период менструации, в которых могут размножаться стафилококки. Клинически проявляется температурой тела выше 38,8оС, рвотой, диареей, скарлатиноподобной сыпью, снижением артериального давления. Лейкоцидин оказывает цитотоксическое действие на полиморфноядерные нейтрофилы,
150
