
- •Химия (Часть 1)
- •Введение
- •Техника лабораторных работ Порядок работы
- •Реактивы и обращение с ними
- •Меры предосторожности при работе в лаборатории
- •Лабораторная работа №1 Определение молярной массы эквивалента магния Краткие теоретические сведения
- •Количество вещества. Молярные массы
- •Молярный объем вещества.
- •Закон эквивалентов:
- •Экспериментальная часть
- •Условия и результаты опыта для расчета молярной массы эквивалентов магния
- •Давление насыщенного водяного пара при различных температурах
- •Расчет молярной массы эквивалентов магния
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №2 Классы неорганических веществ Краткие теоретические сведения
- •Экспериментальная часть опыт №1. Идентификация кислот и оснований
- •Опыт №2. Реакция нейтрализации
- •Опыт №3. Получение средней и кислой солей
- •Опыт №4. Получение основной соли и гидроксида кобальта
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
- •Зависимость скорости реакции от концентрации. Гомогенные реакции
- •Гетерогенные реакции
- •Зависимость скорости реакции от температуры.
- •Химическое равновесие и принцип Ле Шателье
- •Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
- •Опыт № 2. Зависимость скорости гетерогенной реакции от величины активной поверхности реагирующих веществ
- •Опыт № 3 Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы для домашней подготовки
- •Упражнения
- •Литература
Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
Различные реакции протекает с различными скоростями. Некоторые заканчиваются мгновенно, например реакции разложения взрывчатых веществ, а другие идут длительное время. Скорость химической реакции зависит от различных факторов: природы взаимодействующих веществ, концентрации, температуры, влияния катализаторов и пр.
Учение о скорости реакции называется кинетикой химических процессов.
Вопрос о кинетике химических реакций имеет большое теоретическое и практическое значение. Изменяя условия протекания реакции, можно добиться желаемой скорости, необходимой для данного технологического процесса.
Различают реакции гомогенные и гетерогенные. Закономерности их кинетики не в полной мере совпадают.
Зависимость скорости реакции от концентрации. Гомогенные реакции
Гомогенные реакции протекают между веществами, находящимися в системе в одной фазе. Примеры однофазных систем: смесь газов, раствор нескольких веществ в одном растворителе.
Гомогенные реакции идут во всем объеме системы, поэтому скорость таких реакций измеряют изменением концентрации вступающего или образующегося вещества за единицу времени.
Скорость химической реакции изменяется с изменением концентрации реагирующих веществ. В начальной стадии реакции концентрации исходных веществ уменьшаются, а концентрации получаемых – возрастают. Следовательно, численные значения скорости реакции будут различны в разные промежутки времени. Если отнести изменение концентрации к бесконечно малому промежутку времени, то истинная скорость реакции в данный момент определяется как производная от концентрации по времени
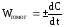 , (15)
, (15)
где Wгомог – скорость реакции;
С – молярная концентрация;
t – время.
Приведенная формула выражает истинную скорость реакции. Для практических целей часто измеряют среднюю скорость за конечный промежуток времени, тогда пользуются формулой
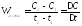 . (16)
. (16)
На скорость химических реакций влияет, прежде всего, природа реагирующего вещества, а также возможность столкновений между молекулами, т.е. сближение их до такого расстояния, при котором электроны и атомы одной молекулы попадают в сферу действия электрических полей, возбуждаемых частицами другой. Под влиянием этих полей происходят перегруппировки атомов, в результате которых образуются молекулы новых веществ. Установлено, что в реакциях, протекающих с конечными скоростями, только малое число столкновений приводит к образованию новых молекул.
Очевидно, что число столкновений должно увеличиваться с повышением концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации выражена законом действия масс:
при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, равной коэффициенту перед формулой данного вещества в уравнении реакции.
В математической форме в применении, например, к реакции
2SO2 + O2 2SO2
закон действия масс выражается следующей формулой:
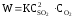 , (17)
, (17)
где W – скорость реакции;
С – молярная концентрация (грамм-моль в литре раствора);
К – коэффициент пропорциональности для данной реакции при постоянной температуре, или константа скорости, численно равная скорости реакции в условиях, когда концентрации каждого из исходных веществ равна единице.
Часто молярную концентрацию реагирующих веществ выражают [SO2], [O2], [SO3], тогда для приведенной реакции зависимость ее скорости от концентрации реагирующих веществ выразить формулой
 .
.
Математическая форма закона действия масс для реакции общего вида mA + nB рС + qД будет
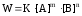 , (18)
, (18)
где [A] и [B] – молярные концентрации веществ А и В;
m и n – коэффициенты в уравнении реакции.
