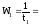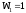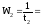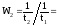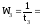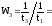- •Химия (Часть 1)
- •Введение
- •Техника лабораторных работ Порядок работы
- •Реактивы и обращение с ними
- •Меры предосторожности при работе в лаборатории
- •Лабораторная работа №1 Определение молярной массы эквивалента магния Краткие теоретические сведения
- •Количество вещества. Молярные массы
- •Молярный объем вещества.
- •Закон эквивалентов:
- •Экспериментальная часть
- •Условия и результаты опыта для расчета молярной массы эквивалентов магния
- •Давление насыщенного водяного пара при различных температурах
- •Расчет молярной массы эквивалентов магния
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №2 Классы неорганических веществ Краткие теоретические сведения
- •Экспериментальная часть опыт №1. Идентификация кислот и оснований
- •Опыт №2. Реакция нейтрализации
- •Опыт №3. Получение средней и кислой солей
- •Опыт №4. Получение основной соли и гидроксида кобальта
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
- •Зависимость скорости реакции от концентрации. Гомогенные реакции
- •Гетерогенные реакции
- •Зависимость скорости реакции от температуры.
- •Химическое равновесие и принцип Ле Шателье
- •Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
- •Опыт № 2. Зависимость скорости гетерогенной реакции от величины активной поверхности реагирующих веществ
- •Опыт № 3 Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы для домашней подготовки
- •Упражнения
- •Литература
Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
Реактивы и оборудование
1. Раствор тиосульфата натрия.
2. Раствор серной кислоты.
3. Дистилированная вода.
4. Четыре мерные пробирки.
Опыт основан на взаимодействии тиосульфата натрия с серной кислотой
Na2S2O3 + H2SO4 Na2SO4 + H2O + SO2 + S.
Помутнение раствора в результате выделения коллоидной серы дает возможность установить момент окончания реакции, зафиксировать время ее протекания при разных концентрациях исходных веществ и таким образом определить скорость реакции.
Скорость реакции
в нашем опыте выражается в условных
единицах (безразмерно) как величина,
обратная времени протекания процесса.
Так, например, если при концентрации
С1
реакция закончилась за 20 с, а при
концентрации С2
– за 10 с, то скорость первой реакции
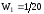 ,
а второй
,
а второй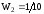 .
Следовательно,
.
Следовательно,
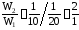 ,
,
т.е. вторая реакция протекает быстрее, чем первая в 2 раза.
Начертите следующую таблицу, в которую будете заносить данные опытов.
Таблица 4
Зависимость скорости от концентрации растворов
|
№ пробирки |
Объемы, мл |
Условная концентрация |
Время протекания реакции |
Скорость реакции |
Сравнение скоростей | ||||
|
раствора Na2S2O3 |
H2O | ||||||||
|
1 |
1 |
3 |
С1 |
t1 |
|
| |||
|
2 |
2 |
2 |
С2 |
t2 |
|
| |||
|
3 |
4 |
0 |
С3 |
t3 |
|
| |||
Ход работы
В градуированную пробирку налейте 1 мл (одно деление) раствора тиосульфата натрия, приготовленного лаборантами, и перелейте в пробирку с карандашной меткой на стенке. В эту же пробирку добавьте 3 мл воды и 4 мл раствора серной кислоты. Смесь быстро взболтайте и сразу же включите метроном или секундомер.
Поднимите пробирку на уровень глаз на расстоянии около 30 см и поверните ее так, чтобы карандашная черта была на противоположной от глаз стороне. Следите за помутнением раствора. Исчезновение видимости карандашной черты условно примите за окончание реакции. Зафиксируйте в табл. 1 продолжительность реакции t1.
Повторите опыт с концентрацией С2 , для чего в ту же пробирку, предварительно вымытую, налейте 2 мл раствора тиосульфата натрия, 2 мл воды и 4 мл раствора серной кислоты. Зафиксируйте продолжительность реакции t2.
Проделайте еще один опыт с концентрацией С3; к 4 мл раствора тиосульфата натрия налейте 4 мл раствора серной кислоты. Время реакции запишите в табл. 1.
Вычислите условные скорости реакций, соответствующие каждой концентрации тиосульфата натрия. Для этого разделите единицу на время протекания реакции. Полученные величины, выраженные в десятичных дробях, занесите в табл. 1.
Сравните скорости реакций, соответствующе разным концентрациям, для чего скорости реакций для С2 и С3 разделите на скорость для С1, т.е. примите скорость реакции для С1 равной единице. Запишите полученные данные в табл. 1.
Для наглядности выразите зависимость скорости от концентрации тиосульфата натрия в виде графика: по оси X отложите концентрации С1, С2, С3, а по оси У – значения скоростей реакции в относительных величинах (рис. 1). Точки пересечения вертикальных линий, соответствующих концентрациям, и горизонтальных линий, соответствующих скоростям реакций, соедините между собой кривой.

По характеру полученной кривой сформируйте вывод о зависимости скорости реакции от концентрации раствора (в общем виде).