
- •Химия (Часть 1)
- •Введение
- •Техника лабораторных работ Порядок работы
- •Реактивы и обращение с ними
- •Меры предосторожности при работе в лаборатории
- •Лабораторная работа №1 Определение молярной массы эквивалента магния Краткие теоретические сведения
- •Количество вещества. Молярные массы
- •Молярный объем вещества.
- •Закон эквивалентов:
- •Экспериментальная часть
- •Условия и результаты опыта для расчета молярной массы эквивалентов магния
- •Давление насыщенного водяного пара при различных температурах
- •Расчет молярной массы эквивалентов магния
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №2 Классы неорганических веществ Краткие теоретические сведения
- •Экспериментальная часть опыт №1. Идентификация кислот и оснований
- •Опыт №2. Реакция нейтрализации
- •Опыт №3. Получение средней и кислой солей
- •Опыт №4. Получение основной соли и гидроксида кобальта
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
- •Зависимость скорости реакции от концентрации. Гомогенные реакции
- •Гетерогенные реакции
- •Зависимость скорости реакции от температуры.
- •Химическое равновесие и принцип Ле Шателье
- •Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
- •Опыт № 2. Зависимость скорости гетерогенной реакции от величины активной поверхности реагирующих веществ
- •Опыт № 3 Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы для домашней подготовки
- •Упражнения
- •Литература
Гетерогенные реакции
В гетерогенных система обязательно присутствует поверхность раздела фаз. Таким образом, гетерогенные реакции протекают между веществами, находящимися в системе в разных фазах. Например, жидкость – твердое вещество, жидкость – нерастворенный газ, две взаимно не растворяющиеся жидкости, твердое вещество – газ.
В гетерогенных системах столкновение между молекулами может происходить лишь на поверхности раздела фаз. Скорость гетерогенной реакции измеряют количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности твердой фазы,
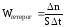 , (19)
, (19)
где – знак приращения;
n – количество вещества в молях, весовых или объемных единицах;
S – площадь поверхности фазы, на которой протекает реакция;
t – время.
Таким образом, величина поверхности твердого реагента оказывает большое влияние на продолжительность протекания реакции. Как известно, с повышением степени дисперсности (раздробления) суммарная поверхность вещества резко возрастает, поэтому, чем больше измельчен реагент, тем интенсивнее протекает реакция и быстрее заканчивается процесс. Этой закономерности подчиняется твердение цемента и других строительных материалов, коррозия бетона и т.д.
Зависимость скорости реакции от температуры.
В реакциях, протекающих с конечной скоростью, эффективными оказываются лишь контакты между такими молекулами, которые в момент столкновения обладают некоторым избытком энергии по сравнению со средней для данной температуры величиной. Этот избыток энергии называется энергией активации, а молекулы с повышенной энергией – активными молекулами. От других молекул того же вещества они отличаются тем, что их внутренние химические связи ослаблены. Это и позволяет им активно вступать в реакции.
Энергия активации – избыточное количество энергии (по сравнению со средней величиной), которой должна обладать молекула в момент столкновения, чтобы быть способной к данное химическому взаимодействию.
Молекулы могут активизироваться действием повышенной температуры, электрического разряда, ультразвуковыми колебаниями, действием различного рода излучений и т.д.
При поглощении энергии возрастает число активных молекул, возрастает число их столкновений в единицу времени, следовательно, с увеличением температуры скорость реакции также возрастает.
Существует приближенное правило, по которому повышение температуры на 10° увеличивает скорости реакций примерно в 2–4 раза (правило Вант-Гоффа).
Если обозначить:
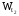 –скорость при
конечной температуре;
–скорость при
конечной температуре;
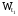 – скорость
реакции при начальной температуре,
– скорость
реакции при начальной температуре,
то соотношение скоростей выразится формулой
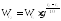 . (20)
. (20)
Например, при повышении температуры реакционной смеси с 10 (t1) до 100° (t2) при температурном коэффициенте , равном 2, скорость реакции возрастет в 512 раз:
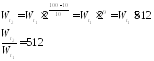
Химическое равновесие и принцип Ле Шателье
Некоторые химические реакции в определенных условиях протекают одновременно в двух противоположных направлениях. Такие реакции называются обратимыми. По мере течения прямой реакции, уменьшаются концентрации исходных веществ и увеличиваются концентрации полученных продуктов, при этом скорость прямой реакции W1 уменьшается, а обратной W2 – увеличивается. В определенный момент скорости обеих реакций становятся равны (W1 = W2), наступает состояние химического равновесия, когда установившиеся концентрации всех веществ реакции остаются неизменными.
Для общего вида обратимой реакции
mA + nB рС + qД;
при условии равновесия следует
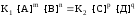
или
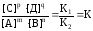 . (21)
. (21)
Величина К называется константой химического равновесия. Она равна отношению произведения концентраций продуктов реакции к произведению концентраций реагентов в момент химического равновесия. Следует отметить, что это выражение справедливо только для гомогенной реакции. Если реакция гетерогенная, то на равновесие влияет концентрация только газообразных или жидких веществ, концентрации твердых веществ не учитываются. Например для реакции
CaCO3(т)+2HCl(ж) =CaCl2(ж)+H2CO3(ж)
Константа равновесия равна
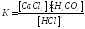
Изменение концентрации хотя бы одного из веществ равновесной системы повлечет за собой изменение других, и равновесие будет смещаться в ту или другую сторону, поэтом химическое равновесие называется подвижным, или динамическим.
Рассмотрим пример гомогенной обратимой реакции
FeCl3 + 3KCNS Fe(CNS)3 + 3KCl.
Продукт реакции Fe(CNS)3 – роданит железа (III) имеет красную окраску. По интенсивности окраски можно проследить изменение его концентрации при смещении равновесия.
Константа равновесия для данной реакции равна
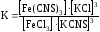 .
.
При увеличении концентрации FeCl3 или KCNS знаменатель возрастает, соотношение концентраций становится меньше величины К, что при данных температурных условиях быть не должно. Изменение концентраций влечет за собой смещение равновесия вправо, т.е. в сторону увеличения концентраций продуктов реакции. Это видно по более интенсивной окраске Fe(CNS)3.
Если к раствору прибавить KCl, то равновесие смещается влево и концентрация Fe(CNS)3 уменьшается. Смещение равновесия продолжается до тех пор, пока не установится новое химическое равновесие.
Для подвижных химических равновесий существует принцип, носящий название принципа Ле-Шателье:
Если на обратимую систему, находящуюся в подвижном равновесии, оказывать внешнее воздействие (изменять концентрацию, температуру, давление и т.д.), то равновесие смещается в сторону той реакции, которая уменьшает величину оказываемого воздействия.
