
- •Химия (Часть 1)
- •Введение
- •Техника лабораторных работ Порядок работы
- •Реактивы и обращение с ними
- •Меры предосторожности при работе в лаборатории
- •Лабораторная работа №1 Определение молярной массы эквивалента магния Краткие теоретические сведения
- •Количество вещества. Молярные массы
- •Молярный объем вещества.
- •Закон эквивалентов:
- •Экспериментальная часть
- •Условия и результаты опыта для расчета молярной массы эквивалентов магния
- •Давление насыщенного водяного пара при различных температурах
- •Расчет молярной массы эквивалентов магния
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №2 Классы неорганических веществ Краткие теоретические сведения
- •Экспериментальная часть опыт №1. Идентификация кислот и оснований
- •Опыт №2. Реакция нейтрализации
- •Опыт №3. Получение средней и кислой солей
- •Опыт №4. Получение основной соли и гидроксида кобальта
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
- •Зависимость скорости реакции от концентрации. Гомогенные реакции
- •Гетерогенные реакции
- •Зависимость скорости реакции от температуры.
- •Химическое равновесие и принцип Ле Шателье
- •Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
- •Опыт № 2. Зависимость скорости гетерогенной реакции от величины активной поверхности реагирующих веществ
- •Опыт № 3 Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы для домашней подготовки
- •Упражнения
- •Литература
Давление насыщенного водяного пара при различных температурах
|
Температура, 0С |
Давление пара, мм. рт. ст. |
Температура, 0С |
Давление пара, мм. рт. ст. |
|
15 |
12,788 |
22 |
19,827 |
|
16 |
13,634 |
23 |
21,088 |
|
17 |
14,530 |
24 |
22,377 |
|
18 |
15,477 |
25 |
23,756 |
|
19 |
16,477 |
26 |
25,321 |
|
20 |
17,535 |
27 |
26,532 |
|
21 |
18,650 |
28 |
55,324 |
Расчет молярной массы эквивалентов магния
1. Используя формулу объединенного газового закона (2):
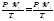 (2)
(2)
приведите объем выделившегося водорода V1 к нормальным условиям, т. е. вычислите V0.
2. На основе закона эквивалентов определите молярную массу эквивалентов данного метала. Поскольку объем газа при постоянных температурах и давлении прямо пропорционален массе, то нет необходимости выражать эквиваленты газообразных веществ единицами массы. Когда одно из веществ находится в твердом состоянии (металл), а второе – в газообразном (водород), то закон эквивалентов (9) записывается следующим образом:
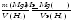 (9)
(9)
3. Вычислите
абсолютную ошибку опыта (А)
 .
.
Мэ(теор) находится по формуле (4)
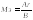 (4)
(4)
как отношением молярной массы магния к его валентности,
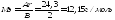
4. Вычислите относительную ошибку опыта в процентах.
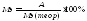 (14)
(14)
Сформулируйте вывод по результату проведенного эксперимента. Если ошибка опыта превышает 5-10 процентов, то приведите возможные причины.
Вопросы для домашней подготовки
Что такое моль вещества?
Как рассчитать молярную массу вещества?
Что такое молярный объем газа?
Как рассчитать число молей вещества?
Как рассчитать число молей газа?
Что такое эквивалент?
Как рассчитать мольную массу эквивалента элемента, оксида, кислоты, основания, соли?
8. Сформулируйте закон эквивалентов. Напишите его математическое выражение.
Упражнения
1. Выразите в молях 6,02 ∙10 22 молекул сероводорода.
1. 0,5 3. 0,2
2. 0,1 4. 1,0
2. Какой объем при н.у. занимают 8 г кислорода?
1. 22,4 л 3. 5,6 л
2. 11,2 л 4. 1,0 л
3. У какого из приведенных соединений молярная масса эквивалентов в 3 раза меньше молярной массы?
1. Н2SО4 3. Na2S
2. SO3 4. Na3PO4
4. При восстановлении кислородом 1,34г оксида металла до металла образовалось 0,324 г воды. Вычислите молярную массу эквивалентов металла.
1. 29,2 г/моль 3. 58,4 г/моль
2. 37,2 г/моль 4. 9 г/моль
5. Сколько молекул содержится в 0,01 моль аммиака?
1. 6.02 1023 3. 6,02 1021
2. 3,01 1022 4. 2,006 1023
6. Вычислите массу 1л воздуха при н.у.
1. 2,4г 3. 2,9г
2. 3,0г 4. 1,29г
7. Определите молярную массу эквивалентов фосфорной кислоты в реакции: Н 3PO4 + Na ОН = NaН2PO4 + Н2О
1. 98 г/моль 3. 49 г/моль
2. 32,7г/моль 4. 196 г/моль
8. При взаимодействии кальция с водой образуется газ, занимающий объем 224 л при давлении 0,3 атмосферы и температуре 5460С. Вычислите массу и число атомов металла.
1. 40 г и 6,03 1022 2. 40 г и 6,03 1023 3. 4 г и 3, 015 1023 4. 20 г и 6,03 1023
9. В каком весовом количестве серной кислоты H2SO4 содержится столько же молекул, сколько в 18г воды?
1. 49 г 3. 196 г
2. 1 г 4. 98 г
10. Вычислите мольную массу газа, масса 1л которого 0,76 г (н.у.).
1. 17 г/моль 3. 34 г/моль
2. 76 г/моль 4. 10 г/моль
11. Молярная масса эквивалентов трехвалентного металла составляет 17,3 г/моль. Вычислить мольную массу металла.
1. 34,6г/моль 3. 103,8г/моль
2. 51,9г/моль 4. 17,3 г/моль
12. Вычислить молярную массу эквивалентов кислоты, на нейтрализацию 0,18г которой пошло 0,1г NaOН.
1. 36 г/моль 3. 72 г/моль
2. 40 г/моль 4. 20 г/моль
13.Выразите в молях 6,02 ∙10 21 молекул этилена С2Н4.
1. 0,01 3. 0,1
2. 1,0 4. 10,0
14. Вычислите массу 5,6л углекислого газа СО2 при н.у.
1. 44 г 3. 22 г
2. 11 г 4. 5,6 г
15. Определите молярную массу эквивалентов гидроксида алюминия Аl(ОН)3 в реакции: Аl(ОН)3 + НCl = Аl(ОН)2Cl + Н2О.
1. 39 г/моль 3. 78 г/моль
2. 26 г/моль 4. 3,9 г/моль
16. Кусок металла, молярная масса эквивалентов которого 20 г/моль, вытесняет из кислоты 700 см3 водорода, измеренного при н.у. Определить массу металла.
1. 2,5 г 3. 5,0 г
2. 1,5 г 4. 1,25 г
17. Сколько молекул содержится в 64 г кислорода?
1. 6,02 ∙10 24 3. 6,02 ∙10 23
2. 1,204 ∙10 24 4. 3,01 ∙10 23
18. Определите молярную массу эквивалентов фосфора в соединении РН3.
1. 15,5 г/моль 3. 11,3 г/моль
2. 34 г/моль 4. 10,3 г/моль
19. В хлориде железа содержится 43,43 % железа. Зная, что молярная масса эквивалентов хлора 35,5г/моль, вычислите молярную массу эквивалентов железа в данном соединении.
1. 27,3 г/моль 3. 54,6 г/моль
2. 13,7 г/моль 4. 2,6 г/моль
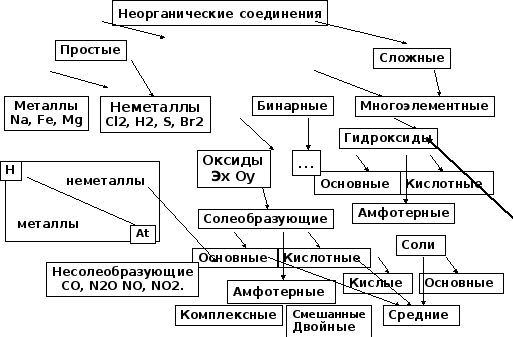
Многоэлемент
Рис. 2.Основные классы неорганических соединений
