
- •Химия (Часть 1)
- •Введение
- •Техника лабораторных работ Порядок работы
- •Реактивы и обращение с ними
- •Меры предосторожности при работе в лаборатории
- •Лабораторная работа №1 Определение молярной массы эквивалента магния Краткие теоретические сведения
- •Количество вещества. Молярные массы
- •Молярный объем вещества.
- •Закон эквивалентов:
- •Экспериментальная часть
- •Условия и результаты опыта для расчета молярной массы эквивалентов магния
- •Давление насыщенного водяного пара при различных температурах
- •Расчет молярной массы эквивалентов магния
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №2 Классы неорганических веществ Краткие теоретические сведения
- •Экспериментальная часть опыт №1. Идентификация кислот и оснований
- •Опыт №2. Реакция нейтрализации
- •Опыт №3. Получение средней и кислой солей
- •Опыт №4. Получение основной соли и гидроксида кобальта
- •Вопросы для домашней подготовки
- •Упражнения
- •Лабораторная работа №3 Скорость химических реакций и химическое равновесие Краткие теоретические сведения
- •Зависимость скорости реакции от концентрации. Гомогенные реакции
- •Гетерогенные реакции
- •Зависимость скорости реакции от температуры.
- •Химическое равновесие и принцип Ле Шателье
- •Экспериментальная часть Опыт № 1: Зависимость скорости гомогенной реакции от концентрации реагирующих веществ
- •Опыт № 2. Зависимость скорости гетерогенной реакции от величины активной поверхности реагирующих веществ
- •Опыт № 3 Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы для домашней подготовки
- •Упражнения
- •Литература
Количество вещества. Молярные массы
Количество вещества измеряют в молях. Моль – это такое количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов, др.), сколько атомов содержится в 12 г изотопа углерода 612С. Это число (количество) равно 6,02∙1023 и называется постоянной Авогадро NА. Таким образом моль – это такое количество вещества, которое содержит 6,02∙1023 частиц.
Молярная масса – масса моля атомов, молекул, др., выраженная в граммах. Молярная масса имеет такое же численное значение, что и относительная масса и выражается в г/моль. Значение атомных масс всех элементов (Ar) приведены в таблице периодически элементов Д.И. Менделеева. Так атомная масса водорода Ar (Н) = 1,008 г/моль. А молярная масса молекул (М) рассчитывается как сума атомных масс все атомов, входящих в состав молекулы. Так, например, молярная масса молекулярного водорода (М) (Н2) =(Ar) ∙2= 1,008∙2=2,016 г/моль.
Число молей вещества можно рассчитать как массу вещества, деленную на его молярную массу:
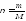 (1)
(1)
Молярный объем вещества.
Было установлено, что 1 моль любого вещества в газообразном состоянии при одинаковых условиях (давлении, температуре) занимает один и тот же объем.
При нормальных условиях (нормальное атмосферное давление P0 =101,325 кПа, или 760 мм. рт. ст., нормальная температура Т0= 2730К) молярный объем Vм равен 22,4 л. При других условиях объем можно вычислить используя формулу газового закона:
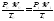 (2)
(2)
Таким образом число молей газа рассчитывается как объем газа V, деленный на молярный объем газа :
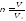 (3)
(3)
При химических взаимодействиях всегда соблюдаются три основных количественных закона.
Закон сохранения массы:
Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии:
При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
Закон эквивалентов:
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам, или молярным массам эквивалентов.
Первые два закона не требуют комментариев, они отражают общий закон природы – закон сохранения.
Закон эквивалентов связан с понятиями химического эквивалента, молярной массы эквивалента, объемного эквивалента и вычислениями их по химическим формулам и реакциям.
Упрощено эквивалентом элемента Э можно назвать такое его количество, которое реагирует с одним молем атомов водорода, т. е с 1г атомов водорода или молем атомов кислорода, т. е. с 8 г атомов кислорода. Эквивалент Э выражается в молях. Молярные массы эквивалентов Мэ выражаются в г / моль.
Молярные массы эквивалентов простых и сложных веществ вычисляются следующим образом.
1. Молярная масса эквивалентов Мэ простого вещества (элемента) равна его молярной массе атомов (Аr), деленной на валентность элемента (В) в данном соединении:
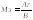 (4)
(4)
2. Молярная масса эквивалентов оксида равна его молярной массе, деленной на произведение числа атомов элемента, образующего оксид, на валентность этого элемента в данном оксиде:
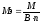 (5)
(5)
3. Молярная масса эквивалентов кислоты равна ее молярной массе, делённой на основность кислоты, которую она проявляет в данной реакции, т. е. на число атомов водорода, замещенных в данной реакции на металл:
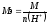 (6)
(6)
4. Молярная масса эквивалентов гидроксида равна его молярной массе, деленной на число гидроксогрупп, участвующих в реакции:
 (7)
(7)
5. Молярная масса эквивалентов соли равна ее молярной массе, деленной на произведение числа атомов метала на его валентность в данной соли:
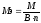 (8)
(8)
При решении многих количественных задач удобнее пользоваться следующими математическими записями закона эквивалентов:
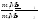 (9)
(9)
где: m1 и m2 - массы реагирующих веществ,
Мэ1 и Мэ2 – молярные массы эквивалентов этих веществ
Если одно из реагирующих веществ находится в газообразном состоянии, то математическое выражение закона эквивалентов принимает следующий вид:
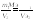 (10)
(10)
где: V2- объем газообразного вещества; Vэ2 – эквивалентный объем этого газа, т.е. объем который занимает один моль эквивалентов данного газа при н. у.
Эквивалентный объем газа Vэ(н2) при н.у. вычисляется исходя из следствия закона Авогадро: моль любого газа при н. у. занимает объём 22,4 л.
Так, например, у водорода молярная масса равна 2 г/моль, молярная масса эквивалентов атомов водорода -1г/моль
Отсюда: 2 г /моль– 22,4л;
1 г/моль – Vэ(Н2).
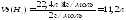 (11)
(11)
Молярная масса кислорода равна 32 г/моль, молярная масса эквивалентов атомов кислорода -8г/моль
Отсюда: 32 г /моль– 22,4л;
8 г/моль – Vэ(О2).
 (12)
(12)
Молярная масса хлора равна 71 г/моль, молярная масса эквивалентов атомов хлора-35,5г/моль
Отсюда: 71 г /моль– 22,4л;
35,5 г/моль – Vэ(Сl2).
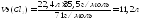 (13)
(13)
Величины эквивалентного объема газов являются постоянными (при н.у.), и могут быть использованы для решения задач.
