- •Для студентов лечебного и педиатрического факультетов
- •Оглавление
- •Раздел 1. Строение, свойства и функции белков
- •Лабораторная работа 1
- •Лабораторная работа 2
- •Оформление работы
- •Практическое значение
- •Тема 1.2. Структура и физико-химические свойства белков Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Клинико-диагностическое значение
- •Практическое значение
- •Оформление работы
- •Исследование денатурации белков при нагревании в условиях различной рН Проведение анализа
- •Оформление работы
- •Тема 1.3. Классификация белков. Строение и функции белков в организме. Сложные белки Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Анализ химического состава гликопротеинов Материал исследования
- •Проведение анализа
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Раздел 2. Строение, классификация и роль витаминов Тема 2.1. Жирорастворимые витамины Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Тема 2.2. Водорастворимые витамины Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Качественные реакции на аскорбиновую кислоту
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Раздел 3. Энзимология Тема 3.1. Строение и свойства ферментов. Регуляция активности ферментов Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Проведение реакции.
- •Оформление работы
- •Оформление работы
- •Оформление работы
- •Обнаружение специфичности действия амилазы слюны Принцип
- •Проведение реакции
- •Оформление работы
- •Лабораторная работа 4 Влияние активаторов и инактиваторов на активность амилазы Принцип
- •Реактивы
- •Материал исследования
- •Проведение реакции
- •Оформление работы
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Контрольные вопросы к итоговому занятию
- •Вопросы для самоподготовки
- •Тестовые задания
- •Ситуационные задачи
- •Раздел 5. Обмен аминокислот и белков Тема 5.1. Внешний обмен белков Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Реактивы
- •Материал исследования
- •Проведение анализа
- •Оформление работы
- •Лабораторная работа 3
- •Оформление работы
- •Темы для реферативных сообщений
- •Лабораторная работа 1 Определение активности аминотрансфераз сыворотки крови Принцип
- •Реактивы
- •Материал исследования
- •Проведение анализа
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Оформление работы
- •Темы для реферативных сообщений
- •Лабораторная работа 1 Определение аминокислот методом распределительной хроматографии на бумаге
- •Принцип
- •Реактивы
- •Материал исследования
- •Проведение анализа
- •Практическое значение
- •Оформление работы
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Раздел 6. Строение и обмен пуриновых и пиримидиновых нуклеотидов Тема 6.1. Строение и метаболизм пуриновых и пиримидиновых нуклеотидов Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Титрометрическое определение мочевой кислоты в моче
- •Ситуационные задачи
- •Темы для реферативных сообщений
- •Оформление работы
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Контрольные вопросы к итоговому занятию
- •Раздел 8. Строение и обмен углеводов Тема 8.1. Строение и внешний обмен углеводов. Обмен гликогена Актуальность
- •Вопросы для самоподготовки
- •ТЕмы для реферативных сообщений
- •Нормальные значения
- •Клинико-диагностическое значение
- •Оформление работы
- •Оформление работы
- •Тема 8.2. Окисление глюкозы в анаэробных условиях. Глюконеогенез Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Практическое значение
- •Оформление работы
- •Тема 8.3. Аэробное окисление глюкозы. Пентозофосфатный путь Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Материал исследования
- •Реактивы
- •Определение концентрации глюкозы
- •Нормальные величины
- •Оценка гликемической кривой
- •Клинико-диагностическое значение
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Контрольные вопросы к итоговому занятию
- •Раздел 9. Строение и обмен липидов
- •Темы для реферативных сообщений
- •Лабораторная работа 1
- •Оформление работы
- •Темы для реферативных сообщений
- •Оформление работы
- •Лабораторная работа 2 Определение концентрации триацилглицеролов в сыворотке крови Принцип
- •Материал исследования
- •Оформление работы
- •Нормальные величины
- •Качественная проба Либена на ацетон Принцип
- •Проведение анализа
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Тема 9.3. Внутриклеточный обмен фосфолипидов и холестерола. Транспорт липидов в крови Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Контрольные вопросы к итоговому занятию
- •Раздел 10. Гормональная регуляция обмена веществ и функций организма Тема 10.1. Механизмы передачи гормонального сигнала. Классификация гормонов. Гормоны гипофиза. (семинар) Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Тема 10.2. Гормоны гипоталамуса, гипофиза, щитовидной поджелудочной и паращитовидной желез Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Лабораторная работа 1
- •Оформление работы
- •Тема 10.3. Гормоны гипофиза, надпочечников и половых желез Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Лабораторная работа 1
- •Ситуационные задачи
- •Раздел 11. Биохимия крови
- •Темы для реферативных сообщений
- •Клинико‑диагностическое значение
- •Оформление работы
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Нормальные величины
- •Оформление работы
- •Лабораторная работа 4 (теоретически) Электрофорез белков на бумаге и ацетатцеллюлозных пленках Принцип
- •Материал исследования
- •Оборудование
- •Проведение анализа (основные положения)
- •Клинико-диагностическое значение
- •Тема 11.2. Обмен железа. Гемопротеины. Синтез и распад гема Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Оформление работы
- •Тема 11.3. Неорганические вещества крови. Кислотно-основное состояние Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Нормальные величины
- •Клинико-диагностическое значение
- •Виды нарушений кислотно-основного состояния
- •Оформление работы
- •Нормальные величины
- •Практическое значение
- •Оформление работы
- •Оформление работы
- •Оформление работы
- •Тестовые задания
- •Ситуационные задачи
- •Раздел 12. Биохимия почек и печени Тема 12.1. Водно-солевой обмен. Нормальные и патологические компоненты мочи Актуальность
- •Вопросы для самоподготовки
- •Темы для реферативных сообщений
- •Нормальные величины
- •Лабораторная работа 2
- •Определение кетоновых тел тест-полосками "Кетофан"
- •Определение билирубина и уробилиногена тест-полосками "Иктофан" Принцип
- •Нормальные величины
- •Клинико-диагностическое значение
- •Определение гемоглобина и эритроцитов тест-полосками "Гемофан"
- •Принцип
- •Нормальные величины
- •Нормальные величины
- •Оформление работы
- •Лабораторная работа 3 (теоретически) Проба Реберга – определение клиренса креатинина Материал исследования
- •Принцип
- •Проведение анализа
- •Темы для реферативных сообщений
- •Клинико‑диагностическое значение
- •Тестовые задания
- •Ситуационные задачи
- •Контрольные вопросы к итоговому занятию
- •Приложение 1 Классификация и номенклатура ферментов
- •I класс. Оксидоредуктазы
- •II класс. Трансферазы
- •III класс. Гидролазы
- •IV класс. Лиазы
- •V класс. Изомеразы
- •VI класс. Лигазы
- •Приложение 2 Индивидуальные белки плазмы крови
- •Характеристика некоторых белков плазмы крови
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Нормальные величины
- •Нормальные величины
- •Клинико-диагностическое значение
- •Нормальные величины
- •Клинико-диагностическое значение
- •Церулоплазмин
- •Нормальные величины
- •Клинико‑диагностическое значение
- •‑Глобулины
- •Желудочный сок
- •Клиренс эндогенного креатинина
- •Приложение 4
- •Строение, классификация и роль витаминов
- •Энзимология
- •Биологическое окисление
- •Обмен аминокислот и белков
- •Строение и обмен пуриновых и пиримидиновых нуклеотидов
- •Матричные биосинтезы
- •Строение и обмен углеводов
- •Строение и обмен липидов
- •Гормональная регуляция обмена веществ и функций организма
- •Биохимия крови
- •Биохимия почек и печени
Лабораторная работа 1 Определение аминокислот методом распределительной хроматографии на бумаге
Хроматографические методы применяют для сорбционно-динамического разделения смесей аминокислот, белков, углеводов, липидов и их метаболитов. Существует множество видов хроматографии, каждый из которых имеет свои биохимические основы.
Достаточно точным и доступным является метод распределительной хроматографии (модификация адсорбционной хроматографии). В данной работе в качестве адсорбента используется специальная фильтровальная бумага.
Принцип
В основе распределительной хроматографии лежит различная растворимость аминокислот в полярных и неполярных растворителях. При использовании двух жидкостей, одна из которых полярна, а другая неполярна, гидрофобные аминокислоты будут переходить в неполярную жидкость, гидрофильные аминокислоты – в полярную. Если какая-либо из этих жидкостей движется, то вместе с ней будут передвигаться соответствующие аминокислоты.
При хроматографии на бумаге вода (полярная жидкость) находится между целлюлозных волокон и является неподвижной полярной фазой. В качестве подвижной неполярной фазы используется органический растворитель бутанол.
При проведении анализа более гидрофобная аминокислота, лучше растворяющаяся в подвижном неполярном растворителе, движется с большей скоростью от линии старта, чем гидрофильная аминокислота, которая переходит в неподвижный водный слой. В результате этого отдельные аминокислоты по окончании хроматографического разделения оказываются на разном расстоянии от линии старта.
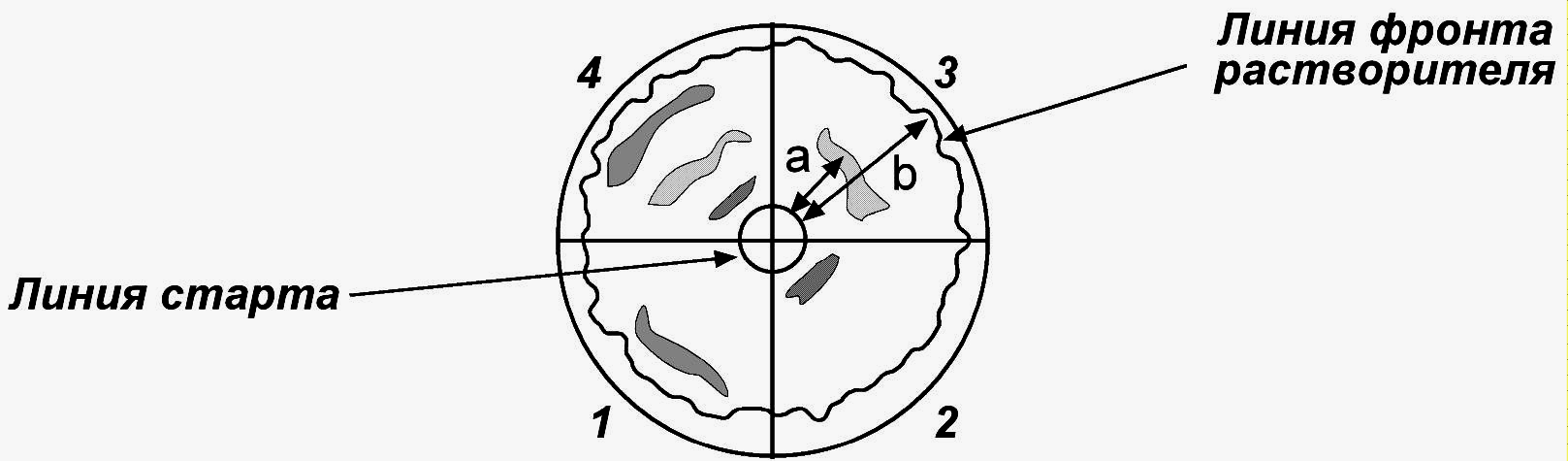
Радиальную хроматографию проводят на бумаге в чашке Петри. Растворитель перемещается от центра к периферии и захватывает аминокислоты, которые распределяются концентрическими кругами и обнаруживаются после высушивания бумаги и проведения нингидриновой реакции.
Реактивы
Хроматографическая смесь (бутанол : уксусная кислота : вода, 1,5:1,5:1,0); 2) 0,2% спиртовый р-р нингидрина.
Материал исследования
Растворы аминокислот-свидетелей – глицина, аланина, лейцина (40 ммоль/л); исследуемые растворы 1, 2, 3, содержащие аминокислоты в различном сочетании.
Проведение анализа
Диск бумаги следует держать за края, чтобы избежать появления отпечатков пальцев на хроматограмме.
Диск специальной хроматографической бумаги карандашом делят на 4 сектора и обозначают их согласно исходным растворам. На расстоянии 1,0 см от центра карандашом отмечают круговую линию старта. В центре листа хроматографической бумаги делают отверстие диаметром около 0,2 см и вставляют фитиль из скрученной полоски бумаги. Высота фитиля должна быть равна высоте чашки Петри.
Стеклянными капиллярами на линию старта в секторах 1, 2, 3 наносят соответствующие растворы аминокислот-свидетелей и в сектор 4 – исследуемую смесь аминокислот.
Просушивают хроматограммы на воздухе до исчезновения влажных пятен.
Хроматограмму помещают в заранее приготовленную чашку Петри (хроматографическую камеру), на 1/3 заполненную хроматографической смесью. Разделение проводят в закрытой чашке Петри, чтобы избежать испарения растворителя, при комнатной температуре под визуальным контролем (в течение 15‑30 минут).
Когда фронт растворителя достигнет границ бумажного диска, разделение прекращают. Немедленно (!) карандашом обводят по всей окружности линию фронта растворителя.
Хроматограмму высушивают при температуре 90‑100С с целью устранения растворителей и фиксации аминокислот.
Далее хроматограмму опрыскивают раствором нингидрина, вновь выдерживают при 100С. На бумаге проявляются красноватые, пурпурно-красные, в большинстве случаев сине-фиолетовые пятна, соответствующие расположению различных аминокислот.
|
|
Рассчитывают коэффициент распределения Rfдля каждой аминокислоты:
Rf =![]() ,
где
,
где
а – расстояние, пройденное от линии старта аминокислотой (мм), b ‑ расстояние, пройденное фронтом растворителя (мм).
Идентифицируют аминокислоты, находящиеся в исследуемом растворе (сектор 4), путем сравнения их положения (коэффициент Rf) с положением соответствующих аминокислот, используемых в качестве "свидетелей" (сектора 1, 2, 3).