
3 курс / Фармакология / Миронов_А_Н_,_Бунатян_Н_Д_и_др_Руководство_по_проведению_доклинических
.pdf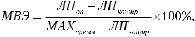
Латентный период реакции зависит: от интенсивности (мощности) теплового излучения (чем интенсивнее — тем короче время реакции), от площади нагреваемой поверхности (чем больше площадь — тем время реакции меньше) и от места нанесения раздражение (чем дистальнее воздействие (дальше от основания хвоста) — тем меньше время реакции, однако обезболивающее действие морфина проявляется сильнее при нанесении раздражения на дистальную часть хвоста).
С помощью данного метода можно регистрировать значения латентного периода реакции животного до и после введения фармакологических препаратов, а также изучать динамику изменения болевой чувствительности во времени. Однако следует помнить, что в случае многократного повторения стимула может возникнуть привыкание или, напротив, выработается условный рефлекс отдергивания хвоста еще до достижения порога болевых ощущений.
Полученные результаты изменения латентного периода реакции после введения препаратов следует сравнить с изменениями в контрольной группе с помощью статистических методов.
При обработке полученных результатов можно также рассчитать величину максимально возможного эффекта (МВЭ). Однако при сравнении эффективности препаратов по величине МВЭ следует учитывать, что в разных экспериментах может различаться максимальное время нанесения раздражителя, что приводит к значительным различиям в величине этого показателя.
где ЛПоп — латентный период реакции после введения вещества, ЛПконтр — латентный период реакции до введения вещества, МАХвремя — максимальное время нанесения раздражителя.
1.1.2. Тест тепловой иммерсии хвоста при погружении в горячую воду (tail immersion)
Тест тепловой иммерсии хвоста (tail immersion) основан на спинальном флексорном рефлексе в ответ на погружение хвоста в горячую воду [41]. Этот метод отличается от теста отдергивания хвоста при тепловом излучении тем, что площадь раздражения больше и нагревание кожной поверхности происходит быстрее. В этой связи не происходит активации терморецепторов, а сразу активируются С-волокна полимодальных ноцицепторов, Аd-волокна полимодальных ноцицепторов, полимодальные ноцицепторы и высокопороговые механорецепторы.
Эксперименты проводят на крысах и мышах (можно проводить на обезьянах). Болевое раздражение моделируют погружением хвоста в горячую воду температурой 52 °С (от 45 до 54 °С). Регистрируют латентный период отдергивания хвоста. Как правило, величина латентного периода реакции в контрольной группе находится в диапазоне от 5 до 30 с (чаще всего от 7 до 12 с). Удлинение времени реакции интерпретируется как обезболивающее действие. Во избежание повреждения тканей не следует нагревать хвост более 30 с. Критерием анальгетического эффекта считают достоверное увеличение латентного периода реакции после введения вещества.
Как и в методе отдергивания хвоста при тепловом излучении можно регистрировать значения латентного периода реакции животного до и после введения фармакологических препаратов, а также изучать динамику изменения болевой чувствительности во времени. Однако, как и в предыдущем методе, при многократном действии стимула может развиться привыкание или выработается условный рефлекс отдергивания хвоста еще до достижения порога болевых ощущений.
Полученные результаты изменения латентного периода реакции после введения препаратов следует сравнить с изменениями в контрольной группе с помощью статистических методов. Также можно использовать показатель МВЭ (см. тест отдергивания хвоста от теплового излучения).
201
1.1.3. Тест термического раздражения лап — Подошвенный тест (Hargreaves test)
Существует модификация теста тепловой иммерсии [22], в которой повреждающее воздействие наносят на лапу с помощью сфокусированного луча инфракрасного света на подошву лапы (например, установка Plantar test (Hargreaves), IITC Life Science, USA или Harvard apparatus, USA или Ugo Basile, Italy). Установка имеет бокс для животных со стеклянным полом, под которым находится перемещаемый источник света. Луч света может быть сфокусирован на лапе животного, находящегося в условиях свободного поведения. Животных предварительно адаптируют в боксе (около 30 мин), чтобы уменьшить число движений, связанных с исследовательской активностью. Регистрируют время отдергивания лапы от источника света. В контрольной группе животных величина латентного периода реакции обычно не превышает 4–6 с. Во избежание повреждения тканей не следует нагревать лапы более 20–30 с. Критерием анальгетического эффекта считают достоверное увеличение латентного периода реакции после введения вещества. Как и в методе отдергивания хвоста при тепловом излучении можно регистрировать значения латентного периода реакции животного до и после введения фармакологических препаратов, а также изучать динамику изменения болевой чувствительности во времени.
Полученные результаты изменения латентного периода реакции после введения препаратов следует сравнить с изменениями в контрольной группе с помощью статистических методов. Также можно использовать показатель МВЭ (см. тест отдергивания хвоста от теплового излучения).
1.1.4. Тест горячей пластины (hot plate)
Тест горячей пластины основан на поведенческих реакциях, контролируемых супраспинальными структурами, в ответ на болевое воздействие [46]. Эксперименты проводят на крысах и мышах. Животных помещают на разогретую в среднем до 52 °С (от 42 до 57°С) металлическую поверхность, окруженную цилиндром (например, TSE-system, Germany или Columbus Instruments, USA). Регистрируют время с момента помещения на горячую поверхность до появления поведенческого ответа на ноцицептивную стимуляцию (облизывания задних лапы, прыжки, отдергивание задней лапы). Критерием анальгетического эффекта считают достоверное увеличение латентного периода реакции после введения вещества.
Разные группы анальгетиков по-разному влияют на поведенческие реакции. Для опиоидов характерно удлинение латентного периода реакции облизывания конечности, а для нестероидных противовоспалительных средств (ацетилсалициловая кислота или парацетамол) — прыжковой реакции, особенно если температура поверхности 50 °С и ниже или температура линейно повышается от 43 до 52 °С со скоростью 2,5 °С/мин.
Как и в тесте отдергивания хвоста от теплового излучения можно регистрировать значения латентного периода реакции животного до и после введения фармакологических препаратов, а также изучать динамику изменения болевой чувствительности во времени. Однако проведение тестирования более одного раза в день или даже раза в неделю неизбежно ведет к постепенному уменьшению времени реакции.
Полученные результаты изменения латентного периода реакции после введения препаратов следует сравнить с изменениями в контрольной группе с помощью статистических методов. Также можно использовать показатель МВЭ (см. тест отдергивания хвоста от теплового излучения).
1.2. Методы оценки механической соматической боли
При оценке соматической механической боли наиболее часто сдавливающее раздражение наносят на хвост или лапу. Используют тесты с постоянным давлением и постепенным увеличением давления.
202
1.2.1. Тест механического раздражения основания хвоста по Гаффнеру (Haffner’s tail clip test)
Тест зажима основания хвоста основан на раздражении низкопороговых механорецепторов и ноцицепторов рецептивного поля врожденного рефлекса скручивания к основанию хвоста.
Эксперименты проводят на крысах и мышах. Врожденную оборонительную реакцию крыс на защемление корня хвоста специальным зажимом оценивают, используя 4-баль- ную шкалу: 0 — отсутствие реакции, 1 — вздрагивание, 2 — побежка вперед, 3 — скручивание к основанию хвоста и кусание зажима. Критерием анальгетического эффекта считают достоверное уменьшение интенсивности болевых реакций, оцененной в баллах, относительно контрольной группы.
1.2.2. Тест механического раздражения лапы или хвоста
Эксперименты проводят на крысах и мышах. Лапу, реже хвост (на расстоянии 1 см от основания хвоста) животного помещают между плоской поверхностью и тупым предметом, который соединен с системой, постепенно увеличивающей давление (например, анальгезиметр Randall-Selitto, TSE-system, Germany или Ugo Basile, Italy) [37]. При увеличении давления на конечность можно видеть последовательно: спинальный рефлекс отдергивания конечности, комплекс супраспинальных двигательных реакций животного, направленных на освобождение конечности, и вокализацию. Регистрируется порог возникновения вокализации (вес в граммах). Критерием анальгетического эффекта считают достоверное уменьшение интенсивности болевых реакций, оцененной в баллах, относительно контрольной группы.
Этот тип механического раздражения имеет определенные недостатки: 1) иногда трудно точно измерить интенсивности раздражителя; 2) повторное механическое раздражение может приводить к снижению или увеличению чувствительности; 3) слабая чувствительность метода требует использования воздействия высокой интенсивности.
С целью повышения чувствительности при механическом раздражении используют методики механического раздражения воспаленной конечности (см. тест тактильной аллодинии (п. 1.4.1.4.) и механической гиперальгезии (п. 1.4.1.1.)).
1.3. Методы оценки электрической активности при реализации соматического рефлекса
1.3.1. Метод регистрации ноцицептивного флексорного рефлекса
Ноцицептивный флексорный рефлекс относится к группе защитных рефлексов и используется для оценки болевой чувствительности в эксперименте и клинике. Метод позволяет оценить влияния анальгетиков на возбудимость ноцицептивных нейронов, реагирующих как на активацию Аd-, так и С-афферентов. Ноцицептивный флексорный рефлекс можно оценивать у мышей и крыс в остром эксперименте до и после введения препаратов.
У наркотизированных животных регистрируют биоэлектрическую активность в двуглавой мышце бедра при помощи биполярных игольчатых электродов в ответ на ноцицептивное раздражение рецептивного поля № suralis импульсами тока длительностью 1 мс и интенсивностью до 15 мА по стандартной методике [4,39]. Биоэлектрические сигналы усиливают (например, с помощью широкополосного усилителя осциллографа VC-9 (Nihon Kohden, Япония)), преобразуют в аналоговый сигнал и обрабатывают с помощью компьютеризированной системы сбора и анализа данных (например, Microlink (Biodata Limited, Англия)). Анализируют латентный период, длительность, частоту и характер разрядов раннего и позднего компонентов ноцицептивного флексорного рефлекса.
203
1.4. Методы оценки боли, вызванной альгогенами
Химические тесты основаны на изменении чувствительности С-полимодальных ноцицепторов в присутствии медиаторов воспаления или при изменении рН.
Раздражающие вещества вводят в суставную сумку (модель артрита), внутримышечно (модель миалгии), внутрибрюшинно (модель перитовисцеральной боли), в пульпу зуба (модель зубной боли), в вибриссы (модель орофасциальной тригеминальной боли),
вмочевой пузырь, матку, прямую кишку (модели висцеральной боли).
1.4.1.Методы оценки соматической боли, вызванной альгогенами
1.4.1.1. Формалиновый тест Эксперименты проводят на крысах и мышах (можно на кошках и обезьянах). Острую
воспалительную реакцию вызывают субплантарным (под подошвенный апоневроз) или подкожным введением формалина (крысе 50 мкл, мыши 20 мкл). Концентрация формалина может быть от 0.5 до 15% (чаще используют 2–5% раствор). Регистрируют число болевых реакций (постукивание лапой об пол, грызение лапы и т.д.) в первые 5–10 мин — I фаза и с 30 по 50 минуту — II фаза [24]. Критерием анальгетического эффекта считают достоверное уменьшение числа болевых реакций в получавших ЛС группе относительно контрольной группы.
В зависимости от введенной концентрации формалина можно зарегистрировать 4 типа поведенческих реакций: 0 — отсутствие реакции; 1 — лапа остается на земле, но животное на нее не опирается; 2 — лапа поднята, 3 — лапа облизывается, грызется или встряхивается.
Тест имитирует реакции, развивающиеся при операционных кожных разрезах. Одним из механизмов ноцигенного действия формалина является активация TRPA1 каналов, реагирующих в норме на холод и стимулирующих развитие воспаления [28]. Первая фаза реакции развивается сразу и характеризуется воздействием на первичные афференты боли, вторая фаза отставлена во времени и является болью, вызванной воспалительной реакцией. Опиоидные анальгетики блокируют обе фазы. Нестероидные противовоспалительные средства подавляют только вторую фазу, а местные анестетики — только первую [24]. Формалиновый тест имеет достаточно высокую прогностическую значимость.
Сходные поведенческие реакции можно регистрировать при введении в качестве раздражающего агента капсаицина (0,1%), серотонина (0,1%) или глутамата (0,5 М).
1.4.1.2. Тест механической гиперальгезии при воспалении Эксперименты проводят на крысах и мышах. Воспаление воспроизводят субплан-
тарным введением 1% раствора каррагенина. Болевую чувствительность, вызванную механическим раздражением, оценивают через 3 ч с помощью анальгезиметра, который должен обеспечить плавное увеличение нагрузки на воспаленную лапу до появления болевой реакции (оцениваемой по писку животного) (например, анальгезиметр RandallSelitto TSE-system, Germany или Ugo Basil, Italy) (см. п. 1.2.2). Исследуемые вещества вводят через 2 ч после введения каррагенина. Критерием анальгетического эффекта считают снижение гиперальгезии менее чем на 50% по сравнению с контрольной группой. Можно оценивать разницу между порогом болевых реакций в воспаленной и невоспаленной лапах.
Сходные поведенческие реакции можно регистрировать при введении в качестве раздражающего агента капсаицина (0,1–0,2%, тестируют через 15 мин), серотонина (0,1%), глутамата (0,5 М), пивных дрожжей (10% суспензия), адъюванта Фрейнда (5 мг/мл БЦЖ в вазелиновом масле, вводится за 24 ч).
1.4.1.3. Тест термической гиперальгезии при воспалении Эксперименты проводят на крысах и мышах. Воспаление воспроизводят субплан-
тарным введением 1% раствора каррагенина. Болевую чувствительность, вызванную
204
термическим раздражением, оценивают через 3 ч с помощью сфокусированного луча инфракрасного света на подошву лапы (например, установка Plantar test (Hargreaves) (см. п. 1.1.3.). Исследуемые вещества вводят через 2 ч после введения каррагенина. Критерием анальгетического эффекта считают снижение гиперальгезии менее чем на 50% по сравнению с контрольной группой. Можно оценивать разницу между порогом болевых реакций в воспаленной и невоспаленной лапах.
Сходные поведенческие реакции можно регистрировать при введении в качестве раздражающего агента капсаицина (0,1–0,2%, тестируют через 15 мин), серотонина (0,1%), глутамата (0,5 М), пивных дрожжей (10% суспензия), адъюванта Фрейнда (5 мг/мл БЦЖ в вазелиновом масле, вводится за 24 ч).
1.4.1.4. Тест тактильной аллодинии Эксперименты проводят на крысах и мышах. Воспаление воспроизводят субплан-
тарным введением 1% раствора каррагенина. Болевую чувствительность, вызванную механическим раздражением, оценивают через 3 ч с помощью волосков Фрея весом от 0,06 до 23.96 г (например, Frey hairs, Senselab aesthesiometer, Somedic, Sweden). Животных помещают в бокс с полом из проволоки. После снижения двигательной активности, связанной с исследовательским поведением (около 30 мин), проводят тестирование. Для каждого волоска тестирование проводится по 5 раз с интервалом 1–2 с. Определяется минимальный порог реакции, вызывающий отдергивание лапы в одном предъявлении из пяти [14].
Исследуемые вещества вводят через 2 ч после введения каррагенина. Критерием анальгетического эффекта считают снижение гиперальгезии менее чем на 50% по сравнению с контрольной группой. Можно оценивать разницу между порогом болевых реакций в воспаленной и невоспаленной лапах.
Сходные поведенческие реакции можно регистрировать при введении в качестве раздражающего агента капсаицина (0,1–0,2%, тестируют через 15 мин), серотонина (0,1%), глутамата (0,5 М), пивных дрожжей (10% суспензия), адъюванта Фрейнда (5 мг/мл БЦЖ в вазелиновом масле, вводится за 24 ч).
1.4.1.5.Тест хронического воспаления — адъювантного артрита Эксперименты проводят на крысах. Хроническое воспаление моделируют субплан-
тарным введением в заднюю лапу адъюванта Фрейнда (0,1 мл взвеси БЦЖ 2,5 мг/мл в вазелиновом масле). Воспалительная реакция оценивается в динамике каждые 2 дня по интенсивности воспалительных изменений в суставах пораженной конечности, выраженной в индексе отека, а также по изменению порогов болевой чувствительности [31]. Могут учитываться также и другие симптомы генерализованной реакции организма на введение адъюванта (отек ушей, хвоста, полиартрит, ухудшение общего состояния, снижение массы тела, гибель). Первичная реакция (отек на лапе введения) оценивается онкометрически на 3-й день после инъекции адъюванта. Вторичная иммунологическая реакция (отек на соседней лапе) оценивается на 14 день после введения адъюванта (при профилактике: первое введение до введения адъюванта) или на 25 день (при лечении: начиная с 14 дня после введения адъюванта).
Данный метод позволяет оценить эффективность препаратов, применяемых при артралгиях, миалгиях и других соматогенных болевых синдромах.
1.4.1.6. Тест орофасциальной тригеминальной боли Эксперименты проводят на крысах. Формалин (5 мкл, 5%) или капсаицин (0,4–
1.5 мкг/крысу, 5 мкл) вводят в область вибрисс у крыс. Регистрируют интенсивность груминга и чесательных движений [16, 34]. Критерием анальгетического эффекта считают достоверное уменьшение числа болевых реакций в получавшей ЛС группе относительно контрольной группы.
205
1.4.2. Метод оценки висцеральной боли, вызванной альгогенами
1.4.2.1.Метод оценки перитовисцеральной боли — тест корчей Внутрибрюшинное введения веществ, раздражающих серозные оболочки, вызывает у
мышей и крыс сокращение абдоминальной мускулатуры. Данный метод можно использовать как модель перитонита. В качестве раздражающего агента может выступать уксусная кислота (0,5–1% раствор) или фенибензохинон (0,1–0,2% раствор в 4% этаноле).
Эксперименты проводят на крысах и мышах (можно на обезьянах). Регистрируют число корчей на протяжении 20 мин после внутрибрюшинного введения 0,6% раствора уксусной кислоты введения (время наблюдения может варьировать от 15 до 30 мин). Критерием анальгетического эффекта считают достоверное уменьшение числа корчей в получавшей ЛС группе относительно контрольной группы [15], при условии исключения миорелаксантного действия у изучаемого соединения.
Число корчей в контрольной группе зависит от температуры окружающей среды. Максимальное количество корчей наблюдается в комфортной среде (27–28 °С), а при повышении или снижении температуры их число снижается [1].
Частота корчей спонтанно уменьшается со временем, что не позволяет оценить длительность действия болеутоляющих средств.
Тест корчей более чувствителен не только к действию анальгетиков. В данном тесте могут проявить эффект некоторые адреноблокаторы, антигистаминные препараты, блокаторы серотониновых рецепторов, мышечные релаксанты, ингибиторы моноаминоксидазы, нейролептики, антидепрессанты.
2. Методы оценки нейрогенной боли
2.1.Моделирование нейропатического болевого синдрома
2.1.1.Моделирование нейропатического болевого синдрома, вызванного перерезкой седалищного нерва
Нейропатический болевой синдром у самцов беспородных крыс создают перерезкой седалищного нерва на уровне подколенной ямки выше места его трифуркации на № tibialis, № peroneus и № suralis и последующем его лигированием для предотвращения регенерации [3]. Развитие болевого синдрома определяют по появлению признаков аутотомий на оперированной лапе. Интенсивность аутотомий оценивают по 11 балльной шкале: 1 балл — повреждение 1-го когтя; 2, 3, 4 и 5 баллов — повреждение 2-х, 3-х, 4-х
и5-ти когтей; 6 баллов — повреждение фаланги одного пальца; 7, 8, 9 и 10 баллов — повреждение фаланг соответственно на 2-х, 3-х, 4-х и 5-ти пальцах; 11 баллов — повреждение плюсневых костей. Динамику развития болевого синдрома у крыс, получавших ЛС,
иконтрольной групп наблюдают в течение 25 дней. Животным контрольной группы в день перерезки седалищного нерва и последующие 10 дней после операции вводят растворитель, а животным, получающим ЛС групп, в те же сроки — изучаемое вещество. Критерием анальгетического эффекта считают достоверное уменьшение числа болевых реакций в получавших ЛС группе относительно контрольной группы.
Интенсивность развития механической аллодинии (на 12 день после операции) оценивают с помощью волосков Фрея весом от 0.06 до 23.96 г (Frey hairs, Senselab aesthesiometer, Somedic, Sweden). Для каждого волоска тестирование проводится по 5 раз с интервалом 1–2 с. Определяется минимальный порог реакции, вызывающий отдергивание лапы в одном предъявлении из пяти.
Интенсивность развития механической гиперальгезии оценивают (на 12–13 день после операции) с помощью анальгезиметра, который должен обеспечить плавное увеличение нагрузки до появления болевой реакции (оцениваемой по писку животного) (например, анальгезиметр Randall-Selitto TSE-system, Germany или Ugo Basil, Italy) (см. п. 1.2.2). Определяется порог реакции, вызывающий отдергивание лапы.
206
Интенсивность развития термической гиперальгезии оценивают (на 12–13 день после операции) с помощью сфокусированного луча инфракрасного света на подошву лапы (например, установка Plantar test (Hargreaves) (см. п. 1.1.3). Определяется порог реакции, вызывающий отдергивание лапы.
2.1.2.Моделирование нейропатического болевого синдрома, вызванного перевязкой спинномозговых нервов
Хроническую нейропатическую боль у самцов беспородных крыс создают перевязкой L5 и L6 спинномозговых нервов [26]. Операцию проводят под наркозом. Через 2 недели после операции тестируют интенсивность развития механической аллодинии, механической и термической гиперальгезии (см. п. 2.1.1).
2.1.3.Моделирование диабетического нейропатического болевого синдрома
У многих животных (грызунов, кроликов, собак) можно вызвать инсулинозависимый сахарный диабет с помощью стрептозоцина или аллоксана — веществ, избирательно повреждающих бета-клетки. В хвостовую вену крыс вводят стрептозацин (40–75 мг/кг, в 0,75 мМ цитратном буфере рН 4,5). Развитие гиперглигемии оценивают с помощью глюкометра. Через 3–8 недель после введения стрептозацина тестируют интенсивность развития механической аллодинии, механической и термической гиперальгезий (см. п. 2.1.1) [47].
2.2. Моделирование центрального болевого синдрома
Модель воспроизводится путем создания в дорсальных рогах люмбального отдела спинного мозга популяции гиперактивных ноцицептивных нейронов с помощью аппликации агаровой пластинки, содержащей какой-либо конвульсант (КС1 и уабаин — прямая деполяризация нейронов, стрихнин — нарушение глицинергического торможения, пенициллин (15000 или 7000 ЕД) — нарушение ГАМК-ергического торможения). Данная модель используется при оценке эффективности препаратов для лечения центральных болевых синдромов (таламические боли, боли у пациентов с рассеянным склерозом, боли при демиелинизирующих заболеваниях и др.).
Для моделирования центрального болевого синдрома самцам беспородных крыс под эфирным наркозом после односторонней ламинэктомии на дорсальную поверхность люмбального отдела (L4–L6) спинного мозга апплицируют 1% агаровую пластинку размером 6 × 1,5 × 2 мм, содержащую конвульсант, приводящий к сенситизации ноцицептивных нейронов в дорсальных рогах спинного мозга. Выраженность болевого синдрома оценивают по 3-х бальной шкале. Регистрируют следующие показатели: вокализацию, общую двигательную активность в период приступа, локальную реакцию в виде вылизывания и выкусывания тканей в зоне боли на задней конечности в период приступа, аллодинию — болевой ответ на тактильный стимул, частоту приступов и их длительность. После зашивания кожного разреза вводят вещество и наблюдают клиническую картину развития синдрома, сравнивая с контрольной серией, которым также после оперативного вмешательства и аппликации конвульсанта вводят физиологический раствор в том же объеме [5]. Критерием анальгетического эффекта считают достоверное уменьшение числа болевых реакций в получавшей ЛС группе относительно контрольной группы.
3. Оценка сопутствующих и нежелательных эффектов, характерных для анальгетиков
3.1. Методы оценки влияния веществ на частоту дыханиия
3.1.1 Метод оценки влияния веществ на частоту дыхания наркотизированных кроликов
Эксперименты проводят на наркотизированных кроликах-самцах. Животных фиксируют в специальном станке, в одну ноздрю вставляют пластиковую трубку, смазанную
207

вазелином и соединенную с датчиком давления. Графическую регистрацию дыхательных движений производят с помощью прибора, например «Мингограф-81». Рассчитывают количество дыхательных движений в минуту, учитывают случаи возникновения патологических форм дыхания (дыхание Чейн-Стокса, Кусмауля, Биота, агональное). Регистрацию проводят до и после введения вещества.
3.1.2. Метод оценки влияния веществ на частоту дыхания ненаркотизированных мышей
У ненаркотизированных мышей регистрируют число дыхательных движений за минуту после введения веществ с помощью механического счетчика. Можно грудную клетку мыши опоясать резиновым обручем, наполненным специальным составом и соединенным с записывающим устройством. Критерием подавления дыхания считают достоверное снижение частоты дыхательных движений по сравнению с контролем.
3.2.Метод оценки влияния на моторику желудочно-кишечного тракта
Висследованиях на мышах и крысах оценивают скорость продвижения активированного угля по кишечнику животных в сравнении с контрольной группой и группой, получившей препарат сравнения. Критерием снижения моторной деятельности ЖКТ считают достоверное уменьшение времени выхода активированного угля.
3.3.Методы оценки влияния веществ на температуру тела
Эксперименты проводят на мышах и крысах. Измеряют ректальную температуру
тела с помощью термодатчиков. При измерении температуры тела следует учитывать температуру окружающей среды. Различают три температурных режима (Gordon, 1990): холодная зона (4–6°С), характеризующая превалирование механизмов теплопродукции над теплоотдачей; 2) термонейтральная (комфортная) зона (27–28°С для крыс), при которой наблюдается баланс между теплопродукцией и теплоотдачей, осуществляемый за счет изменения тонуса сосудов («игра просвета сосудов»); 3) жаркая зона (32–33°С), при которой теплоотдача преобладает над теплопродукцией. В холодной среде гипотермический эффект вещества может усиливаться, а в жаркой среде у того же вещества может развиваться гипертермическая реакция. Критерием влияния веществ на температуру тела считали достоверное изменение ректальной температуры при сравнении с контрольной группой животных, находящихся в тех же условиях.
3.4. Метод оценки толерантности к антиноцицептивному действию
Вещества вводят 14 или 28 дней. Оценивают изменение анальгетической активности в тестах оценки болевой чувствительности. Для проведения исследования кросс-толерантности в день тестирования изучаемое вещество заменяют инъекцией морфина3 (5 мг/кг). Критерием развития толерантности считают отсутствие анальгетического действия или снижение анальгетического действия в группе, хронически получавшей вещество, относительно контрольной группы, хронически получавшей растворитель и в день тестирования получившей вещество.
Дополнительно оценивают влияние хронического введения на общее состояние по нарушению ушного и корнеального рефлексов, наличию судорог, тремора, птоза, прыжков, встряхиваний, стука зубами, синдрома Штрауба, чесания, чихания, бокового положения.
3.5.Методы оценки синдрома отмены
3.5.1.Метод оценки развития синдром отмены без провокации налоксоном
При оценке синдрома отмены без провокации налоксоном изучаемое соединение вводят 28 дней. На второй день после отмены вещества регистрируют анальгетическую
3 В соответствии с ФЗ от 08.01.1998 № 3-ФЗ (ред. от 03.12.2011) «О наркотических средствах и психотропных веществах».
208

активность, двигательную активность (например, в тесте открытое поле), общее состояние по нарушению ушного и корнеального рефлексов, наличию судорог, тремора, птоза, прыжков, встряхиваний, стука зубами, синдрома Штрауба, чесания, чихания, бокового положения. Критерием развития синдрома отмены считают появление гиперальгетического действия, стимулирование двигательной активности и изменение общего состояния животных, относительно контрольной группы животных, хронически получавших растворитель.
3.5.2. Метод оценки развития синдрома отмены с провокацией налоксоном
При оценке синдрома отмены с провокацией налоксоном изучаемое соединение или препарат сравнения морфин4 вводят внутрибрюшинно 2 раза в день (утром и вечером) в течение 5 дней по схеме 3 инъекции по 50 мг/кг, 3 инъекции по 75 мг/кг и 3 инъекции по 100 мг/кг. Синдром отмены провоцируют налоксоном (10 мг/кг, подкожно) через 5 ч после последней инъекции соединений [20].
Протокол исследования:
1 день в 10 часов — вещество (морфин) в дозе 50 мг/кг, в 16 часов — в дозе 50 мг/кг, 2 день в 10 часов — вещество (морфин) в дозе 50 мг/кг, в 16 часов — в дозе 75 мг/кг, 3 день в 10 часов — вещество (морфин) в дозе 75 мг/кг, в 16 часов — в дозе 75 мг/кг, 4 день в 10 часов — вещество (морфин) в дозе 100 мг/кг, в 16 часов — в дозе 100 мг/кг, 2 день в 10 часов — вещество (морфин) в дозе 100 мг/кг, в 15 часов — налоксон в дозе
10мг/кг.
Умышей регистрируют число прыжков, корчей, встряхиваний, тремора в виде барабанного боя и птоза на протяжении одного часа после инъекции налоксона. Критерием выраженности синдрома отмены считали уменьшение числа прыжковых реакций относительно группы, получавшей по такой же схеме морфин.
3.6.Методы оценки первично-подкрепляющих и стимульных свойств
3.6.1. Самовведение с необученными мышами
Методика позволяет с высокой вероятностью оценить наличие первичноподкрепляющих свойств у психоактивных веществ. Мышей помещают в парную клетку (8х8х8см), имеющую фронтальное отверстие с инфракрасными сенсорными датчиками, соединенными через компьютер с автоматической помпой. У мышей фиксируют хвост на горизонтальной поверхности. В течение 10 мин тестируют экспериментальных животных и подбирают пары, обладающие одинаковым уровнем активности заглядывания в отверстие. В хвостовую вену мышей вставляют катетер, который соединен с автоматической помпой. Через хвостовую вену мышь получает инфузию исследуемого вещества в ответ на определенную реакцию (например, заглядывание в отверстие в стенке). Одновременно тестируется две мыши. Первая, «активная», получает тестируемое вещество в ответ на совершенное действие, а другая, «пассивная», получает инфузию вещества независимо от собственной реакции одновременно с первой мышью. Рассчитывают R-критерий, представляющий десятичный логарифм отношения частоты оперантной реакции у «активных» и «неактивных» мышей. Критерием выраженности подкрепляющих свойств считается положительный R-критерий по сравнению с контрольной группой, получавшей внутривенное введение растворителя (при статистическом анализе используют тест Даннетта) [40].
3.6.2. Дискрименантные стимульные свойства (Drug discrimination)
Методика позволяет оценить фармакологическую природу субъективных состояний, вызываемых психоактивными веществами. При оценке риска развития лекарственной
4 В соответствии с ФЗ от 08.01.1998 № 3-ФЗ (ред. от 03.12.2011 г.) «О наркотических средствах и психотропных веществах».
209
зависимости (наркогенного потенциала) сравнивают интероцептивные эффекты эталонного препарата с известными наркогенными свойствами (например, морфина) с интероцептивными эффектами препарата исследования. В качестве объекта исследования могут использоваться млекопитающие (крысы, мыши, свиньи), птицы, приматы (саймири, бабуины). Животных обучают выполнению определенной инструментальной реакции альтернативного выбора (например, нажатию на одну из двух педалей в стандартной камере Скиннера) для получения подкрепления. После инъекции изучаемого вещества подкрепление выдается при нажатии на одну педаль, а после введения растворителя — на другую. При формировании навыка различения веществ у крыс с водной или пищевой депривацией возможно в различных оперантных режимах: режиме фиксированного отношения FRN (подкрепление предъявляют после каждого N-го нажатия на адекватный рычаг), фиксированного интервала FIN (подкрепляют нажатия, совершаемые через n сек после предыдущего) и т.д. Инъекции препарата или растворителя (дифференцируемые интерорецептивные стимулы) в процессе выработки лекарственной дифференцировки осуществляют в равновероятностной последовательности 1 раз в день. В целях контроля над возможным влиянием на процесс обучения врожденного предпочтения односторонних реакций в каждой группе половину животных обучают выбирать левый рычаг после введения психотропного средства и правый — после инъекции растворителя, а второй половине группы наоборот. Обучение проводят ежедневно 5 раз в неделю в течение 15 мин. Регистрируют % правильных оперантных реакций. Критерием стабильного навыка различения веществ считают воспроизведение 80%-го уровня правильных реакций в течение шести последовательных сеансов обучения на фоне действия каждого из дифференцируемого стимула [33]. При стабильном выполнении тестируют воспроизведение сформированного навыка в течение 2–3-х мин в отсутствии подкрепления адекватного поведения с целью определения уровня сформировавшегося навыка лекарственной дифференцировки [25]. После выработки у животного устойчивого навыка различения эталонного вещества и растворителя на основе заместительного тестирования осуществляют сравнительный анализ интероцептивных эффектов эталона и препарата исследования. Если при замене эталонного препарата на препарат исследования наблюдается 80% и более реакций, адекватных тренировочному препарату, то полагают, что интероцептивные эффекты сравниваемых веществ идентичны, что свидетельствует о наличии у изучаемого вещества сопоставимого с эталоном наркогенного потенциала.
У животных с выработанным навыком различения веществ можно провести тестирование на антагонизм с анализаторами с известным механизмом действия с целью выявления механизма действия изучаемого вещества.
3.6.3. Электрическая самостимуляция мозга. Автотитрование
Электрическая самостимуляция мозга — это еще один метод для исследования наркогенного потенциала вещества. Практически все известные вещества, вызывающие зависимость у человека, способны активировать реакцию, основанную на электрическом раздражении структур мозга (зоны «удовольствия», вентральная тегментальная область, медиальный переднемозговой пучок и др.), входящую в так называемую «систему награды», в ответ на выполнение животным определенного действия (инструментальной реакции).
Крысам имплантируют биполярные электроды в вентральную тегментальную область. Через 10 дней после вживления электродов крыс обучают нажимать на педаль в камере Скиннера для получения электрического раздражения мозга (прямоугольные импульсы отрицательной полярности, длительностью 1 мс, с частотой 100 Гц, в течение 0,4 с, пороговые значения тока в режиме «фиксированных пачек»). Для повторного раздражения животное было вынуждено вновь нажимать на педаль. Частота и длительность нажатий регистрировались автоматически. Анализировали частоту и время каждого нажатия на педаль. На основании этих результатов вычисляли коэффициент «рассогласования» [7]. Коэффициент «рассогласования» принимает значения от -1 до
210
