
4 курс / Оториноларингология / Иммуноцитологические_исследования_в_оториноларингологии_Арефьева
.pdf5.МЕТОДЫ ЗАБОРА И ОБРАБОТКИ МАТЕРИАЛА
Внастоящее время для забора исследуемого материала используется множество способов, каждый из которых обладает своими преимуществами и недостатками. Известны следующие методы забора материала (Шевры-
гин Б.В., 1998):
•метод отпечатков (непосредственное прикладывание к слизистой оболочке поверхности предметного стекла);
•метод перепечатков (материал забирают зондом, валиком, кото-
рыми затем делают отпечатки на предметном стекле);
•метод последовательных смывов и промываний;
•метод соскоба;
•пункционный метод (позволяющий получить материал из глу-
боких тканей);
•метод отпечатки кусочками тканей, удаленных дли гистологиче-
ских исследований.
Содержание изучаемых клеток в образцах зависит от способа получе-
ния материала (табл. 1.) и места забора образцов (табл. 2.) (Settipane G.A., 1999).
Таблица 1
Содержание клеток в биологических образцах в зависимости от способа получения материала (по Settipane,G.A.)
на примере слизистой оболочки носа
|
|
Методика забора |
|
||
Определяемые клетки |
|
|
|
|
|
отделяемое |
|
соскоб |
|
биопсия |
|
|
(секрет) |
|
|
|
|
|
|
|
|
|
|
Мерцательный эпителий |
нет |
|
да |
|
да |
Бокаловидные клетки |
нет |
|
да |
|
да |
Эозинофилы |
да |
|
да |
|
да |
Базофилы |
да |
|
да |
|
да |
Тучные клетки |
редко |
|
да |
|
да |
Нейтрофилы |
да |
|
да |
|
да |
Бактерии |
часто |
|
редко |
|
редко |
Подслизистый слой |
нет |
|
нет |
|
да |
|
|
|
|
|
|
|
50 |
|
|
|
|
Таблица 2
Клеточный состав риноцитограмм в зависимости от места забора образцов (по Guy A. Settipane)
|
Место забора |
Характеристика |
|
|
|
Нижняя носовая раковина: |
Много нейтрофилов, редко встречаются эозино- |
|
• |
передняя поверхность |
филы |
• |
средняя треть |
Респираторный эпителий с эозинофилъными и |
|
|
базофильными клетками |
|
|
|
Средняя носовая раковина |
Большое содержание эозинофилов |
|
|
|
|
Верхняя носовая раковина |
Трудно визуализируется, возможна стимуляция |
|
|
|
назального кардиального рефлекса |
|
|
|
Перегородка |
Кровотечение, редко – эозинофилы |
|
|
|
|
Наиболее распространенный эксфолиативный метод – метод мазков-пе-
репечатков, при котором для исследования используются лишь свободно ле-
жащие или готовые отторгнуться с поверхности слизистой оболочки клетки. Метод нетравматичный, хорошо переносится больными.
Для приготовления мазка перепечатка материал забирают ватным туп-
фером из-под средней носовой раковины или из лакун небных миндалин. За-
бранный материал вращательными движениями без надавливания наносят на предварительно обезжиренное предметное стекло. Полученные мазки высу-
шивают на воздухе. Фиксация проводится в 96% этаноле в течение 1 минуты.
Мазок окрашивают по методу Романовского-Гимза. Отмывание от краси-
теля производят дистиллированной водой. После высушивания образец изу-
чают под малым увеличением (х150) для определения качества окраски и ко-
личества клеток в мазке, затем микроскопируют под иммерсией при большем увеличении (х630).
Также возможно исследование материала, полученного из естествен-
ных полостей, например околоносовых пазух. Способ забора осуществляется следующим образом: промывные жидкости из пазухи получают по транс-
назальному катетеру. В зависимости от цели исследования материал забирают перед, во время или после проведения лечебных манипуляций. Промывные
51
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
жидкости центрифугируют 10 минут при 1500 об/мин, надосадочную жид-
кость удаляют и осадок перемешивают, каплю центрифугата наносят на пред-
метное стекло и аккуратно без нажима размазывают с последующим высу-
шиванием. Фиксация, окрашивание и микроскопия проводятся по выше-
описанному методу.
Иммуноцитологические исследования (иммуноцитограммы) в отори-
ноларингологии включают в себя изучение клеточного представительства слизистой оболочки носа, лакун небных миндалин, промывных жидкостей из пораженных пазух и отделяемого из уха. Просчитывают 200 клеток, опреде-
ляя процентное количество нейтрофилов, лимфоцитов, макрофагов, эозино-
филов, цилиндрического эпителия, плоского эпителия, безъядерной цито-
плазмы плоского эпителия.
Обязательным условием при изучении иммуноцитограмм является под-
счет абсолютного количества клеток в мазке (цитоз мазка), так как определе-
ние относительных показателей (процентного количества клеток) может дать ложное представление об истинном характере процесса. Например, если относительное количество нейтрофилов в риноцитограмме составляет 90%,
то при общем цитозе в 50 клеток – абсолютное количество составит 45
нейтрофилов, что не является признаком воспаления (у практически здоро-
вых лиц в мазке может находиться до 100 нейтрофилов). При цитозе в 1000
клеток абсолютное количество нейтрофилов составит 900 клеток, что интер-
претируется как воспалительный процесс.
И, наоборот, низкое процентное содержание нейтрофилов не является по-
казателем нормы, так как при высоком цитозе показатели абсолютного содер-
жания клеток в мазке будут повышены.
Изучение деструктивных процессов В клетках проводят по методу Л.А. Матвеевой (1986) с определением среднего показателя деструкции клеток (CПД), индекса цитолиза клеток (ИЦК), индекса деструкции клеток
(ИДК) по следующим формулам:
52
СПД= (1х n1+2х n2+3х nЗ+4х n4):100
ИЦК= n4: (n0+n1+n2+n3+n4)
ИДК5= (n1+n2+n3+n4): 100, где
0, 1, 2, 3, 4 — номера классов деструкции;
n0, n1, n2, nЗ, n4 — количество клеток соответствующего класса.
Деструкцию клеток оценивают по методике Л.А. Матвеевой (1986) (табл. 3).
Нулевой класс деструкции включает в себя целые клетки с нормальной структурой ядра и цитоплазмы (рис. 26, 27, 36, 37, 45, 46).
При первом классе деструкции ядро сохраняет нормальную структуру,
а цитоплазма подвергается частичному (не более половины) деструктивному повреждению (рис. 28, 29, 38, 39, 47).
Второй класс деструкции характеризуется частичным деструктивным повреждением ядра и значительным (более половины, но не полной) деструк-
цией цитоплазмы (рис. 30, 31, 40, 41).
При третьем классе деструкции ядро подвергается значительной (но не-
полной) деструкции, цитоплазма полностью деструктирована (рис. 32, 33, 42,
43, 46).
Ядро и цитоплазма клеток четвертого класса деструкции полностью де-
структированы (рис. 34, 35, 44, 47).
Помимо этого, определяют индекс модуляции цилиндрического эпи-
телия (отношение количества модулированных клеток к общему количеству цилиндрического эпителия), процент метаплазии цилиндрического эпителия в плоский (количество плоского эпителия и чешуек).
53
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Таблица 3
Деструкция клеток
Фагоцитарную активность нейтрофилов исследуют при наличии мик-
рофлоры в мазке, вычисляя процент фагоцитирующих нейтрофилов, содер-
жащих микробные клетки (рис. 48).
Среди фагоцитирующих нейтрофилов учитывают процент целых нейтрофилов, содержащих внутри клетки микроорганизмы, и процент раз-
54

рушенных нейтрофилов (l–4-гo классов деструкции), в протоплазме кото-
рых сохранились непереваренные микроорганизмы, и рассчитывают показа-
тель незавершенности фагоцитоза по формуле:
Nd/(Nc+Nd) x 100, где
Nd – число деструктированных нейтрофилов, содержащих в протоплазме не-
переваренные бактерии;
Nc – число целых нейтрофилов, содержащих микроорганизмы.
Показатель незавершенного фагоцитоза выражают в процентах.
Целые нейтрофилы с сохранённой структурой, содержащие внутри-
клеточно бактерии, расцениваются как адекватно фагоцитирующие клетки (рис. 49), деструктированные нейтрофилы (клетки с поврежденной мембраной и разрушенным ядром) с наличием микроорганизмов внутри клетки – это клетки, не способные их переварить (рис. 50).
Рис. 26. Целые нейтрофилы (0 класс деструкции) в назальной слизи больного острым гнойным риносинуситом (х630)
55
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
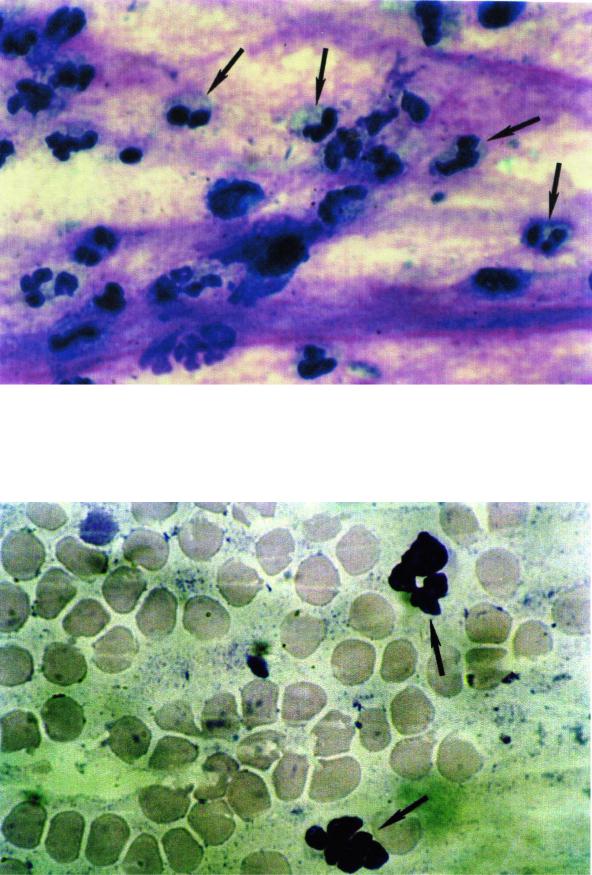
Рис. 27. Целые нейтрофилы (0 класс деструкции) промывных жидкостей из воспаленной пазухи больного хроническим гнойным риносинуситом (х630)
Рис. 28. Нейтрофилы со слизистой оболочки носа 1-го класса деструкции (х630)
56

Рис. 29. Нейтрофилы промывных жидкостей из воспаленных пазух 1-го класса деструкции (х630)
Рис. 30 Нейтрофилы назальной слизи 2-го класса деструкции (х630)
57
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Рис. 31. Нейтрофилы промывных жидкостей из воспаленных пазух 2-го класса деструкции (х630)
Рис. 32. Нейтрофилы назальной слизи: 1 – 2-й класс деструкции;
2 – 3-й класс деструкции
58

Рис. 33 Нейтрофилы назальной слизи: 1 – 2-й класс деструкции;
2 – 3-й класс деструкции
Рис. 34. Нейтрофил со слизистой оболочки носа
4-го класса деструкции (х630)
59
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
