
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_1_Ашер_А_,_Покровский_А_В_
.pdf
Глава 4. Внутрисосудистое ультразвуковое исследование |
65 |
|
|
Рис. 4.7. Изображение ВСУЗИ пораженной атеросклерозом подвздошной артерии человека. Большая кальцинированная бляшка (отмечена стрелками) создает яркую линию просвета с акустической тенью позади; u — полость ультразвукового катетера; a — артефакт изображения. (С разрешения Tabarra M. et al. In-vivo human comparison of intravascular ultrasound and angiography. J. Vasc Surg 1991: 14:496–504.)
шечного типа нелегко получить в больших сосудах, таких как аорта, ввиду того что в их медии содержится повышенное количество эластина.
Устройства для внутрисосудистого УЗИ чувствительны при дифференциации кальцинированных и некальцинированных поражений. Поскольку волна ультразвука сильно отражается от кальцинированной бляшки, она изображается как яркий объект с плотной акустической тенью позади него (рис. 4.7; см. рис. 4.4 и 4.5).
По этой причине точное расположение медии и адвентиции нельзя увидеть в сегментах сосудов, пораженных выраженным кальцинозом, и размеры должны быть оценены путем интерполирования данных с прилежащих участков. Gussenhoven с соавторами описали четыре основных компонента бляшки, которые можно различить при использовании 40-МГц ВСУЗИ in vitro [19]: эхопрозрачные отложения липидов, или «липидные озера»; мягкие эхо-сигналы фибромышечной ткани, или интимальная пролиферация, включающая различные количества диффузно рассеянных липидов; яркие эхо-сигналы богатой коллагеном фиброзной ткани; и яркие эхо-сигналы с акустической тенью кальцинированной ткани.
В многочисленных исследованиях проводилось сравнение ангиографии и ВСУЗИ по их способности к внутрипросветным и чресстенным измерениям нормальных и умеренно пораженных атеросклерозом артерий человека [18, 20, 21]. Площади поперечного сечения, вычисленная с помощью ангиограмм в двух плоскостях и измеренная с помощью ВСУЗИ, хорошо коррелируют друг с другом при оценке нормальных или минимально измененных периферических артерий in vivo. В большинстве исследований обнаружено, что данные ВСУЗИ и ангиографии также хорошо коррелируют, когда их используют для визуализации слегка эллиптических просветов, но при получении измерений тяжело пораженных сосудов ангиограммы склонны к недооценке тяжести заболевания. Являясь методом определения просветной и чресстенной морфологии и измерений, ВСУЗИ открывает новые перспективы в изучении заболеваний артерий.
Проводилось также сравнение двух- и трехмерного ВСУЗИ с ангиографией и трехмерной компьютерной томографией (КТ) при визуализации аневризм брюшной аорты [22]. Каждый метод дает уникальную информацию относительно анатомии аорты и распределения компонентов аневризмы (рис. 4.8). В рассматриваемом случае аортограмма показывает, что аневризма ограничена инфраренальным отделом аорты, и доказывает проходимость прилежащих ветвей артерий. Морфология просвета, изображенная на ангиограмме, недооценивает размеры аневризмы, хотя смещение правого мочеточника предполагает большую величину. Кроме того, ангиограмма не дает точных величин площади поперечного сечения и волюметрических данных, относительно шейки
Рис. 4.8. Слева направо: аортограмма, продольное ВСУЗИ в серой шкале, поверхностно-очерченное трехмерное ВСУЗИ и трехмерная КТ наружной поверхности аневризмы аорты. Изображения имеют сравнимую длину аорты со сходным качеством изображения для сравнения этих методов. (С разрешения White RA, et al. Innovations in vascular imaging angiography, 3D CT and 2D and 3D intravascular ultrasound of an abdominal aortic aneurysm. Ann Vasc Surg 1994: 8: 285–289.)

66 |
Раздел I. Техника визуализации |
|
|
|
|
аневризмы, количества тромботических масс, характеристик стен- |
витии будущих интервенционных методов, таких как внутрисо- |
|
ки аорты и других находок, очевидных при КТ и ВСУЗИ. |
судистая установка графтов, будут использованы специфические |
|
|
Изображения поперечного сечения аневризмы, полученные |
возможности каждого из методов для увеличения точности эндо- |
при КТ и ВСУЗИ, позволяют точно определить размеры про- |
васкулярных восстановительных вмешательств. В частности, ВСУ- |
|
света и стенок и тесно коррелируют на разных уровнях аорты. Ок- |
ЗИ используется для определения размеров и оценки характе- |
|
ружающие анатомические структуры и характеристики сосуди- |
ристик стенки аорты и аневризмы перед раскрытием графта, для |
|
стой стенки были выявлены при использовании обоих методов |
наиболее точного расположения устройства во время процедуры |
|
(рис. 4.9). Изображения при ВСУЗИ демонстрируют отхождение |
и для оценки правильности установки графта. |
|
висцеральных сосудов (верхней брыжеечной и почечных артерий) |
Обычная ангиография не способна обеспечить достаточно де- |
|
по отношению к аневризме и дифференцируют участки кальци- |
тальную информацию относительно эффекта эндоваскулярных |
|
фикации в сравнении с тромбом и фиброзными компонентами |
вмешательств. Для ясной оценки этих новых методов необходи- |
|
стенки. Кальцификация четко определяется при ВСУЗИ как ги- |
мо знать консистенцию бляшек и распределение резидуальных |
|
перэхогенные участки с затенением позади поражения. Кальци- |
поражений после вмешательств. Визуализация с помощью внут- |
|
фикация стенки аорты более отчетливо выявляется при ВСУЗИ, |
рисосудистого УЗИ дает возможность тщательно измерить сте- |
|
чем при ангиографии или КТ. Хотя двухмерные изображения по- |
нозы за счет сравнения размеров просвета с нормально выглядя- |
|
перечного сечения, полученные с помощью КТ и ВСУЗИ, близки |
щими прилежащими ветвями сосудов. Это связано отчасти с |
|
в определении измерений просвета и сосудистой стенки, трехмер- |
ограничением артериографии одним или двумя измерениями, а |
|
ные реконструкции ВСУЗИ показали некоторые отличия формы |
|
|
и топографии поверхности стенки вдоль продольной оси аневриз- |
|
|
мы в сравнении с данными, полученными при трехмерной компь- |
|
|
ютерной томографии. Трехмерная КТ очерчивает наружную поверхность аорты, в то время как ВСУЗИ позволяет визуализировать просвет и трансмуральные характеристики стенок. В раз-
Рис. 4.9. Сравнение изображений при ВСУЗИ (сверху) и КТ (снизу) аневризмы в одном и том же месте. l — просвет аорты; t — тромб в полости аневризмы; c — кальцификация; IVC — нижняя полая вена; v — тело позвонка. (С разрешения White RA, et al. Innovations in vascular imaging angiography, 3D CT and 2D and 3D intravascular ultrasound of an abdominal aortic aneurysm. Ann Vasc Surg 1994: 8: 285–289.)
А
Б
Рис. 4.10. (A) Полная цилиндрическая реконструкция сосуда с наружной границей, образованной адвентицией. (Б) Реконструкция просвета того же сосуда. При вычитании объема просвета из объема цилиндра всего сосуда можно получить объем сосудистой стенки (пораженной или неизмененной). (С разрешения Cavaye DM, et al. Three-dimensional vascular ultrasound imaging. In Cavaye DM, White RA, eds. A text and atlas of arterial imaging: modern and developing technologies. London: Chapman & Hall, 1993: 143–147.)

Глава 4. Внутрисосудистое ультразвуковое исследование |
67 |
|
|
также с тем фактом, что ангиограмма является более просветным силуэтом, нежели трансмуральным изображением стенок.
Трехмерное ВСУЗИ может использоваться для демонстрации объема атеросклеротического поражения, его распространения
ихарактеристик ткани, что особенно ценно для изучения естественного течения атеросклеротической болезни и для волюметрических исследований бляшек до и после эндоваскулярных вмешательств. Объем поражения может быть измерен с помощью трехмерного ВСУЗИ, однако в настоящий момент нет данных относительно точности подобных измерений. Расчет объема бляшки основывается на понятии разницы цилиндрических объемов, когда внутренний (меньший) цилиндр представлен просветом сосуда, а внешний (больший) цилиндр ограничен адвентицией. Оба этих объема могут быть выявлены за счет создания поверхностно-ог- раниченного изображения просвета и полной реконструкции адвентиции сегмента сосуда (рис. 4.10). Такая разница между двумя цилиндрами представляет «объем», занятый компонентами стенки сосуда, как нормальными, так и патологическими. Данный объем измеряется до и после таких вмешательств, как эндартерэктомия,
иразница в объеме представляет количество собственно удаленного элемента поражения. Эта информация требуется для выявления механизмов неудач ангиопластики, так как роли резидуального и рекуррентного стенозов не были адекватно определены доступными ангиографическими данными. Внутрисосудистое УЗИ предоставляет существенную информацию для исследования расслоений артериальной стенки за счет определения размера, локализации
истепени отслоений интимы (рис. 4.11). Поскольку визуализа-
Рис. 4.11. Изображение внутрисосудистого УЗИ дистальной части брюшной аорты у пациента с острым расслоением аневризмы аорты подтверждает распространение расслоения до этого уровня. Видны отслоившийся лоскут (двойные стрелки), стенка аорты (одиночная стрелка), истинный (T) и ложный (F) просветы. (С разрешения Cavaye DM, et al. Intravascular ultrasound imaging of the acute dissecting aortic aneurysm: a case report. J Vasc Surg 1991; 13: 510–512.)
ция при ВСУЗИ происходит динамически в реальном времени, можно увидеть движение артериальных отслоений во время систолического и диастолического токов крови. Важно точное определение места и ориентации отслойки, так как оно может определить необходимость иссечения и установки графта, стента или хирургического восстановления. Внутрисосудистое УЗИ используется для определения локализации и тяжести расслоения и отслоения и позволяет произвести оценку и лечение на эндоваскулярном этапе [23–26]. Особенно информативно в этой роли трехмерное ВСУЗИ, поскольку расслоение аорты обычно проявляется в спиральных или имеющих сложную форму отслоениях, которые трудно оценить в трех измерениях, используя иные способы визуализации. Трехмерные реконструкции позволяют выявить начальный участок расслоения, степень отслоения и отношение ложного просвета к крупным висцеральным ветвям, что играет роль в экспериментальном эндопротезировании расслоения стенок аорты.
Внутрисосудистое УЗИ как дополнение к эндоваскулярным вмешательствам
Проведенные исследования показали, что при чрескожной транслюминальной баллонной ангиопластике (ЧТБА), размер баллона при выборе, сделанном на основе количественной ангиографии, зачастую оказывается неверным, и что оптимальный размер баллона более точно определяется при ВСУЗИ [27]. По другим данным, ангиография при баллонной ангиопластике чаще успешна, когда тяжелые поражения прорываются расслоениями, распространяющимися в медию сосуда, в то время как неудачи ангиографии происходят при поражениях, которые не смещаются, или когда происходят циркулярные расслоения или отслоения интимы [28]. Успех применения ангиографии при мягких бляшках обусловлен поверхностными щелями или разломами поверхности (в просвете), в то время как реакция сосуда и разрушение внутреней поверхности или тромбоз в местах разрыва бляшек приводят к неудаче. Внутрисосудистое УЗИ способно выявить все эти особенности и предоставить бесценную информацию, от которой будет зависеть определение возможности использования при этих поражениях баллонной ангиопластики.
Благодаря обобщению информации о консистенции бляшки и стенки сосуда с данными о локализации поражения, такими как эксцентричность, и оценке резидуального стеноза и расслоений, ВСУЗИ идеально подходит в качестве скринингового и управляющего метода улучшения результатов баллонной ангиопластики [29, 30]. В клинической практике с многообещающими результатами был использован баллонный ультразвуковой визуализирующий катетер (BUIC; Boston Scientific, Watertown, MA). Подтверждено, что одноплоскостные изображения можно получить через срединный разрез в баллоне для ангиопластики в любой момент во время процедуры, и такие особенности просвета, как разрыв бляшки или эластическая отдача, могут быть отображены с помощью ВСУЗИ в реальном времени до раздувания, во время раздувания и после раздувания баллона [31, 32]. Периферическая баллонная ангиопластика при мониторировании с помощью ВСУЗИ оказалась особенно полезной в идентификации и оценке величины эффекта отслоения интимы [9].
В предварительных исследованиях ВСУЗИ использовалось для локализации и лечения коарктации аорты как экспериментально, так и клинически [33]. Внутрисосудистое УЗИ ясно показывает коарктацию и точно измеряет прилежащий нормальный просвет аорты для определения размера баллона. После дилата-

68 Раздел I. Техника визуализации
Рис. 4.12. Изображение внутрисосудистого УЗИ протяженного сегмента коронарной артерии после ротерной эндартерэктомии и баллонной ангиопластики. Представлены девять поперечных изображений с 3-мм диаметром. Слева представлены более дистальные изображения, отображают диссекцию циркулярно-расположенной кальцинированной бляшки. Имеется тяжелый протяженный и циркулярный кальциноз, особенно в зоне остаточного просвета, с размерами 2,3 х 2,7 мм. Использовался наибольший бур — 2,15 мм с баллоном размерами 3,0 мм. ( С разрешения Mintz GS,et al. Intravascular ultrasound evaluation of the effect of rotational atherectomy in the atherosclerotic coronary artery disease. Circulation 1992; 86:13831393.)
ции ВСУЗИ отражает внешний вид дилатации, включая подтвер- |
Внутрисосудистое УЗИ является методом управления раскры- |
ждение расслоений. |
тия и оценки эффекта внутрисосудистого стента в периферических |
Внутрисосудистое УЗИ использовалось как метод изучения |
сосудах. Оно позволяет осуществить правильный выбор размера |
механизма действия и функции устройств для эндартерэктомии, |
стента для конкретного сосуда и определить наиболее подходящую |
лазеров и стентов [34–36]. Для каждого типа интервенционного |
позицию для стентирования. Двух- и трехмерное ВСУЗИ идеаль- |
устройства комбинация возможностей управления и оценки сте- |
но подходит для оценки сосудистых сегментов до и после установ- |
пени тяжести с помощью ВСУЗИ и техники вмешательства может |
ки стента. При этом может быть получена уникальная информа- |
предоставить особые преимущества для конкретного типа подхо- |
ция относительно адекватности установки и изменений |
да. На рис. 4.12 демонстрируется использование изображения |
морфологии, создаваемых стентом (рис. 4.13). |
ВСУЗИ при выборе размера устройства для атерэктомии и балло- |
|
нов для лечения поражений коронарных артерий [35]. |
|
A |
|
Б |
|
|
|
Рис. 4.13. (A) Изображение внутрисосудистого УЗИ стента в артерии, кажущийся полностью раскрытым по данным флюороскопии, но потребовавший дополнительного раздувания баллона (ВСУЗИ в рельном времени) IVUS до полного расширения; (Б) каркас стента (одна стрелка), стенка артерии (две стрелки).

Глава 4. Внутрисосудистое ультразвуковое исследование |
69 |
|
|
Бляшка
Медиа
Медиа
Бляшка
Рис. 4.14. Основы характеристики тканей. Левое изображение построено на основании чистых радиочастотных данных. Одна линия этой информации показана справа с помеченными соответствующими элементами тканей. Изображение построено при обработке амплитуды этого сигнала. Больше данных о специфических типах тканей, тем не менее возможно получить при компьютерном анализе чистого сигнала. Изображение и сигнал взяты от прототипа системы (Cardiovascular Imaging Systems, Inc., Sunnyvale, CA), которая комбинирует изображение и характеристики тканей. ( С разрешения Yock PG, et al. Clinical applications of intravascular ultrasound imaging. In: Bernstein EF, ed. Vascular diagnosis, 4th edn.Chicago: Mosby Year Book Medical Publishers, 1993: 994–1000.)
Перспектива применения внутрисосудистого УЗИ
Внутрисосудистое УЗИ представляет собой инвазивную процедуру, при которой используется пункция сосуда и введение катетера. Его диагностические возможности расширяются при совмещении с инвазивными исследованиями, такими как периферическая ангиография или катетеризация полостей сердца, или как метод управления лечебными процедурами, включая ангиопластику и установку стента. Возможности ВСУЗИ варьируют от уточнения локализации сосудистых опухолей перед хирургическим вмешательством [37] или визуализации длительно функционирующих кава-фильтров [38] до применения в качестве основного метода управления лазерной ангиопластикой [39].
Приоритетом разработок технологии ВСУЗИ является необходимость дальнейшей миниатюризации и достижения объективного соотношения цены и качества в производстве устройств и их компонентов. Существующие в настоящее время устройства относительно дороги, и если подразумевается, что техника должна быть клинически полезной при использовании одноразовой катетерной системы для диагностического или лечебного вмешательства, то цена единичных комплектов должна быть определена преимуществами визуализации с помощью ВСУЗИ.
Будущие проводниковые устройства для ангиопластики могут комбинировать преимущества ангиоскопии и ВСУЗИ в единой доставляющей системе, пригодной для включения устройств для механической или лазерной абляции. Ангиоскопия позволит проводить визуальный осмотр просвета, а ультразвуковой компонент — определение характеристик и измерение стенки сосуда. Дополнительным преимуществом этого типа проводниковых устройств будет возможность выбора наиболее подходящего метода абляции для конкретного типа или размера бляшки. Определение характеристик тканей с помощью анализа радиочастотного ультразвукового сигнала подает надежды в дифференциации типов бляшек (рис. 4.14).
Внутрисосудистое УЗИ также предоставляет широкие возможности для сосудистых исследований, включая изучение податливости кровеносных сосудов, динамические изменения в стенке сосуда, вызванные заболеванием или воздействием фармакологического агента, а также естественное изучение атеросклероза.
Литература
1.Born N, ten Hoff H, et al. Early and recent intratuminal ultrasound devices. Int J Card Imaging 1989; 4: 79–88.
2.Cieszynski T. Intracardiac method for the investigation of structure of the heart with the aid of ultrasonics. Arch Immunol Ther Dow 1960; 8: 551–557.
3.Kossof G. Diagnostic applications of ultrasound in cardiology. Australas Radiol 1966; 10: 101–106.
4.Carleton RA, Sessions RW, Graettinger JS. Diameter of heart measured by intracavitary ultrasound. Med Res Eng 1969; May: 28–32.
5.Frazin 1., Talano JV, et al. Esophageal echocardiography. Circulation 1976; 54: 168–171.
6.Born N, Lancee CT, Van Egmond FC. An ultrasonic intracardiac scanner. Ultrasonics 1972; 10: 72–76.
7.Lockwood CR, Ryan LK, Foster FS. High frequency intravascular ultrasound imaging. In Cavaye DM, White RA, eds. Arterial imaging: modern and developing technologies. London: Chapman & Hall, 1993; 125–129.
8.Yock PG, Linker DT, Angelsen BAJ. Two-dimensional intravascular ultrasound: technical development and initial clinical experience. J Am Soc Echocardiogr 1989; 2(4): 296–304.
9.Heffernan PB, Robb RA. A new method for shaded surface display of biological and medical images. IEEE Trans Med Imaging 1985; MI-4: 26–38.
10.Cavaye DM, Tabbarra MR, et al. Three dimensional vascularultrasound imaging. Am Surg 1991; 57: 751–755.

70 Раздел I. Техника визуализации
11.van Urk H, Gussenhoven WJ, et al. Assessment of arterial disease and arterial reconstructions by intravascular ultrasound. IntJ Card Imaging 1991; 6: 157–164.
12.Burns PN, Goldberg BB. Ultrasound contrast agents for vascular imaging. In: Cavaye DM, White RA, eds. Arterial imaging: modern anddevelopingtechnologies.London:Chapman&Hall,1993:61–67.
13.Gussenhoven WJ, Essed CE, Lancee CT. Arterial wall characteristics determined by intravascular ultrasound imaging: an invitro study. J Am Coli Cardiol 1989; 14: 947–952.
14.Kopchok CE, White RA, et al. Intraluminal vascular ultrasound: preliminary report of dimensional and morphologic accuracy. Ann Vasc Surg 1990; 4: 291–296.
15.Kopchok GE, White RA, White G. Intravascular ultrasound: a new potential modality for angioplasty guidance. Angiology 1990; 41: 785–792.
16.Mallery JA, Tobis JM, et al. Assessment of normal and atherosclerotic arterial wall thickness with an intravascular ultrasound imaging catheter. Am Heart J 1990; 119: 1392–1400.
17.Nissen SE, Grines CL, et al. Application of new phasedarray ultrasound imaging catheter in the assessment of vascular dimensions. Circulation 1990; 81: 660–666.
18.Nissen SE, Gurley JC, et al. Intravascular ultrasound assessing of lumen size and wall morphology in normal subjects and patients with coronary artery disease. Circulation 1993; 88: 1087–1099.
19.Gussenhoven WJ, Essed CE, et al. Intravascular echo-graphic assessment of vessel wall characteristics: a correlation with histology. Int J Card Imaging 1989; 4: 105–116.
20.Tabbara MR, White RA, et al. In-vivo human comparison of intravascular ultrasound and angiography. J Vasc Surg 1991; 14: 496–504.
21.Tobis JM, Mahon D, et al. The sensitivity of ultrasound imaging compared to angiography for diagnosing coronary atherosclerosis [abstract]. Circulation 1990; 82 (Suppl III): 439.
22.White RA, Scoccianti M, et al. Innovations in vascular imaging: angiography, 3D CT and 2D and 3D intravascular ultrasound of an abdominal aourtic aneurysm Ann Vasc Surg 1994; 8: 285–289.
23.Cavaye DM, French WJ, et al. Intravascular ultrasound imaging of an acute dissecting aortic aneurysm: a case report. J Vasc Surg 1991; 13: 510–512.
24.Pandian NG, Fries A, et al. Intravascular high frequency twodimension detection of arterial dissection and intimal flaps. Am J Cardiol 1990; 65: 1278–1280.
25.Neville RF, Yasuhara H, et al. Endovascular management of arterial intimal defects: an experimental comparison by arteriography, angioscopy and intravascular ultrasonography. J Vasc Surg 1991; 13: 496–502.
26.Cavaye DM, White RA, et al. Usefulness of intravascular ultrasound for detecting experimentally induced aortic dissection in dogs and for determining the effectiveness of endoluminal stenting. Am J Cardiol 1992; 69: 705–707.
27.Cacchione J, Nair R, Hodson J. Intracoronary ultras ound is better than conventional methods for determining optimal PTCA balloon size [abstract]. J Am Coll Cardiol 1991; 17: 112A.
28.Leon M, Keren G, et al. Intravascular ultrasound assessment of plaque responses to PTCA helps to explain angiographic findings [abstract]. J Am Coll Cardiol 1991; 17: 47A.
29.Davidson CJ, Sheikh KR, et al. Intracoronary ultrasound evaluation of interventional procedures [abstract]. Circulation 1990; 82(Suppl III): 440.
30.Gurley J, Nissen S, et al. Comparison of intravascular ultrasound following percutaneous transluminal coronary angioplasty [abstract]. Circulation 1990; 82: 90.
31.Crowley RJ, Hamm MA, et al. Ultrasound guided therapeutic catheters: recent developments and clinical results. Int J Card Imaging 1991; 6: 145–156.
32.Isner JM, Rosenfield K, et al. Combination balloonultrasound imaging catheter for percutaneous transluminal angioplasty. Circulation 1991; 84: 739–754.
33.Sanzobrino B, Gillam L, et al. A direct clinical role for intravascular ultrasound: utility in the assessment of coarctation of the aorta [abstract]. J Am Coll Cardiol 1991; 17: 68A.
34.Smucker ML, Scherb DE, Howard PE Intra-coronary ultrasound: How much «angioplasty effect» in atherectomy? [abstract]. Circulation 1990; 82(Suppl): 676.
35.Mintz G, Potkin B, et al. Intravascular ultrasound evaluation of the effect of rotational atherectomy in obstructive athereroscierotic coronary disease. Circulation 1992; 86: 1383–1393.
36.Cavaye DM, Tabbara MR, et al. Intravascular ultrasound assessment of vascular stent deployment. Ann Vasc Surg 1991; 5: 241–246.
37.Barone GW, Kahn MB, et al. Recurrent intracaval renal cell carcinoma: the role of intravascular ultrasonography. J Vasc Surg 1990; 13: 506–509.
38.Greenfield LJ, Tauscher JR, Marx V. Evaluation of a new percutaneous stainless steel Greenfield filter by intravascular ultrasonography. Surgery 1991; 109: 722–729.
39.White RA, Kopchok GE, et al. Intravascular ultrasound guided holmium: YAG laser recanalization of occluded arteries. Lasers Surg Med 1992; 12: 239–245.

Глава 5
Основы ангиографии
Харвей Л. Найман, Джеймс Б. Лайонс
За последние четыре десятилетия, с тех пор, когда Сельдингер впервые описал коаксиллярную технику катетеризации, ангиография претерпела изменения [1]. Ряд технических новшеств привел к значительной безопасности и диагностической эффективности, а также к активному применению данного метода. Отсутствие визуализационных исследований, таких как компьютерная томография (КТ), ультрасонография и магнитно-ядерный резонанс (МРТ), больше доказывало, чем оправдывало роль ангиографии, занимавшей ключевое место в обследовании пациента. Фактически эти новые методы визуализации часто прибавляли уверенности в необходимости последующего более детального артериографического исследования, нередко с лечебным вмешательством.
Ангиография/интервенционная радиология — это проблем- но-ориентированная дисциплина, требующая диагностической проницательности, понимания патофизиологии сосудистых заболеваний, технического мастерства и широких знаний лечения сосудистых заболеваний. Это мастерство позволяет интервенционистам принимать участие в диагностике и лечении пациентов с сосудистой патологией и предлагать технику, когда инвазивное лечение обосновано.
История ангиографии
Основы ангиографии были заложены сообщением Рентгена об открытии Х-лучей в 1895 г. [2]. Первое ангиографическое исследование было проведено Haschek и Lindenthal спустя месяц после классического описания Рентгена. Эти авторы ввели инъкционно раствор, содержащий мел (смесь Тейхмана), в кровеносный сосуд ампутированной кисти [3]. Впервые ангиографическое исследование как артерий, так и вен у живых пациентов выполнено Berbich и Hirsh в 1923 г. с использованием 20%-ного бромида стронция [4]. А первое
медицинское применение ангиографического исследования отмечено в 1924 г., когда Brooks предложил ангиографические исследования при ампутации конечности [5]. В 1928 г. Moniz и Diaz сообщили о первой попытке визуализации мозговой циркуляции путем инъекции радиоактивной суспензии оксида тория в выделенную хирургически сонную артерию [6]. McPheeters и Rice в 1929 г. использовали йодинизированное маковое масло (Липиодол) для визуализации вен нижних конечностей [7].
Возникшие дисциплины — ангиография и венография — до появления органического йодистого контраста и развития элементарной катетерной техники применялись редко. В 1929 г. Moses сообщил об использовании для внутривенной урографии органического йодида (названного Урозолектан), толерантность к которому была лучше, чем к йодиду натрия [8]. Урозолектан был впоследствии вытеснен более совершенными веществами — диодтрастом (Диодоне) и неойопаксом (Уроселектан В) [9]. В последующие годы Forsmann устанавливал катетер через кубитальную вену и выполнял радиографию, предполагая, что катетер находится в правом предсердии [10]. В 1931 г. Moniz и его коллеги успешно визуализировали правое сердце и легочные сосуды пациента, применяя технику Forsmann [11]. Бесполезность интравенозных инъекций контрастного вещества для артериального контрастирования стала ясна, когда Casstellanos с соавторами в 1937 г. опубликовали результаты своих исследований [12]. Их работа была сфокусирована на диагностике кардиальных аномалий и ограничена из-за невозможности контрастировать левое сердце; полученные после интравенозных инъекций изображения были часто неадекватными. В 1939 г. Robb и Streinberg подробно изложили технические аспекты визуализации сердца, включавшие сообщения о быстрой смене экспозиции [13].
В 1935 г. Zeides des Plantes показал, что фотографическое субтракционное изображение используется для разделения по плотно-

72 Раздел I. Техника визуализации
А |
|
Б |
|
|
|
В |
|
Г |
|
|
|
Рис. 5.1. Цифровая субтракционная ангиограмма полученная в пошаговом режиме. Получено «реальное время» цифрового субтракционного изображения. Исследование проведено с помощью 85 мл контраста с визуализацией сосудистой системы от диафрагмы до стопы. (А) Среднее атеросклеротическое поражение абдоминальной аорты с одной почечной артерией с обеих сторон (стрелки). Визуализируется частичная проходимость чревного ствола и верхней брыжеечной артерии. (Б) Отмечается окклюзия левой поверхностной бедренной артерии (стрелка). (В) Визуализируются признаки умеренного атеросклеротического поражения правой поверхностной бедренной артерии и окклюзия левой поверхностной бедренной артерии. (Г) Восстановление (контрастирования) левой подколенной артерии в приводящем канале.
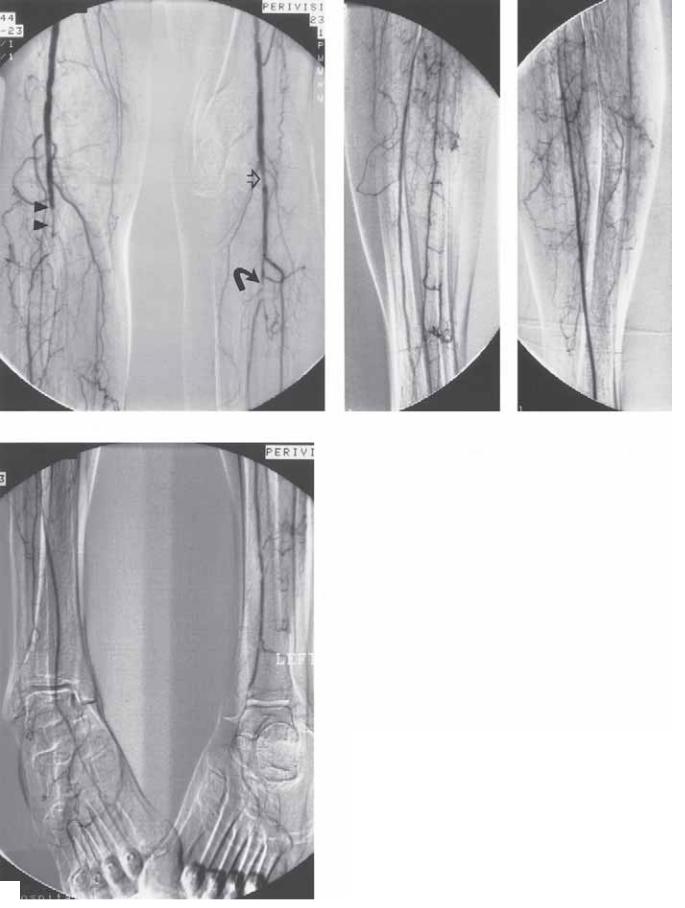
Глава 5. Основы ангиографии |
73 |
|
|
Д |
|
Е |
|
Ж |
|
|
|
|
|
Рис. 5.1. (Окончание.) (Д) Изображение подколенной зоны, демонстрирующее умеренный стеноз левой подколенной артерии на уровне щели коленного сустава (стрелка). Окклюзия левого тибиоперониеального ствола (круглая стрелка). Окклюзия правой подколенной артерии (2 заштрихованных стрелки) с уровня щели коленного сустава. (Е) Боковой вид левой нижней конечности, демонстрирующий 2 артерии оттока. Малоберцовая артерия значимо атеросклеротически поражена. (Ж) Боковой вид правой нижней конечности, демонстрирующий одну артерию оттока. (З) Изображение лодыжек и стопы смещено из-за
З |
движения пациента. |
|

74 Раздел I. Техника визуализации
сти структур контрастом, выделяемым костью или другими нормальными анатомическими структурами [14]. Применение этой концепции с использованием компьютерной цифровой субтракционной техники является перспективной областью артериографии сегодня.
Ретгроградная плечевая аортография была описана в 1939 г. Castellanos и Pereiras [15]. В 1941 г. Farinas сообщил о ретроградном введении катетера через бедренную артерию в абдоминальную аорту для аортографии [16]. Однако современная эра ангиографии начинается в 1953 г. с описания Сельдингером транскутанного трансфеморального метода катетеризации по проводнику [1]. Следующие основные достижения включают коронарную артериографию, фармакоангиографию для диагностики и руководства при гастроинтестинальных кровотечениях или ишемии, почечную, панкреатическую и печеночную ангиографию, так же как ряд других описанных техник. Параллельные изменения равных по важности технических приемов затронули следующие: развитие быстрого фильмирования (кадрирования), бипланарного изображения, компьютерной цифровой субтракции, катетерной технологии, низкоосмомолярного контраста, баллонных катетеров, стентов, и стент-графтов. Компьютерная цифровая субтракционная ангиография применяется для отображения изолированной сосудистой анатомии без накладывающихся анатомических образований. За счет этого повышается контрастное разрешение (рис. 5.1).
Технические принципы
Ангиографическое оборудование
Стандартный ангиографический кабинет должен иметь высококачественную флюорографическую систему, позволяющую проводить видеомониторинг. Процедуры не должны осуществляться без флюороскопического наведения. Цифровая основа современных флюороскопических систем обеспечивает такие возможности, как снижение лучевой нагрузки, получение изображений без пленки, ориентировочное картирование, анализ изображений в режиме реального времени и создание трехмерных конструкций [17].
Для обеспечения оптимальных уровней киловольтажа при минимальном времени экспозиции необходим также высокопроизводительный трехфазный генератор с постоянной нагрузкой на выходе мощностью не менее 100 кВт при 100 кВ. Для полной отдачи генератора и стабильности вольтажа во время исследования необходим хорошо продуманный источник электропитания, независмый от других линий госпиталя. В генератор Х-лучей должна так же быть встроена линия автоматической компенсации вольтажа.
Для всех типов традиционных экранно-пленочных ангиографических исследований дополнительно необходима возможность быстрой смены кассет с пленкой. Однако современное оборудование позволяет получать и выдавать на дисплей рабочей станции цифровое изображениевысокогоразрешения,чтоделаетпленкуненужной. Возможно так же формирование как локальных, так и расширенных рабочих сетей, с включением операционных с архивами для хранения изображений в том илиином виде. Возможность исследованиявдвух проекциях может быть полезна, так как изображение, полученное в одной проекции, не всегда точно отображает имеющиеся отклонения. При отсутствии возможности исследования в двух проекциях часто приходится делать последовательные снимки во второй проекции.
Для артериографии нижних конечностей должно быть доступно программное обеспечение, связанное с пошаговым движением стола. Пошаговая настольная платформа или движущийся портал могут использоваться в соединении со стандартной покадровой установкой и специализированным управляемым компьютером —
оборудованием, которое позволяет устройству совершать предварительно заданные интервалы. Автоматический пошаговый метод также доступен и для цифровой субтракционной ангиографии [18]. Мы применяли эту технику многие годы с отличными результатами. Надо отметить, что в нашем отделении мы вообще не применяем пленочную технику.
Проведение процедуры облегчает ангиографический катетеризационный стол, который должен иметь подвижную крышку. По возможности, этот стол должен также двигаться вверх и вниз для облегчения исследования и правильного положение пациента.
Рентгеновская трубка и электронно-лучевой преобразователь должны управляться независимо, это способствует увеличению обзора. На этих установках вручную должны быть выставлены положения «С» или «U» для облегчения их использования и получения возможности фильмирования. Возможности фильмирования необходимы, только если в такой операционной производится катетеризация сердца.
Каждый ангиографический кабинет обязательно должен иметь ЭКГ-оборудование и систему мониторинга пульсовой оксигенации, а все пациенты должны подвергаться мониторингу [19]. Мониторы, отражающие внутриартериальное давление, помогают оценить гемодинамически значимые стенозы, результаты ангиопластики, давление в портальной вене. Внутрисосудистое давление определяется также первично при пульмонографии перед введением контрастного вещества. Важны методики для определения времени свертывания. Введение контрастного вещества с определенной скоростью и давлением выполняется с помощью автоматических приборов. Для тестирования положения катетера во время флюороскопии и во время использования цифровой субтракции, однако, выполняют ручное введение контраста. Тест проводится при тщательном мониторировании катетерного введения для предупреждения случайного механического введения контраста в субинтимальный слой или в неинтересуемый сосуд.
Если фильмирование используется вместо цифрового архивирования, лазерный процессор должен находиться в близко расположенной к операционной комнате. Это необходимо для точного проведения исследования, так как последующее изображение связано с предыдущим. Все исследования должны учитывать индивидуальные потребности.
В заключение отметим, что для тщательного высококачественного, безопасного и эффективного исследования бесценна и необходима хорошо подготовленная команда технических специалистов по ангиографии и сестер. Из-за особенностей процедуры его должен выполнять на постоянной основе только персонал, хорошо знакомый с исследованием. Заведенный порядок ротации всего персонала во всем отделение для отделения ангиографии не желателен.
Катетеры и проводники
Усовершенствование катетеров и проводниковой техники — одно из наиболее значимых достижений в ангиографии. Катетер размером 5 Fr имеет существенное преимущество перед 6,5- и 7-Fr катетерами, применяемыми в последнее время. Усовершенствование материала поверхности катетера снижает риск тромботических и эмбологенных осложнений. Постоянно идет поиск нового материала для стенки катетера, что позволит применять катетеры меньшего диаметра, устанавливаемые в зону высокого кровотока; большой объем инъекции, необходимый для аортографии, наряду с вращением и тракцией важны для селективной сосудистой катетеризации. Вращение проводника способствует мобильному продвижению катете-
