
3 курс / Общая хирургия и оперативная хирургия / Сосудистая_хирургия_по_Хаймовичу_Том_1_Ашер_А_,_Покровский_А_В_
.pdf
Глава 17. Эндартерэктомия 245
Рис. 17.8. Образец, удаленный из правой общей бедренной артерии путем открытой эндартерэктомии.
Литература
1.Dos Santos JC. Sur la desobstruction des thromboses arterielles anciennes. Mem Acad Chir 1947; 73: 409.
2.Dos Santos JC. Introduction to a round table on endarterectomy. J Cardiovasc Surg (Special Issue for the 15th International Congress of the European Society of Cardiovascular Surgery), 1966: 223.
3.Jianu I. Thrombectomia arteriala pentru un caz dp gangrene uscata a piciorului. Soc Chir (Bucarest) 1912; 27: 11.
4.Delbet P. Chirurgie arterielle et veineuse. In: Les modernes acquisitions. Paris: Bailliere, 1906: 104.
5.Dos Santos JC. From embolectomy to endarterectomy, or the fall of a myth. J Cardiovasc Surg 1976; 17: 113.
6.Bazy L, Huguier J, et al. Desobliteration d’une thrombose ancienne segmentaire. de 17 cm long, dans une artere femorale superficielle, atteinte d’artente parietale calcifee. Mem Acad Chir 1947; 73: 602.
7.Leriche R, Kunlin J. Essais de desobstruction des arteres thromboses suivant la technique de Jean Cid Dos Santos. Lyon Chirl 947; 42: 475.
8.Wylie EJ, Kerr E, Davis O. Experimental and clinical experiences with the use of fascia lata applied as a graft about major arteries after thromboendarterectomy and aneurysmorrhaphy. Surg Gynecol Obstet 1951; 92: 257.
9.Wylie EJ. Thromboendarterectomy for arteriosclerotic thrombosis of major arteries. Surgery 1952; 23: 275.
10.Cannon J, Barker W. Successful management of obstructive femoral arteriosclerosis by endarterectomy. Surgery 1955; 38: 48.
11.Bazy L, Reboul H. Technique de l’endarteriectomie desobliterante. J Int Chir 1950; 65: 196.
12.Malan E, Botta JC. Normal and pathologic planes of cleavage. J Cardiovasc Surg (Special Issue for the 15th International Congress of the European Society of Cardiovascular Surgery), 1966; 261.
13.Malan E, Longo T Hemodynamic factors in endarterectomy. J Cardiovasc Surg (Special Issue for the 15th International Congress of the European Society of Cardiovascular Surgery), 1966; 265.
14.Sumner DS, Hokanson DE, Strandness DE. Arterial walls before and after endarterectomy: stress-strain characteristics and col- lagen-elastin content. Arch Surg 1969; 99: 606.
15.Dos Santos JC. Late results of reconstructive arterial surgery (restoration, disobliteration, replacement with the establishment of some operative principles). J Cardiovasc Surg 1964; 5: 445.
16.Inahara T. Endarterectomy for segmental occlusive disease of the superficial femoral artery. Arch Surg 1981; 116: 1547.

Глава 18
Баллонная ангиопластика периферических артерий и вен
Хуан Айерди, Морис М. Солис, Ким Дж. Ходгсон
Достижения внутрипросветной технологии привели к экспоненциальному увеличению числа чрескожных эндоваскулярных вмешательств, выполненных за последние два десятилетия. У пациентов, страдающих периферической артериальной и венозной обструкцией, чрескожная транслюминальная ангиопластика (ЧТА) — наиболее часто выполняемая внутрисосудистая операция, нередко дополняемая установкой внутрисосудистых стентов (см. гл. 19). Идеальная ЧТА недорога, легко выполнима, ассоциирована с низкой заболеваемостью и смертностью и имеет разумные краткосрочные и отдаленные показатели рестеноза. В значительной степени достигая этих целей, ЧТА стала стандартной техникой в арсенале сосудистых хирургов.
Нередко стимулом для выполнения ЧТА является возможность замещения осложненной высоким риском хирургической операции минимально инвазивным вмешательством с приемлемыми показателями проходимости и клиническим успехом. Не всегда столь же длительная, что и соответствующая хирургическая реваскуляризация, ЧТА имеет низкий риск и возможность повторного выполнения, что часто делает данный метод вмешательством выбора, особенно у пациентов с тяжелыми сопутствующими заболеваниями. В то время, как операция ЧТА имеет низкий риск, ее неудачи и осложнения не безвредны и могут привести к неблагоприятным клиническим исходам, нередко связанным с областью воздействия на сосуд или областью сосудистого доступа. Системные осложнения, связанные с манипуляциями катетером, контрастным препаратом или физиологическим стрессом, включают инсульт, инфаркт миокарда, почечную недостаточность, потерю конечности или даже смерть. Конверсия в открытую операцию для спасения от ранних послеоперационных осложнений несет в себе все риски экстренного вмешательства у пациентов с высоким риском. По этим причинам важно, чтобы сосудистый хирург имел полное знание и
понимание патофизиологии того заболевания, которое требует лечения, а также показания и потенциальные осложнения терапевтических методов. Для получения хороших результатов ЧТА необходимо обучение и опыт выполнения манипуляций с катетером и проводником.
История
Одним из наиболее важных достижений в эволюции эндоваскулярной хирургии было изобретение Thomas J. Fogarty катетера для эмболэктомии [1]. Charles T. Dotter, вдохновленный работой Fogarty, 16 января 1964 г. выполнил первую ЧТА [2, 3]. У пациентки в возрасте 83 лет с сухой гангреной трех пальцев левой стопы, отказавшейся от ампутации, операция реваскуляризации была невозможна из-за тяжелого состояния больной и плохих путей оттока. Под местной анестезией последовательно по проводнику были проведены тефлоновые катетеры 8 Fr и затем 12 Fr и произведена дилатация проксимального стеноза подколенной артерии. После дилатации пациентка наблюдалась амбулаторно, и ее стопа быстро зажила [4]. Через 10 месяцев Dotter и Judkins сообщили о 11 пациентах с окклюзией подвздошных артерий, которым была выполнена баллонная дилатация введенными последовательно через ипсилатеральную общую бедренную артерию жесткими политетрафторэтиленовыми катетерами [2]. Несмотря на приемлемые результаты, беспокойство из-за атероэмболизации во время проведения катетера привело к значительному скептицизму по отношению к технике. В следующем году Dotter использовал баллоны Фогарти из латекса, обернутые вокруг друг друга для увеличения их толщины, и выполнил первую баллонную ангиопластику подвздошной артерии, как мы ее знаем сегодня. Четырнадцать лет спустя после первой баллонной ангиопластики
Глава 18. Баллонная ангиопластика периферических артерий и вен |
247 |
|
|
артерия оставалась проходимой [4]. Dotter полагал, что транслюминальный подход будет применим в большинстве артериальных систем, заявляя в 1969 г.: «Мы долго ждали, чтобы устранить стеноз почечной артерии чрескожным путем. Когда-нибудь коронарные артерии будут эффективно излечиваться транслюминально — возможно, в амбулаторных условиях...» [5].
О фундаментальном усовершенствовании техники Dotter в 1974 г. сообщили Gruntzing и Hopff. Они заменили материал баллона из латекса на менее эластичный поливинилхлорид, который эффективнее разрушал атеросклеротическую бляшку [6]. С тех пор катетеры для ЧТА подверглись множеству усовершенствований, включая гидрофильное покрытие, уменьшающее трение; появились катетеры и баллоны с низким профилем, более прочные и более стойкие к проколу баллоны, монорельсовые «скоростные» катетеры, баллоны с режущим краем. Эти усовершенствования позволили легче выполнять ЧТА и расширили область ее применения, но патофизиология, показания, техника, результаты и осложнения баллонной ангиопластики остались те же.
Патофизиология
Успех ЧТА изначально приписывался компрессии и перераспределению атеросклеротической бляшки [2]. Однако последующие гистологические исследования показали, что уплотнение бляшки обусловливает меньшую часть эффективности ЧТА [7, 8]. По современным данным, ЧТА вызывает контролируемый разрыв бляшки, ее разделение, диссекцию интимы и натяжение медии и адвентиции с частым сопутствующим разрывом медии [7, 9]. Перерастянутая медиа не возвращается в свое изначальное состояние и сопряжена с фрагментами бляшки [7, 10]. Происходит сосудистое ремоделирование, увеличивающее просвет сосуда в большинстве случаев [11]. Возможность достичь немедленного технического успеха после ЧТА уменьшается в артериях с эксцентричными бляшками или гиперплазированными рестенозами, а также в венах или венозных протезах. Баллонная дилатация эксцентричных бляшек оказывается неэффективной для того, чтобы разорвать бляшку, так как сила радиальной дилатации просто растягивает противоположную от бляшки стенку артерии. Баллонная дилатация неатеросклеротических бляшек, обычно обнаруживающихся в венозных стенозах и рестенозах артерий, не всегда успешна из-за неподатливости неэластического фиброзного слоя. В отдаленных сроках проходимость после ЧТА часто ограничена непрерывной пролиферацией клеток гладкой мускулатуры сосуда, что может привести к миоинтимальной гиперплазии и развитию рестеноза [12].
Показания
В большинстве случаев атеросклеротического поражения сосудов клинические показания для ЧТА сходны с таковыми для хирургических вмешательств, хотя минимально инвазивная природа ЧТА может снизить порог симптомов для лечения соответствующих поражений. ЧТА более успешна и, таким образом, в большей степени показана как альтернатива хирургической реконструкции при коротких поражениях (< 5 см) и в артериях с большим диаметром и высокой скоростью кровотока (например, подвздошные артерии), в противоположность длинным поражениям в артериях малого калибра и низкой скоростью кровотока (например,
берцовые артерии). Кроме того, ЧТА достигает лучшего результата в лечении стенозов, чем окклюзий, одиночных, чем множественных, и неустьевых (> 5 мм от устья), чем устьевых поражений.
Бессимптомные поражения артерий нижних конечностей, как правило, не требуют лечения, только в случае риска тромбоза накладывается шунт. Симптомные поражения аорто-подвздош- ных сегментов в настоящее время являются наиболее распространенным показанием для периферической ЧТА, так как результаты ЧТА подвздошных артерий превосходны и частота осложнений низка [13–15]. Хотя показатель «риск–польза» для ЧТА при лечении бедренно-подколенного сегмента не такой привлекательный, как для подвздошных сегментов, показания расширились и включают: перемежающуюся хромоту, ограничивающую образ жизни; боли покоя или потерю ткани у пациентов со значительными поражениями, расположенными проксимально от приемлемого оттока; значительные факторы риска для операции реконструкции, или как дополнение к хирургической реваскуляризации. Из-за относительно высокого риска рестеноза в бедренных и подколенных артериях, показатель «риск–польза» позволяет выполнять ЧТА только при коротких концентрических стенозах (< 10 см) с хорошим оттоком или у пациентов с высоким риском, у которых отсутствуют аутовены для реконструктивной хирургии [16, 17]. Недавний анализ рентабельности показывает, что ЧТА следует выполнять как первоначальное лечение у пациентов со стенозами бедренно-подколенного сегмента и перемежающейся хромотой. Пациенты с окклюзиями бедренно-подколенного сегмента и/или поражениями берцовых артерий, страдающие от критической ишемии нижних конечностей, лучше лечатся операциями шунтирования, так как результаты сохранения конечностей после ЧТА в этих случаях хуже [18]. Хотя выполнение ЧТА берцовых артерий для сохранения конечности обосновано у пациентов с хорошими артериями притока и фокальными поражениями берцовых артерий, особенно у пациентов с недостатком аутовен для шунтирования или при высоком риске сосудистой реконструкции, такие пациенты — редкость.
Наиболее распространенным показанием для ЧТА почечной артерии является вазоренальная гипертензия и/или почечная дисфункция у пациентов со стенозом почечной артерии (ишемическая нефропатия) [19]. Более спорна рекомендация некоторых авторов выполнять ЧТА при гемодинамически значимых стенозах почечной артерии при отсутствии неконтролируемой гипертензии для предотвращения прогрессирования стеноза и последующей потери функции почки [20]. Для прогнозирования эффекта от операции (и классификации пациентов по признаку, ответят или не ответят на вмешательство) определяется индекс почечного сопротивления с использованием ультразвукового допплера или выполняется сцинтиграфия с каптоприлом [21, 22]. Другими показаниями для ЧТА артерии почки являются фибромышечная дисплазия, артериит Такаясу и посттрансплантационный стеноз. У пациентов с классическими симптомами хронической мезентериальной ишемии и подходящим поражением после ЧТА отмечаются хорошие результаты. Пациенты с менее оптимальными мезентериальными поражениями могут быть пролечены методом ЧТА в том случае, если они признаны неподходящими для операции реваскуляризации. Большинство устьевых почечных и мезентериальных поражений лечатся методом первичной ЧТА, хотя большая часть из них потребует стентирования.
Ангиопластика атеросклеротических поражений сонных артерий в настоящее время проходит обширные исследования, без четких показаний для ее выполнения вне клинических исследований [23–25]. С другой стороны, каротидная ангиопластика в ле-

248 Раздел III. Основные сосудистые и эндоваскулярные техники
чении симптоматической фибро-мышечной дисплазии сонных артерий показала отличные результаты и стала принятым стандартом лечения [26, 27]. ЧТА брахиоцефальных, подключичных и подмышечных артерий может быть рассмотрена для лечения ишемии верхних конечностей при нагрузке, язвенных поражений, подключичного стил-синдрома, коронарного стил-синдрома и может предшествовать коронарному или подмышечно-бедренному шунтированию. Результаты ЧТА подключичной артерии при ишемии верхней конечности или подключичном стил-синдроме сравнимы с таковыми после сонно-подключичного шунтирования [28].
Роль ЧТА в лечении хронических венозных окклюзий значительно возросла после внедрения сосудистых стентов. Результаты ЧТА у пациентов с симптоматическим стенозом или окклюзией верхней полой/брахиоцефальной вены или нижней полой/подвздошной вены хуже, чем результаты, наблюдаемые в артериальной системе [29].
Техника
Подготовка
ЧТА хорошо переносится под местной анестезией 1%-ным раствором лидокаина, а использование внутривенной седации предотвращает боязнь и дискомфорт. С использованием этих подходов выполняются даже большие сосудистые, эндоваскулярные или смешанные операции [30, 31]. Всем пациентам необходимо проводить электрокардиографию и измерение кровяного давления. При необходимости устанавливается мочевой катетер, в зависимости от продолжительности вмешательства.
Все пациенты, которым выполняется ЧТА, нуждаются в проведении антиагрегантной терапии, которую следует продолжать, по крайней мере, в течение 3 месяцев после вмешательства. После выполнения внутриартериального доступа и перед введением проводника и манипуляцией катетером проводится системная гепаринизация в дозировке 50–100 ЕД/кг. Убедительных доказательств применения профилактических доз антибиотиков при эндоваскулярных вмешательствах нет, однако если планируется установка стента, то рекомендуется антибиотико-профилактика цефалоспорином 1-го поколения [32–34].
Доступ
Выполнение сосудистого доступа является фундаментальной частью операции ЧТА. Чрескожный доступ предпочтителен, когда он может быть выполнен безопасно. Технику выделения артерии следует применять, когда сосуд имеет малый диаметр или до этого производилась хирургическая диссекция (менее 4–6 недель) для уменьшения осложнений со стороны области доступа [35].
Предпочтителен тот сосудистый доступ, который находится как можно ближе к зоне поражения, требующей дилатации, но которая предоставляет адекватное рабочее пространство для завершения вмешательства. Это оптимизирует проводимость катетера: плохая проводимость может стать проблемой при проведении катетера через острый угол бифуркации аорты или через извитые подвздошные артерии. Поэтому проксимальные поражения подвздошных артерий лучше всего лечатся из ипсилатерального, ретроградного доступа из общей бедренной артерии, тогда как наиболее дистальные поражения наружной подвздошной артерии, общей бедренной артерии или проксимальной части по-
верхностной бедренной артерии могут лечиться только из контрлатерального доступа или из подмышечного доступа, так как ипсилатеральная пункция не обеспечит адекватное рабочее пространство для баллона, даже без интродьюсера. Поражения дистальнее проксимальной трети поверхностной бедренной артерии (ПБА) лучше достигаются из ипсилатеральной, антеградной пункции общей бедренной артерии. Почечные артерии достигаются или из бедренного, или левого подмышечного доступа, в то время как брыжеечные артерии достигаются подмышечным доступом.
Большую часть катетеров для ангиопластики вмещает 5- или 6-Fr интродьюсер, но если предполагается использовать проводниковый катетер или стент, может потребоваться интродьюсер большего диаметра (7–10 Fr). Для почечных, подключичных или контрлатеральных подвздошных артерий проводниковые катетеры или длинные интродьюсеры-проводники незаменимы для стабилизации проводника/катетера и введения контраста для ангиографического мониторинга вмешательства. Они также требуются для безопасной доставки баллон-расширяемых стентов.
Прохождение проводником
Успешное прохождение требуемого поражения проводником — это следующий и наиболее трудный этап в ЧТА. Проводник с кончиком типа J в меньшей степени способен повредить сосуд, однако широкий профиль непрямого ведущего элемента не позволит провести его через выраженные стенотические поражения. Альтернативой являются прямой или ангулированный с гибким концом проводники, такие как Wholey (Mallinckrodt Inc., St Louis, MO), Terumo Glidewire (Boston Scientific Co., Natick, MA) или Bentson (Cook Inc., Bloomington, IN), которые могут быть с осторожностью использованы под флюороскопическим контролем. Проводник Glidewire имеет гидрофильное покрытие, которое делает его столь скользким, что требует высокого внимания, чтобы не завести этот проводник в плоскость диссекции позади бляшки, так как последующая дилатация в пределах ошибочной плоскости может привести к гемодинамически значимой диссекции и окклюзии сосуда. Время от времени применение проводника с гибким концом вместе с диагностическим катетером, доведенным в пределах 1–2 см от конца проводника, предоставляет проводнику дополнительную поддержку. Изменение позиции катетера по отношению к кончику проводника обеспечивает различную гибкость кончика проводника. Коаксиальное использование ангулированных катетеров добавляет управляемости проводникам с прямым концом, что способствует проведению проводника через извитые сосудистые сегменты или через поражения, расположенные под углом. Это может особенно помочь при дилатации почечных, подключичных или других сосудистых ветвей; специфические формы катетера доступны для всех анатомических конфигураций, с которыми обычно сталкивается хирург. Различные формы катетера позволяют направить проводник в направлении устья сосуда интереса. Как только поражение пройдено, производить последующие замены катетеров нужно с большой осторожностью, чтобы убедиться, что проводник, проведенный через пораженный сегмент, установлен не слишком далеко за поражением, где он может повредить другие сосудистые ветви.
Прохождение артериальных окклюзий ставит дополнительные задачи. Окклюзия с мягким тромботическим ядром способствует легкому прохождению проводника. В этом случае, как правило, применяется ангулированный или с гибким концом проводник Glidewire. Резистентные окклюзии могут потребовать дополнительной поддержки для проводника, что обеспечивает-
Глава 18. Баллонная ангиопластика периферических артерий и вен |
249 |
|
|
ся прямым катетером, позиционированным в пределах 1–2 см от кончика проводника. Это позволяет гибкому кончику проводника прозондировать бляшку и предотвратить его продольное сгибание под воздействием встречной силы. Часто случается, что проводник проходит через окклюзии субинтимально, что неудивительно. Поэтому обязательно условие, чтобы выведение проводника обратно в просвет сосуда было подтверждено — для того, чтобы последующая дилатация восстанавливала непрерывность кровотока, а не увеличивала длину окклюзии. Вращение проводника и обнаружение признаков свободной ротации ангулированного кончика, внимательное изучение направления проводника в нескольких проекциях, проведение тонкого катетера по проводнику в место выхода в просвет сосуда и введение контрастного препарата — вот те приемы, которые могут быть применены для подтверждения выхода в просвет сосуда.
При последующем прохождении окклюзии обоснована попытка тромболитической терапии, так как значительный компонент окклюзии может быть по своей природе тромбом и поддаваться растворению. Это не только уменьшит необходимость дилатировать сосуд по всей длине, но также минимизирует вероятность эмболизации нестабильного тромба во время дилатации. Шансы успешного лизиса тромба значительно возрастают, если возраст тромба меньше 2 недель [36–38], однако даже существенно более старые тромбы могут быть успешно лизированы, хотя это менее предсказуемо [38]. Присущая нестабильность острого тромба заставляет проводить курс тромболизиса до дилатации у пациентов с подозрением на нестабильный тромб, в то время как необходимость в попытке лизиса более хронических окклюзий остается предметом дискуссии.
Ангиопластика
Выбор баллона для ангиопластики требует внимательности, калибровки и измерения ангиографических изображений. После того как баллон подобран, он подготавливается путем постановки на отрицательное давление через шприц, содержащий разбавленный наполовину контраст. Затем канал для раздувания баллона заполняется контрастом, что позволяет визуализировать процесс раздувания баллона и уменьшить риск воздушной эмболии из места разрыва баллона. Баллонным катетерам до их использования тестовое раздувание, как правило, не проводится, так как это увеличит профиль баллона, что, возможно, затруднит его прохождение через пораженный сегмент. Канал для проводника просто промывается солевым раствором.
Правильное позиционирование баллона по отношению к пораженному сегменту достигается путем флюороскопического соотнесения к анатомическим структурам или наружным рентгеноконтрастным меткам, установленным во время получения первых ангиограмм. Необходимо убедиться, что система маркеров не сдвинута и что первоначальные и вновь получаемые изображения идентичны. Флюороскопия в режиме «картирование пути» («Roadmapping»), при котором изображение контрастированного сосуда накладывается на флюороскопию в режиме реального времени, может помочь в точном позиционировании. Введение контраста через адекватно позиционированный и превышающий по размерам проводниковый катетер или интродьюсер может использоваться для определения позиции баллона.
Как правило, баллонный катетер предпочтительно раздувать разведенным контрастом, введенным с помощью устройства для контроля давления с целью убедиться, что безопасные границы давления при раздувании не превышены. Раздувание баллона кон-
тролируется флюороскопически и, как только давление в баллоне увеличивается, сужение (талия) в профиле баллона исчезает с дилатацией бляшки. Оптимальное число и продолжительность раздуваний в настоящее время неизвестны. Экспериментальные данные показывают, что периоды раздувания от 30 до 60 с достаточны, чтобы вызвать желаемую пластическую деформацию клеточных компонентов медии [10, 39]. После флюороскопического подтверждения того, что баллон полностью сдулся, он вытаскивается из проводникового катетера или интродьюсера.
Ощущение боли пациентом во время дилатации — обычное явление и, как правило, устраняется путем сдувания баллона. Возникновение боли во время ЧТА свидетельствует о растяжении нервных волокон адвентиции, и отсутствие боли говорит о недостаточном раздувании. Постоянная боль после дилатации побуждает к переоценке ситуации путем введения контраста, так как боль может свидетельствовать о повреждении артерии и экстравазации. Это укрепляет необходимость прохождения проводником всех поражений, так как лечение любого сосудистого разрыва или выраженной диссекции внутрисосудистым способом требует сохраненного доступа к истинному просвету сосуда.
Атеросклеротические бляшки, развивающиеся в бифуркациях, по существу, являются одиночными бляшками с распространением в оба сосуда и требуют специального подхода. Дилатация только одной сосудистой ветви приведет к разрыву бляшки в другой ветви с возможным возникновением диссекции, стеноза или окклюзии. Бифуркация аорты — частая локализация таких поражений, с вовлечением устьев обеих общих подвздошных артерий. В таких случаях дилатация достигает лучших результатов при технике «целующихся баллонов» («kissing balloon»), при которой обе общие подвздошные артерии дилатируются одновременно с помощью баллонов, «целующихся» в дистальном отделе аорты, доступами из обеих бедренных артерий. Такой подход позволяет поддерживать обе стороны во время дилатации и рекомендован для проксимальных поражений общих подвздошных артерий, даже если только одно из них достаточно выражено. По крайней мере, проведенный через контрлатеральный сосуд проводник сохранит доступ в этом направлении, если диссекция или окклюзия потребует лечения [13]. Подобным образом, когда требуется устранить поражение поблизости от сосудистой ветви, как, например, при стенозе в средней трети почечной артерии, проведение двух проводников (по одному в каждую ветку) будет страховать доступ к обеим ветвям в случае возникновения диссекции или окклюзии после устранения проксимального поражения.
Дилатацию через устье ветви сосуда следует проводить с осторожностью, так как она может привести к окклюзии ветви сосуда. Для некоторых сосудов, таких как а. hypogastricа, серьезных последствий не будет, однако закрытие позвоночной артерии во время дилатации подключичной артерии может иметь более негативные результаты, и поэтому необходимо хорошее клиническое мышление.
Оценка результатов
Анатомически ЧТА считается технически успешной в случае, если после завершения вмешательства резидуальный стеноз составляет меньше 30% и отсутствует диссекция, ограничивающая кровоток, что подтверждается ангиограммами в разных проекциях или внутрисосудистым ультразвуком. Резидуальный стеноз более 30%, необязательно гемодинамически значимый, коррелиру-

250 Раздел III. Основные сосудистые и эндоваскулярные техники
Таблица 18.1. Периоперационные критерии для определения технического успеха чрескожной транслюминальной ангиопластики
Параметры |
Критерии |
|
|
Анатомические |
|
Ангиографический |
|
резидуальный стеноз |
< 30% стеноз |
Внутрисосудистый ультразвук |
< 30% стеноз |
Гемодинамические |
|
Симметричное определение |
|
давления |
< 5 мм рт. ст. градиент |
Давление Pull-through |
< 5 мм рт. ст. градиент |
Фармакологический стресс |
< 20 мм рт. ст. градиент |
|
|
ет с ранним рецидивом. Если дилатация выполнена баллоном соответствующего размера, то определяемый 30%-ный резидуальный стеноз, постоянный градиент давления или выраженная диссекция, как правило, требуют установки стента.
Гемодинамическая оценка является более надежным доказательством успеха ЧТА, чем только ангиографические показатели. Одновременное определение давления проксимально и дистально от поражения является наиболее точным методом определения гемодинамики (рис. 18.1). Однако такое определение требует двух артериальных доступов, в которых нет необходимости, что делает метод невыполнимым стандартом. Более часто применяется техника измерения давления «pull-through» («проводить через»), при которой давление измеряется катетером с отверстием на конце, который проводится через зону интереса. Разница давления покоя через поражение больше 5 мм рт. ст. свидетельствует о неадекватной дилатации. Неудобства применения такой методики включают необходимость извлечения проводника для измерения давления и потенциально неточные измерения в случае, если катетер продвигается против тока крови через сосудистое поражение, что вызывает частичную обтурацию просвета катетером. Фармакологическая вазодилатация, вызываемая прямым введением вазодилататоров в сосудистую систему по ходу кровотока, может быть использована для определения пограничных гемодинамически значимых поражений, которые проявляются падением давления дистальнее стеноза на более чем 20 мм рт. ст. (табл. 18.1).
Осложнения
Осложнения ЧТА могут возникнуть в месте доступа, в месте проведения инструментов, в области ангиопластики, в русле оттока и системно (табл. 18.2).
Пункция артерии — наиболее неконтролируемая часть операции ЧТА, и неудивительно, что гематома в месте доступа наиболее часто возникает как осложнение артериографии и ЧТА. Факторы риска этого осложнения включают гипертензию, использование интродьюсеров большого диаметра и/или тромболитическую терапию. Для доступа из общей бедренной артерии пункция сосуда близко к паховой связке или каудальнее к головке бедренной кости связана с увеличенным риском кровотечения из-за того, что невозможно эффективно провести компрессию после удаления катетера или интродьюсера [35]. Гематомы в типичных случаях развиваются вскоре после удале-
Таблица 18.2. Осложнения чрескожной транслюминальной ангиопластики
Место доступа
Гематома
Кровотечение Разрыв нерва от введения иглы
Ишемия нерва от нейрососудистой гематомы около интродьюсера
Артериовенозная фистула Диссекция интимы Артериальный тромбоз Псевдоаневризма
Связанные с катетером
Неумышленное кровотечение из открытого конца или бокового порта
Воздушная эмболия Случайное смещение спиралей или стентов
Место ЧТА
Диссекция
Тромбоз Неудача при сдувании баллона
Артериовенозная фистула Разрыв артерии
Ускорение атеросклеротического процесса
Место оттока
Эмболия
Спазм
Тромбоз
Системные
Аллергические реакции Перегрузка жидкостью Нефротоксичность Вазовагальный ответ Аритмии
ния катетера или интродьюсера. У пациентов, получающих гепарин, удаление интродьюсера обычно задерживают до тех пор, пока активированное время коагуляции станет меньше 200 c или, альтернативно, антикоагуляционное действие прекращается введением протамина. Иногда гематомы возникают во время вмешательства из-за подтекания крови вокруг интродьюсера, что устраняется его заменой на интродьюсер большего диаметра. Доступы через верхнюю конечность ассоциированы с более высоким риском осложнений из-за меньшего диаметра плечевой или подмышечной артерий и близким расположением плечевого сплетения. Гематомы из подмышечной артерии, вызывающие неврологическую симптоматику, должны быть диагностированы как можно раньше и дренированы хирургическим путем, чтобы предотвратить постоянный неврологический дефицит. Выполнение высокой пункции плечевой артерии латеральнее большой грудной мышцы, где нервы в меньшей степени прилежат к плечевой артерии и где компрессия артерии наиболее эффективна, может смягчить большую часть из этих осложнений [40].
Другие осложнения из места доступа включают артериовенозные фистулы, псевдоаневризмы, диссекции и тромбоз. Эффективными лечебными манипуляциями для лечения большей части

Глава 18. Баллонная ангиопластика периферических артерий и вен |
251 |
|
|
А
Б
I |
1 mV |
|
|
Gain: 100 |
1 mV |
II |
1 mV |
|
|
Gain: 100 |
1 mV |
200 |
|
s
s |
s |
s |
s
s
ss
s
100
|
d |
d |
d |
dd |
d |
||
|
d |
d |
Г
0
25 mm/s >
[ -1- ] |
1.50 mmHg/mm |
1 |
2 |
3 |
4 |
5 |
В
Рис. 18.1. (A) Первоначальная контрастная аортограмма, полученная через правую бедренную артерию, демонстрирует стеноз левой общей подвздошной артерии с неясными гемодинамическими показателями у пациента с симптомами перемежающейся хромоты нижних конечностей. (Б) Катетеризация левой подвздошной артерии через второй доступ в левой ипсилатеральной бедренной артерии. Градуированный проводник проведен через пораженный сегмент для точного измерения сосуда с целью подбора размера баллонного катетера. (В) Формы волны артериального давления из правого и левого интродьюсера показывают систолический градиент в 30 мм рт. ст. (Г) Аортограмма после ЧТА демонстрирует отличный анатомический результат с отсутствием резидуального стеноза.
252 Раздел III. Основные сосудистые и эндоваскулярные техники
псевдоаневризм являются компрессия под ультразвуковым контролем или введение тромбина [41]. У пациентов с большими артериовенозными фистулами и псевдоаневризмами или у тех пациентов, которые требуют продолжительной антикоагулянтной терапии, более эффективно будет выполнить эмболизацию, имплантацию покрытых стентов и, редко, хирургическое вмешательство [41, 42]. Диссекция из-за пункции до введения интродьюсе-
А
Б
Рис. 18.2. (A) Выраженная диссекция после ЧТА левой общей подвздошной артерии. (Б) Успешное лечение диссекции подвздошной артерии путем установки стента.
А
Б
В
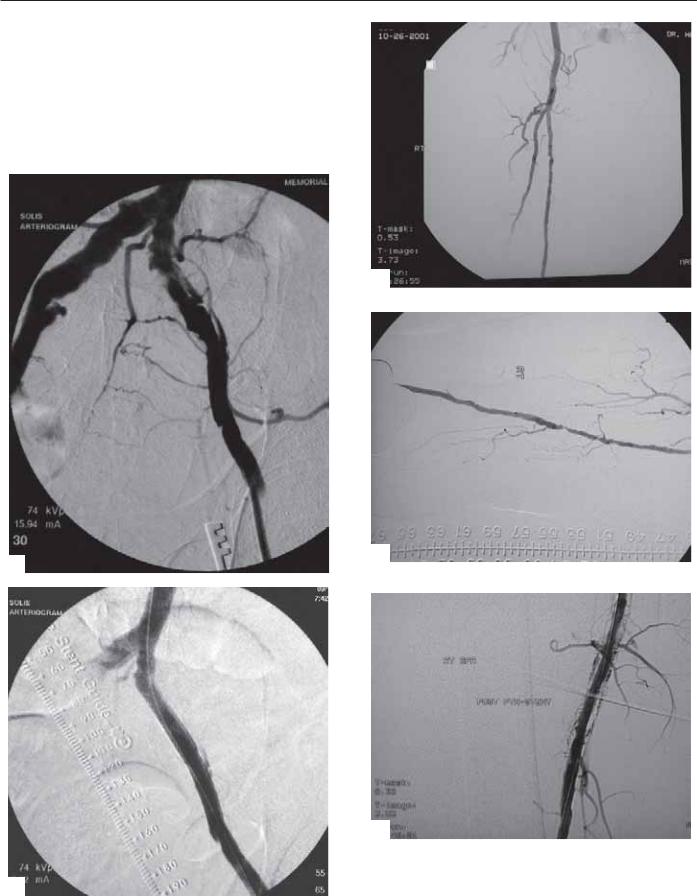
Рис. 18.3. (A) Ангиограмма показывает выраженный фокальный стеноз правой поверхностной бедренной артерии у пациента с перемежающейся хромотой. (Б) Ангиограмма после ЧТА показывает АВ-фистулу с ранним обызвествлением поверхностной бедренной вены. (В) Успешное лечение АВ-фистулы поверхностной бедренной артерии после ЧТА путем установки стента.
Глава 18. Баллонная ангиопластика периферических артерий и вен |
253 |
|
|
ра обычно эффективно лечится простым извлечением иглы или проводника. Если интродьюсер уже поставлен через диссекцию, то после удаления интродьюсера может потребоваться вмешательство для устранения диссекции.
Основные осложнения, связанные с баллонной ангиопластикой, включают эмболию, диссекцию, спазм и перфорацию. Эмболия наиболее часто возникает из-за манипуляции с проводником/катетером, а также дилатации баллоном бляшки неправильной формы или изъязвленной бляшки или свежего тромба. Для лечения клинически значимой эмболии применяется катетерный тромболизис или хирургическая тромбэктомия. В случаях поражений с высоким риском эмболизации необходимо подумать о прямом стентировании без предилатации. В этом случае стент помогает удержать остатки атеросклеротической бляшки и тем самым уменьшить риск эмболии.
Диссекция после ангиопластики может возникнуть из-за манипуляции с проводником и катетером в области бляшки или области бифуркации, а также из-за дилатации баллонным катетером и может иметь минимальные клинические проявления или может развиться окклюзия артерии. Локальная диссекция интимы после ЧТА — нормальное явление и не считается осложнением операции [10]. С другой стороны, обнаруживаемые при ангиографии или гемодинамически значимые диссекции должны быть устранены установкой стента (рис. 18.2).
Спазм — состояние, часто возникающее после ЧТА в определенных анатомических областях, в таких как почечные и берцовые артерии. Это состояние необходимо дифференцировать с острым тромбозом и устранять введением вазодилататоров или тромболитических агентов.
Разрыв артерии после ЧТА — редкое явление, обусловленное перерастяжением артерии с выраженным кальцинозом или склеротически измененной вены. Артериальный разрыв приводит к кровотечению, гематоме, окклюзии артерии или образованием ар- терио-венозной фистулы (рис. 18.3) [43–50]. Методы лечения включают наблюдение, установку стента или стента-графта или экстренное хирургическое вмешательство, в зависимости от клинической ситуации.
Наблюдение и рекомендации по ведению
Тщательное наблюдение после ЧТА также важно для получения хороших отдаленных результатов, как и после открытой хирургической реконструктивной операции [51, 52]. Лечение рестеноза с помощью повторной эндоваскулярной операции будет более успешно, а результат более длительный, чем попытка восстановить проходимость окклюзированного сегмента, который окклюзировался из-за неадекватного ведения. Для контроля за ходом эндоваскулярного вмешательства используются различные методики, включая клинические, гемодинамические и анатомические. Дуплексное сканирование наиболее часто применяется для оценки состояния после ангиопластики. Поскольку в настоящее время нет четко определенных критериев для диагностики стеноза, в 30% случаев с помощью этого метода клинически значимый рестеноз обычно определяется при дуплексном сканировании, когда стеноз > 50% в зоне вмешательства. Интервалы оценки для всех участков ЧТА несколько произвольны. В основном мы рекомендуем проводить клиническое обследование и дуплексное сканирование во время выписки, через 1, 3 и 6 месяцев с последую-
щим наблюдением каждые 6 месяцев. При подозрении на рестеноз поражения следует подтверждать ангиографически и незамедлительно принимать меры.
Заключение
Технологии, связанные с ЧТА, продолжают быстро развиваться, что обусловлено высокой потребностью пациентов и врачей в более эффективных минимально инвазивных методах лечения сосудистых заболеваний. Дальнейшее развитие новых технологий и вспомогательных методов, таких как субинтимальная ангиопластика, микроволновая термо-баллонная ангиопластика, ангиопластика баллоном с режущим краем, удаленная эндартерэктомия, лекарство-выделяющие или радиоизлучающие стенты, внутрисосудистый стент-графт в комбинации с новыми фармакологическими агентами, дают уверенность в том, что ЧТА будет играть все более возрастающую роль в лечении артериальных поражений.
Литература
1.Fogarty T, Cranley J, et al. A method for extraction of arterial emboli and thrombi. Surg Gynecol Obstetrics 1963; 116: 241–244.
2.Dotter CT, Judkins M. Transluminal treatment of arteriosclerotic obstruction: description of a new technique and preliminary report of its application. Circulation 1964; (30): 654–670.
3.Dotter CT, Judkins MP. Transluminal treatment of arteriosclerotic obstruction: description of a new technique and preliminary report of its application. 1964. Radiology 1989; 172(3 Pt 2): 904–920.
4.Dotter CT. Transluminal angioplasty: a long view. Radiology 1980; 135(3): 561–564.
5.Dotter CT, Judkins MP, Rosch J. Transluminal angioplasty in arteriosclerotic obstruction of the lower extremities. Med Times 1969; 97(7): 95–108.
6.Gruntzig A, Hopff H. [Percutaneous recanalization after chronic arterial occlusion with a new dilator-catheter (modification of the Dotter technique) (author’s transl)]. Dtsch Med Wochenschr 1974; 99(49): 2502–2511.
7.Castaneda-Zuniga WR, Formanek A, et al. The mechanism of balloon angioplasty. Radiology 1980; 135(3): 565–571.
8.Castaneda-Zuniga WR, Sibley R, Amplatz K. The pathologic basis of angioplasty. Angiology 1984; 35(4): 195–205.
9.Zarins CK, Lu CT, et al. Arterial disruption and remodeling following balloon dilation. Surgery 1982; 92(6): 1086–1095.
10.Castaneda-Zuniga WR, Tadawarthy SM, et al. «Pseudo» intramural injection following percutanious transluminal angioplasty. Cardiovasc Intervent Radiol 1984; 7(2): 104–108.
11.Guzman LA, Mick MJ, et al. Role of intimal hyperplasia and arterial remodeling after balloon angioplasty: an experimental study in the atherosclerotic rabbit model. Arterioscler Thromb Vasc Biol 1996; 16(3): 479–487.
12.Fanelli C, Aronoff R. Restenosis following coronary angioplasty. Am Heart J 1990; 119(2 Pt 1): 357–368.
13.Hood DB, Hodgson KJ. Percutaneous transluminal angioplasty and stenting for iliac artery occlusive disease. Surg Clin North Am 1999; 79(3): 575–596.
14.Bosch JL, Hunink MG. Meta-analysis of the results of percutaneous transluminal angioplasty and stent placement for aortoiliac occlusive disease. Radiology 1997; 204(1): 87–96.

254 Раздел III. Основные сосудистые и эндоваскулярные техники
15.Zdanowski Z, Albrechtsson U, et al. Percutaneous transluminal angioplasty with or without stenting for femoropopliteal occlusions? A randomized controlled study. Int Angiol 1999; 18(4): 251–255.
16.Johnston KW. Aortoiliac disease treatment. A surgical comment. Circulation 1991; 83(2 Suppl): I61–I62.
17.Johnston KW. Factors that influence the ouycome of aortoiliac and femoropopliteal percutaneous transluminal angioplasty. Surg Clio North Am 1992; 72(4): 843–850.
18.Hunink MG, Wong JB, et al. Revascularization for femoropopliteal disease. A decision and costeffectiveness analysis. JAMA 1995; 274(2): 165–171.
19.Leertouwer TC, Gussenhoven EJ, et al. Stent placnnem for renal arterial stenosis: where do we sund? A metaanalysis. Radiology 2000; 216(1): 78–85.
20.Hood DB, Hodgson KF. Renovascular Disease. In Ahn WSMaSS, ed. Endovascular Surgery. Philadelphi, PA: W.B. Saunders, 2001. pp. 233–241.
21.Radermacher J, Weinkove R, Haller H. Tehniques for predicting a favourable response to renal angioplasty in patients with renovascular disease. Curr Opin Nephrol Hypertens 2001; 10(6): 799–805.
22.Radermacher J, Chavan A, et al. Use of Doppler ultrasonography to predict the outcome of therapy for renalartery stenosis. N Engl J Med 2001; 344(6): 410–417.
23.Clagett GP, Barnett HJ, Easton JD. The carotid artery stenting versus endarterectomy trial (CASET). Cardiovasc Surg 1997; 5(5): 454–456.
24.Hobson RW, 2nd. Carotid angioplasty-stent: clinical experience and role for clinical trials. J Vase Surg 2001; 33(2 Suppl): S117–123.
25.Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001; 357(9270): 1729–1737.
26.Ballard JL, Guinn JE, et al. Open operative balloon angioplasty of the internal carotid artery: a technique in evolution. Ann Vase Surg 1995; 9(4): 390–393.
27.Wilms GE, Smits J, et al. Percutaneous transluminal angioplasty in fibromuscular dysplasia of the internal carotid artery: one year clinical and morphological follow-up. Cardiovasc Intervent Radiol 1985; 8(1): 20–23.
28.Motarjeme A, Gordon GI. Percutaneous transluminal angioplasty of the brachiocephalic vessels: guidelines for therapy. lot Angiol 1993; 12(3): 260–269.
29.Sanders RJ, Haug C. Subclavian vein obstruction and thoracic outlet syndrome: a review of etiology and management. Ann Vase Surg 1990; 4(4): 397–410.
30.Barkmeier LD, Hood DB, et al. Local anesthesia for infrainguinal arterial reconstruction. Am J Surg 1997; 174(2): 202–204.
31.Henretta JP, Hodgson KJ, et al. Feasibility of endovascular repair of abdominal aortic aneurysms with local anesthesia with intravenous sedation [see comments]. J Vasc Surg 1999; 29(5): 793–798.
32.Paget DS, Bukhari RH, et al. Infectibility of endovascular stents following antibiotic prophylaxis or after arterial wall incorporation. Am J Surg 1999; 178(3 ): 219–224.
33.Deitch JS, Hansen KJ, et al. Infected renal artery pseudoaneurysm and mycotic aortic aneurysm after percutaneous trans luminal renal artery angioplasty and stent placement in a patient with a solitary kidney. J Vase Surg 1998; 28(2): 340–344.
34.Dravid VS, Gupta A, et al. Investigation of antibiotic prophylaxis usage for vascular and nonvascular interventional procedures. J Vase Interv Radiol 1998; 9(3): 401–406.
35.Hodgson KJ, Mattos MA, Sumner DS. Access to the vascular system for endovascular procedures: techniques and indications for percutaneous and open arteriotomy approaches. Semin Vase Surg 1997; 10(4): 206–221.
36.Ouriel K. Thrombolysis or operation for peripheral arterial occlusion. Vasc Med 1996; 1(2): 159–161.
37.Ouriel K, Veith FJ, Sa sahara AA. A comparison of recombinant urokinase with vascular surgery as initial treatment for acute arterial occlusion of the legs. Thrombolysis or Peripheral Arterial Surgery (TOPAS) Investigators. N Engl J Med 1998; 338(16): 1105–1111.
38.Wholey MH, Maynar MA, et al. Comparison of thrombolytic therapy of lower-extremity acute, subacute, and chrome arterial occlusions. Cathet Cardiovasc Diagn 1998; 44(2): 159–169.
39.Consigny PM, Le Veen RF. Effects of angioplasty balloon inflation time on arterial contractions and mechanics. Invest Radiol 1988; 23(4): 271–276.
40.Lipchik EO, Sugimoto H. Percutaneous brachial artery catheterization. Radiology 1986; 160(3 ): 842–843.
41.Hood DB, Mattos MA, et al. Determinants of success of colorflow duplex-guided compression repair of femoral pseudoaneurysms. Surgery 1996; 120(4): 585–588; discussion 588–590.
42.Waigand J, Uhlich F, et al. Percutaneous treatment of pseudo aneurysms and arteriovenous fistulas after invasive vascular procedures. Catheter Cardiovasc Interv 1999; 47(2): 157–164.
43.Korogi Y, Takahashi M, et al. Percutaneous transluminal angioplasty: pain during balloon inflation. Br J Radiol 1992; 65(770): 140–142.
44.Kelly AJ. Case report: iliac artery rupture-percutaneous treatment by stent insertion. Clin Radiol 1995; 50(12): 876–877.
45.Alfonso F, Goicolea J, et al. Arterial perforation during optimization of coronary stents using high-pressure balloon inflations. Am J Cardiol 1996; 78(10): 1169–1172.
46.Formichi M, Raybaud G, Benichou H, Ciosi G. Rupture of the external iliac artery during balloon angioplasty: endovascular treatment using a covered stent. J Endovasc Surg 1998; 5(1): 37–41.
47.Cooper SG, Sofocleous CT. Percutaneous management of angio- plasty-related iliac artery rupture with preservation of luminal patency by prolonged balloon tamponade. J Vasc Interv Radiol 1998; 9(1 Pt 1): 81–83.
48.Matsi PJ, Manninen HI. Complications of lowerlimb percutaneous trans luminal angioplasty: a prospective analysis of 410 procedures on 295 consecutive patients. Cardiovasc Intervent Radiol 1998; 21(5): 361–366.
49.Scheinert D, Ludwig J, et al. Treatment of catheterinduced iliac artery injuries with self-expanding endografts. J Endovasc Ther 2000; 7(3 ): 213–220.
50.Redman A, Cope L, Uberoi R. Iliac artery injury following placement of the memotherm arterial stent. Cardiovasc Intervent Radiol 2001; 24(2): 113–116.
51.Sampson L, Ayerdi J, Gupta S. Intraprocedural monitoring. In White R, Fogarty T, eds. Peripheral endovascular interventions. New York, NY: Springer, 1998. pp. 93–102.
52.Henretta JP, Hodgson KJ. Postintervention survillance of endovascular procedures. In White R, Fogarty T, eds. Peripheral endovascular interventions. New York, NY: Springer, 1998. pp. 103–118.
