
2 курс / Нормальная физиология / Общий_курс_физиологии_человека_и_животных_Том_2_Ноздрачев_А_Д_,
.pdf
Рис. 9.5. Строение легких человека. А — воздухоносные пути и легкие; Б — легочные альвеолы и их кровоснабжение; В — долька легкого: 1 — легкое, 2 — гортань, 3 — трахея, 4 — бронхи, 5 — мелкие бронхи, 6 — капиллярная сеть, 7 — альвеолы
9.2.1. Дыхательные мышцы
Мышцы, осуществляющие дыхательный акт, подразделяют на инспираторные и экспираторные, способствующие соответственно увеличению и уменьшению объема грудной полости, а также вспомогательные, которые включаются при формированном дыхании.
Основной инспираторной мышцей служит диафрагмальная. Установлено, что при спокойном дыхании именно диафрагма практически обеспечивает весь объем легочной вентиляции. Во время вдоха сокращение мышечных волокон диафрагмы ведет к уплощению обеих ее полусфер (куполов). Содержимое брюшной полости оттесняется, и грудная полость увеличивается в продольном направлении, а ее основание расширяется за счет поднятия каудальных ребер.
Диафрагма работает синергично с другим инспиратором — наружными межреберными мышцами (рис.9.6). В этом плане диафрагму рассматривают как систему двух мышц: реберной и поясничной частей, соединенных сухожильным центром. Первая функционально связана с межреберными мышцами параллельно, вторая — последовательно. Имея строение мышечных волокон, некоторыми чертами напоминающее миокард, и моносинаптическую связь с инспираторными нейронами дорсальной дыхательной группы продолговатого мозга, диафрагма как дыхательная мышца отличается особой автономностью и не участвует в других функциях (за исклю-

чением экспульсивных актов).
Рис. 9.6. Принципы работы мышц-инспираторов: А — диафрагма (I) и ее модель (II: 1 — ножка диафрагмы, 2 — реберная часть диафрагмы, 3 — межреберные и вспомогательные мышцы, 4 — грудная клетка, 5 — легкое, 6 — живот; Б — движения ребер, позволяющие наружным межреберным мышцам увеличивать при вдохе переднезадний (верхние ребра) и поперечный (нижние ребра) диаметр грудной клетки: I — I ребро, II — IV ребро; пунктиром показаны оси шеек ребер; стрелками — перемещение ребер при вдохе
Роль межреберных мышц неоднозначна. Сокращения наружных межреберных и межхрящевых внутренних межреберных мышц (краниальных межреберий), имея тенденцию к подниманию ребер и увеличению диаметра грудной клетки, помогают тем самым диафрагме выполнять ее инспираторную функцию (рис. 9.6). Напротив, задние (межкостные) участки внутренних межреберных мышц при своем сокращении вызывают опускание ребер и способствуют выдоху. К экспираторным относятся и мышцы брюшной стенки: их функция состоит в повышении внутрибрюшного давления, благодаря чему купол диафрагмы впячивается в грудную полость и уменьшает ее объем.
К вспомогательным респираторным мышцам относят ряд мышц шеи, груди и спины, сокращение которых вызывает перемещение ребер, облегчая действие инспираторов либо экспираторов.
9.2.2.Дыхательный акт
Смомента рождения каждого млекопитающего легкие всегда находятся в более или менее растянутом состоянии. Это объясняется отрицательным давлением в плевральной щели, окружающей легкие. Оно противостоит эластической тяге легких — упругим силам, которые вызываются эластическими свойствами легочной ткани в сочетании с тонусом бронхиальных мышц и направлены на спадение легкого. В спавшемся состоянии легкие находятся у плода до рождения и первого вдоха, в спавшееся состояние они немедленно возвращаются, если в плевральную щель войдет воздух, — наступает так на-
зываемый пневмоторакс.
Во время вдоха, вызванного сокращением мышц-инспираторов, вследствие увеличения объема грудной полости отрицательное давление в плевральной щели возрастает. Поэтому, а также благодаря адгезивным силам, возникающим между прилегающими друг
кдругу париетальным и висцеральным листками плевры, легкие растягиваются еще больше. Увеличение легочного объема, в свою очередь, ведет к падению внутрилегочного (внутриальвеолярного) давления, что и служит причиной поступления в них через дыхательные пути атмосферного воздуха.
Как только инспираторная мускулатура расслабляется, возросшая в ходе вдоха
эластическая тяга легких возвращает их в исходное состояние. При этом из-за уменьшения объема легких давление в них становится положительным, воздух из альвеол устремляется через воздухоносные пути наружу.
Таким образом, выдох в отличие от вдоха происходит пассивно, за счет высвобождения потенциальной энергии растянутых во время инспираторной фазы легких.
Лишь при форсированном дыхании включаются мышцы-экспираторы, активно способствующие дополнительному уменьшению объема грудной полости, причем давление в плевральной щели может становиться положительным.
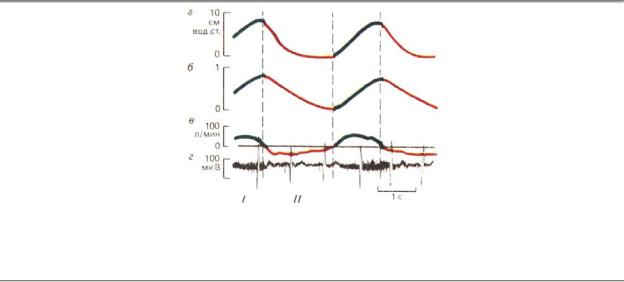
Итак, дыхательный цикл (рис. 9.7) включает две фазы: вдох (инспирацию) и выдох (экспирацию). Обычно вдох несколько короче выдоха: у человека их соотноение равно в среднем 1:1,3. Соотношение компонентов дыхательного цикла (длительность фаз, глубина дыхания, динамика давления и потоков в воздухоносных путях) характеризует так называемый паттерн дыхания.
Рис. 9.7. Фазы дыхательного цикла: I — вдох, II — выдох; а — трансдиафрагмальное давление (разность между давлениями в грудной и брюшной полости), б — объем вдохнутого и выдохнутого воздуха (спирограмма), в — скорости инспираторного и экспираторного потоков, г — электрическая активность диафрагмы (электромиограмма)
В процессе своей работы дыхательные мышцы преодолевают определенное сопротивление. Примерно около 2/3 его приходится на эластическое сопротивление тканей легких и грудной стенки. В свою очередь, около 2/3 эластического сопротивления легких создается за счет поверхностно-активных веществ — сурфактантов, тонким слоем выстилающих изнутри альвеолы. Сурфактанты в основном состоят из липопротеинов. Они стабилизируют сферическую форму альвеол, препятствуя их перерастяжению на вдохе и спадению на выдохе. Остальная часть усилий, развиваемых дыхательными мышцами, тратится главным образом на преодоление неэластического сопротивления газовому потоку в воздухоносных путях.
Неэластическое сопротивление дыханию зависит от просвета воздухоносных путей — особенно голосовой щели, бронхов. Приводящие и отводящие мышцы голосовых складок, регулирующие ширину голосовой щели, управляются через посредство нижнего гортанного нерва группой нейронов, которые сосредоточены в области вентральной дыхательной группы продолговатого мозга (см. разд. 9.4.1). Такое соседство не случайно: во время вдоха голосовая щель несколько расширяется, на выдохе — сужается, увеличивая сопротивление потоку воздуха, что служит одной из причин большей длительности экспираторной фазы. Подобным же образом циклически меняются просвет бронхов и их проходимость.
Тонус гладкой мускулатуры бронхов зависит от активности ее парасимпатической иолинэргической) иннервации: соответствующие эфферентные волокна проходят в составе блуждающего нерва.
Расслабляющее влияние на бронхиальный тонус оказывают симпатическая (адренэргическая) иннервация, а также недавно открытая «неадренэргическая тормозная»

система. Влияние последней опосредуется некоторыми нейропептидами, а также микроганглиями, обнаруженными в мышечной стенке воздухоносных путей; определенный баланс между этими влияниями способствует установлению оптимального для данной скорости воздушных потоков просвета трахеобронхиального дерева.
Нарушение регуляции бронхиального тонуса у человека составляет основу бронхоспазма, в результате которого резко уменьшается проходимость воздухоносных путей (обструкция) и повышается сопротивление дыханию. Холинэргическая система блуждающего нерва участвует также в регуляции секреции слизи и движений ресничек мерцательного эпителия носовых ходов, трахей и бронхов, стимулируя тем самым мукоцилиарный транспорт — выделение попавших в воздухоносные пути инородных частиц. Избыток слизи, характерный для бронхитов, также создает обструкцию и увеличивает сопротивление дыханию.
Сопротивление дыханию при прочих равных условиях зависит от его паттерна. Чем глубже вдох, т.е. чем больше растягиваются легкие, тем больше эластический компонент этого сопротивления. Неэластический его компонент, наоборот, возрастает с увеличением скорости вдоха и выдоха, т. е. с учащением дыхательных циклов. Отсюда следует, что работа дыхательных мышц увеличивается как при слишком глубоком, так и при чрезмерно частом дыхании.
Благодаря рефлекторным механизмам саморегуляции организм, как правило, избирает оптимальный паттерн дыхания — такой, при котором затраты энергии на каждый литр вентилируемого воздуха наименьшие. Поэтому работа, выполняемая респираторными мышцами в покое, относительно невелика и составляет у человека всего 2—3 % от общих энерготрат. Однако при форсированном дыхании (например, при физической нагрузке) она резко возрастает за счет увеличения эластического сопротивления избыточно растягиваемых легких и возникновения турбулентных потоков в воздухоносных путях, достигая 10 % и более от суммарного расхода энергии.
Объем воздуха, вдыхаемого за каждый дыхательный цикл, — глубина дыхания, или дыхательный объем, — составляет при спокойном дыхании относительно небольшую, часть общей емкости легких. При увеличении легочной вентиляции этот объем возрастает за счет дополнительного воздуха (резервного объема), поступающего в легкие при вдохе и изгоняемого при выдохе. Если зафиксировать разницу между максимально глубоким вдохом и максимальным выдохом, получается величина жизненной емкости легких, в которую не входит так называемый остаточный объем, удаляемый только при полном спадении легких.
Однако при спокойном дыхании легкие не опорожняются и до остаточного объема. Ту часть общей емкости легких, которая остается заполненной после обычного выдоха, т. е. при полном расслаблении дыхательных мышц, называют функциональной остаточной емкостью. В нее входит остаточный объем плюс резервный объем выдоха. Соотношение легочных объемов у человека представлено на рис. 9.8.
Рис. 9.8. Легочные объемы и емкости: I — общая емкость легких, II — жизненная емкость легких, III — резервный объем вдоха, IV — дыхательный объем, V — резервный объем выдоха, VI — остаточный объем, VII — емкость вдоха, VIII — функциональная остаточная емкость; 1 — максимальный выдох, 2 — максимальный вдох, 3 — уровень спокойного выдоха; объяснение см. в тексте

9.2.3. Вентиляция легких и внутрилегочный объем газов
Легочной вентиляцией называют объем воздуха, вдыхаемого за единицу времени (обычно используют минутный объем дыхания).
Таким образом, вентиляция — это произведение дыхательного объема на частоту дыхательных циклов. Однако в легочном газообмене участвует не весь вентилируемый воздух, а лишь та его часть, которая достигает альвеол.
Дело в том, что примерно 1/3 дыхательного объема покоя приходится на вентиляцию так называемого мертвого пространства, заполненного воздухом, который непосредственно не участвует в газообмене и лишь перемещается в просвете воздухоносных путей при вдохе и выдохе. Следовательно, вентиляция альвеолярных пространств — альвеолярная вентиляция — представляет собой легочную вентиляцию за вычетом вентиляции мертвого пространства. Именно альвеолярная вентиляция обеспечивает обмен газов в легких.
В воздухоносных путях происходит конвективный и диффузионный перенос газов. В
ходе ветвления воздухоносных путей (рис. 9.9) их суммарное сечение значительно возрастает. Так, у человека от трахеи до альвеол насчитывают 23 таких ветвления (поколения), в ходе которых общая площадь поперечного сечения увеличивается в 4500 раз. Поэтому линейная скорость потока вдыхаемого воздуха по мере приближения к альвеолам постепенно падает.
Рис. 9.9. Ветвление трахеобронхиального дерева (А) и соотношение конвективного (е) и диффузионного (ж) обмена газов в воздухоносных путях (Б): I — кондуктивная зона, II — транзиторная зона, III —
респираторная зона; а — трахея, б — бронхи, в — бронхиолы, г — альвеолярные ходы и мешки, д — альвеолы; цифрами (0—23) обозначены номера генераций
В трахее, бронхах и бронхиолах перенос газов происходит исключительно путем конвекции. В респираторных бронхиолах и альвеолярных ходах, где воздух движется очень медленно, к этому процессу присоединяется диффузионный обмен, обусловленный градиентом парциальных давлений дыхательных газов: молекулы О2 перемещаются в направлении альвеол, где РО2 ниже, чем во вдыхаемом воздухе, а молекулы СО2 — в
обратном направлении. Чем медленнее и глубже дыхание, тем интенсивнее идет внутрилегочная диффузия О2 и СО2.

Происходящий в воздухоносных путях перенос газов направлен на поддержание постоянства парциального давления О2 и СО2 в легочных альвеолах, где идет непрерывный обмен газов с кровью протекающей через легочные капилляры.
Газовая смесь, заполняющая альвеолы, так называемый альвеолярный газ, служит для млекопитающих своего рода внутренней атмосферой. Постоянство состава альвеолярного газа (табл. 9.1) обеспечивается регуляцией дыхания (точнее, альвеолярной вентиляцией) и является необходимым условием нормального протекания газообмена. Воздух, заполняющий мертвое пространство, играет роль буфера, который сглаживает колебания состава альвеолярного газа в ходе дыхательного цикла. Кроме того, мертвое пространство участвует в кондиционирующей функции воздухоносных путей — увлажнении и обогреве вдыхаемого воздуха за счет интенсивного кровоснабжения и секреции слизистой оболочки носовых ходов, носоглотки, гортани, трахеи и бронхов.
Таблица 9.1. Газовый состав дыхательной среды и крови у человека (средние величины в покое)
Среда |
Кислород |
Углекислый газ |
||
|
парциальное |
содержание, |
парциальное |
содержание, |
|
давление, мм |
об. % |
давление, мм |
об. % |
|
рт. ст. |
|
рт. ст. |
|
Вдыхаемый воздух |
159 |
20,9 |
0,2 |
0,03 |
Выдыхаемый воздух |
126 |
16,6 |
28 |
3,7 |
Альвеолярный газ |
103 |
14,5 |
40 |
55 |
Артериальная кровь |
95 |
20 |
40 |
50 |
Венозная кровь |
40 |
15 |
46 |
54 |
(смешанная) |
|
|
|
|
Артериовенозная |
—55 |
—5 |
+6 |
+4 |
разница |
|
|
|
|
Примечание. Альвеолярный газ считают полностью насыщенным водяным паром, парциальное давление которого здесь всегда равно 47 мм рт. ст.
Выдыхаемый воздух представляет собой смесь альвеолярного газа и воздуха мертвого пространства, поэтому средний его состав занимает промежуточное положение между составом вдыхаемого (атмосферного) воздуха и альвеолярного газа (табл. 9.1). В «чистом» виде альвеолярный газ выводится лишь с последней порцией выдоха.
При повышении в организме энерготрат (например, при мышечной деятельности) увеличиваются потребление О2 и продукция СО2; регуляторные механизмы повышают альвеолярную вентиляцию путем сооответствующего увеличения глубины и (или) частоты дыхания – развивается гиперпноэ, при котором состав альвеолярного газа остается нормальным. Если же рост вентиляции превышает потребность организма в газообмене (гипервентиляция), вымывание СО2 из альвеол возмещается поступлением его из тканей, альвеолярное РСО2 падает (гипокапния). Напротив, при недостаточной вентиляции альвеол
(гиповентиляции) в них накапливается избыток СО2 (гиперкапния), а при резком
отставании вентиляции от |
газообмена, кроме того, снижается РО2 (гипоксия). |
|
Соответствующие сдвиги РСО |
и РО |
развиваются при этом и в артериальной крови. |
2 |
|
2 |
9.2.4. Соотношение вентиляции и перфузии легких
Для нормального процесса обмена газов в легочных альвеолах необходимо, чтобы их вентиляция воздухом находилась в определенном соотношении с перфузией их капилляров кровью. Иными словами, минутному объему дыхания должен соответствовать минутный объем крови, протекающей через сосуды малого круга, а этот объем, естественно, равен объему крови, протекающей через большой круг. В обычных условиях вентиляционно-перфузионный коэффициент у человека составляет 0,8—0,9. Например, при альвеолярной вентиляции, равной 6 л/мин, минутный объем крови может составить около 7 л/мин.
В отдельных областях легких соотношение между вентиляцией и перфузией может быть неравномерным. Резкие изменения этих отношений могут вести к недостаточной артериализации крови, проходящей через капилляры альвеол.
Легочные сосуды относят к «емкостной системе». Их просвет в значительной степени зависит от внутригрудного и внутриаль-веолярного давления. В малом круге давление крови низкое, что в нормальных условиях предотвращает выпотевание плазмы через альвеолокапиллярную мембрану и образование отека легких. Ширина сосудистого русла регулируется симпатической иннервацией. Имеются и местные механизмы, сопрягающие перфузию альвеол с их вентиляцией. Так, в тех альвеолах, которые не вентилируются или вентилируются воздухом с пониженным содержанием кислорода, капилляры спазмируются, предотвращая бесполезную перфузию.
Легочный кровоток в целом зависит от величины сердечного выброса, поэтому, в конечном счете, он управляется общими регуляторными механизмами сердечнососудистой системы. Отсюда тесная взаимосвязь между регуляцией дыхания и кровообращения, которая особенно ярко проявляется при мышечной деятельности.
К этому следует добавить, что дыхательные колебания внутригрудного давления, действуя по принципу «двойного насоса», не только обеспечивают вентиляцию легких, но и помогают венозному возврату крови к сердцу. В свою очередь, пульсовые толчки давления в воздухоносных путях и альвеолах, вызванные сокращениями сердца, способствуют внутрилегочному смещению газов, создавая его кардиогенный компонент.
9.3.Транспорт газов между легкими и тканями
9.3.1.Диффузия кислорода и углекислого газа через аэрогематический барьер
Перенос О2 из альвеолярного газа в кровь и СО2 из крови в альвеолярный газ происходит исключительно путем диффузии. Ее движущей силой служат разности (градиенты) парциальных давлений (напряжений) О2 и СО2 по обе стороны аэрогематического барьера, образованного альвеолокапиллярной мембраной (см. табл. 9.1). Никакого механизма активного транспорта газов здесь не существует.
Кислород и углекислый газ диффундируют в растворенном состоянии: все воздухоносные пути увлажнены слоем слизи. Важное значение для облегчения диффузии О2 имеет сурфактантная вытилка альвеол, так как кислород растворяется в фосфолипидах, входящих в состав сурфактантов, гораздо лучше, чем в воде.
В ходе диффузии через аэрогематический барьер молекулы растворенного газа должны преодолеть (рис. 9.10): слой сурфактанта, альвеолярный эпителий, две основные мембраны, эндотелий кровеносного капилляра. Ввиду того, что в транспорте дыхательных газов существенную роль играют эритроциты, к этому списку добавляются слой плазмы и мембрана эритроцита.

Рис. 9.10. Аэрогематический барьер: 1 — альвеола, 2 — эпителий альвеолы, 3 — эндотелий капилляра, 4 — интерстициальное пространство, 5 — основная мембрана, 6 — эритроцит, 7 — капилляр
Диффузионная способность легких для кислорода очень велика. Это обусловлено огромным числом (сотни миллионов) альвеол и большой их газообменной поверхностью (у человека она составляет около 100 м2), а также малой толщиной (порядка 1 мкм) альвеолокапиллярной мембраны. Диффузионная способность легких у человека равна примерно 25 мл О2/мин в расчете на 1 мм рт. ст. градиента парциальных давлений кислорода. При учете того, что градиент РО2 между притекающей к легким венозной
кровью и альвеолярным газом обычно превышает 50 мм рт. ст., этого оказывается вполне достаточно, чтобы за время прохождения через легочный капилляр (около 0,8 с) напряжение кислорода в ней успело уравновеситься с альвеолярным РО2 . Несколько более
низкое (на 3—6 мм рт. ст.) артериальное РО2 по сравнению с альвеолярным объясняется
проникновением венозной крови в артериальную через невентилируемые альвеолы, а также артериовенозные шунты. Лишь при ускорении легочного кровотока, например при тяжелой мышечной работе, когда время прохождения крови через капилляры альвеол может сокращаться до 0,3 с, наблюдается недонасыщение крови кислородом в легких, что, однако, возмещается увеличением минутного объема крови.
Что касается диффузии СО2 из венозной крови в альвеолы, то даже сравнительно небольшого градиента РСО 2 (6—10 мм рт. ст.) здесь оказывается вполне достаточно, так
как растворимость СО2 в 20—25 раз больше, чем у кислорода. Поэтому после прохождения крови через легочные капилляры РСО 2 в ней оказывается почти равным
альвеолярному — обычно около 40 мм рт. ст.
9.3.2. Транспорт кислорода кровью
Лишь небольшая часть О2 (около 2 %), переносимого кровью, растворена в плазме.

Основная его часть транспортируется в форме непрочного соединения с гемоглобином, который у позвоночных содержится в эритроцитах. В молекулы этого дыхательного пигмента входят видоспецифичный белок — глобин — и одинаково построенная у всех животных простетическая группа — гем, содержащая двухвалентное железо.
Присоединение кислорода к гемоглобину (оксигенация гемоглобина) происходит без изменения валентности железа, т. е. без переноса электронов, характеризующего истинное окисление. Тем не менее, гемоглобин, связанный с кислородом, принято называть окисленным (правильнее — оксигемоглобин), а отдавший кислород — восстановленным
(правильнее — дезоксигемоглобин).
1 г гемоглобина может связать 1,36 мл газообразного О2 (при атмосферном давлении). Учитывая, к примеру, что в крови человека содержится примерно 15 г% гемоглобина, 100 мл его крови могут переносить около 21 мл О2. Это так называемая кислородная емкость крови. Оксигенация гемоглобина (иначе говоря, процент, на который используется кислородная емкость крови) зависит от парциального давления О2 в среде, с которой контактирует кровь. Такая зависимость описывается кривой диссоциации оксигемоглобина (рис. 9.11). Сложная S-образная форма этой кривой объясняется кооперативным эффектом четырех полипептидных цепей гемоглобина, кислородсвязывающие свойства (сродство к О2) которых различны.
Рис. 9.11. Кривые диссоциации оксигемоглобина: А — кривая насыщения гемоглобина кислородом при нормальном содержании СО2; Б — влияние изменения напряжения СО2 на кривую диссоциации оксигемоглобина; 1 — при низком содержании CО2, 2 — норма, 3 — при высоком содержании СО2
Благодаря |
такой |
особенности венозная кровь, проходя легочные капилляры |
(альвеолярное |
РО2 |
приходится на верхнюю часть кривой), оксигенирируется почти |
полностью, а артериальная кровь в капиллярах тканей (где РО2 соответствует крутой
части кривой) эффективно отдает О2. Отдаче кислорода способствует содержащийся в эритроцитах 2,3-дифосфоглицерат, синтез которого усиливается при гипоксии и интенсификации окислительного процесса в тканях.
Кривая диссоциации оксигемоглобина сдвигается вправо при повышении температуры и при увеличении концентрации водородных ионов в среде, которая, в свою очередь, зависит от РСО 2 (эффект Бора). Поэтому создаются условия для более полной отдачи
кислорода оксигемоглобином в тканях, особенно там, где выше интенсивность метаболизма, например в работающих мышцах. Однако и в венозной крови большая или меньшая часть (от 40 до 70%) гемоглобина остается в оксигенированной форме. Так, у человека каждые 100 мл крови отдают тканям 5—6 мл О2 (так называемая артериовенозная разница по кислороду) и, естественно, на ту же величину обогащаются кислородом в легких.
Сродство гемоглобина к кислороду измеряется величиной парциального давления кислорода, при которой гемоглобин насыщается на 50 % (P50), У человека оно составляет в норме 26,5 мм рт. ст. для артериальной крови. Параметр P50 отражает способность

дыхательного пигмента связывать кислород. Этот параметр выше для гемоглобина животных, обитающих в бедной кислородом среде, а также для так называемого фетального гемоглобина, который содержится в крови плода, получающего кислород из крови матери через плацентарный барьер.
9.3.3. Транспорт углекислого газа кровью
Хотя СО2 растворяется в жидкости гораздо лучше, чем О2, только 3—6 % общего количества продуцируемого тканями СО2 переносится плазмой крови в физически растворенном состоянии. Остальная часть вступает в химические связи (рис. 9.12).
Рис. 9.12. Реакции, происходящие в процессе обмена кислородом и углекислым газом между эритроцитом (I), плазмой (II) и легочной альвеолой (III) Объяснение см. в тексте
Поступая в тканевые капилляры, СО2 гидратируется, образуя нестойкую угольную кислоту:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- Направление этой обратимой реакции зависит от РСО 2 в среде. Она резко ускоряется
под действием фермента карбоангидразы, находящегося в эритроцитах, куда СО2 быстро диффундирует из плазмы.
Около 4/5 углекислого газа транспортируется в виде гидрокарбоната НСО3-. Связыванию СО2 способствует уменьшение кислотных свойств (протонного сродства) гемоглобина в момент отдачи им кислорода — дезоксигенирование (эффект Холдена). При этом гемоглобин высвобождает связанный с ним ион калия, с которым в свою очередь, реагирует угольная кислота:
К+ + НbО2 + Н+ + НСО3- = ННb + КНСО3 + О2
Часть ионов НСО3- диффундирует в плазму, связывая там ионы натрия, в эритроцит же поступают в порядке сохранения ионного равновесия ионы хлора.
Кроме того, также за счет уменьшения протонного сродства дезоксигенированный гемоглобин легче образует карбаминовые соединения, связывая при этом еще около 15 % переносимого кровью СО2.
Влегочных капиллярах происходит высвобождение части СО2, который диффундирует
вальвеолярный газ. Этому способствует более низкое, чем в плазме, альвеолярное РСО 2 , а
также усиление кислотных свойств гемоглобина при его оксигенации. В ходе дегидратации угольной кислоты в эритроцитах (эта реакция тоже резко ускоряется карбоангидразой) оксигемоглобин вытесняет ионы калия из гидрокарбоната. Ионы НСО3- поступают из плазмы в эритроцит, а ионы Сl- — в обратном направлении. Таким путем каждые 100 мл крови отдают в легких 4—5 мл СО2 — то же количество, какое кровь
