
2 курс / Микробиология 1 кафедра / Доп. материалы / Культуральные_методы_диагностики_туберкулеза
.pdf
Примеры приготовления питательных сред с препаратами
Стрептомицин
Для определения лекарственной чувствительности к стрептомицину используют стрептомицина сульфат. По данным производителя, активность стрептомицина сульфата составляет 750 мг в 1 г чистой субстанции.
Чтобы получить исходный рабочий раствор А, содержащий в 1 мл раствора 1 мг активной субстанции, следует приготовить навеску 20 мг стрептомицина сульфата с точностью до 0,2 мг, что будет соответствовать 15 мг активного начала, и растворить эту навеску в 15 мл стерильной дистиллированной воды – 1 мг/мл = 1000 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (40 пробирок по 5 мл) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 2 мл раствора А + 198 мл среды = 10 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора А, а затем расчетное количество питательной среды, после чего тщательно перемешать содержимое круговыми движениями колбы. Разлить содержимое колбы в 40 пробирок по 5 мл в каждую. Пробирки поместить в наклонном положении в аппарат для свертывания, добиваясь равномерной величины косяков (примерно 8–10 см), и проводить процедуру свертывания питательной среды в обычном порядке.
Изониазид
Активность препарата: в 1 г чистой субстанции содержится 990 мг активного начала = 99%.
Приготовить навеску 20 мг изониазида. Далее приготовить растворы:
А: в 20 мл стерильной дистиллированной воды растворить 20 мг изониазида – 1 мг/ мл = 1000 мкг/мл;
Б: к 9 мл стерильной дистиллированной воды добавить 1 мл раствора А – 100 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл х 40 пробирок) для каждого из двух разведений препарата необходимо в две стерильные промаркированные колбы (колба № 1 – 1 мкг/мл, колба
№2 – 10 мкг/мл) стерильной пипеткой налить последовательно:
в № 1 – 2 мл раствора Б + 198 мл среды = 1 мкг/мл;
в № 2 – 2 мл раствора А + 198 мл среды = 10 мкг/мл.
Желательно вначале налить в колбы расчетное количество раствора Б или А, а затем расчетное количество питательной среды. Содержимое каждой колбы необходимо тщательно перемешать круговыми движениями и разлить в 40 пробирок по 5 мл в каждую, начиная с колбы № 1. Пробирки поместить в наклонном положении в аппарат для свертывания, добиваясь равномерной величины косяков (примерно 8– 10 см), и проводить процедуру свертывания питательной среды в обычном порядке.
Рифампицин
Активность препарата: в 1 г чистой субстанции – 970 мг активного начала = 97%.
Рифампицин нерастворим в дистиллированной в воде. Для приготовления раствора препарата рекомендуется использовать следующую последовательность приготовления растворов.



 180 Культуральные методы диагностики туберкулеза
180 Культуральные методы диагностики туберкулеза

Взвесить 30 мг порошковидной формы чистой субстанции рифампицина. Приготовленную навеску перенести в стерильную пробирку (1): 30 мг RIF + 2,0 мл этанола или диметилформамида – 14550 мкг/мл.
При использовании этанола: подогреть до t 35–40 °С на водяной бане.
Затем, используя стерильные пробирки, приготовить растворы:
А: 2,0 мл раствора (1) + 5,2 мл Н2О – 4000 мкг/мл;
Б: 2,5 мл раствора А + 2,5 мл Н2О – 2000 мкг/мл.
Для ускорения полного растворения препарата допустимо легкое подогревание на водяной бане до 35–40 оС.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (40 пробирок по 5 мл) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 4 мл раствора Б + 196 мл среды = 40 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора Б, а затем добавить в нее расчетное количество питательной среды. Содержимое колбы тщательно перемешать круговыми движениями, а затем разлить в 40 пробирок по 5 мл в каждую. Пробирки поместить в наклонном положении в аппарат для свертывания, добиваясь равномерной величины косяков (примерно 8–10 см), и проводить процедуру свертывания питательной среды в обычном порядке.
Этамбутол
Для определения лекарственной устойчивости используется этамбутол дигидрохлорид. Активность препарата: в 1 г чистой субстанции – 740 мг активного начала.
Приготовить навеску препарата весом 20 мг вещества. Затем приготовить растворы:
А: растворить 20 мг этамбутола в 14,8 мл стерильной дистиллированной воды – 1 мг/мл = 1000 мкг/мл;
Б: к 8 мл стерильной дистиллированной воды добавить 2 мл раствора А – 200 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл ×40 пробирок) на каждое разведение препарата необходимо в две стерильные промаркированные колбы (колба № 1 – 2 мкг/мл, колба № 2 – 5 мкг/мл) стерильной пипеткой налить последовательно:
в № 1 – 2 мл раствора Б + 198 мл среды = 2 мкг/мл;
в № 2 – 5 мл раствора Б + 195 мл среды = 5 мкг/мл.
Желательно вначале налить в обе колбы расчетное количество раствора Б, а затем последовательно добавить в каждую из них расчетное количество питательной среды. Тщательно перемешать содержимое круговыми движениями колбы. Затем содержимое каждой колбы разлить в 40 пробирок по 5 мл в каждую, начиная с колбы № 1. Пробирки поместить в аппарат для свертывания и проводить процедуру свертывания питательной среды в обычном порядке.
Канамицин
Активность препарата: в 1 г чистой субстанции канамицина моносульфата колеблется от 750 до 823 мг активного начала. Для расчета возьмем величину активности, равную 750 мкг в 1 мг.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
181 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

ЧтобыполучитьисходныйрабочийрастворА,содержащийв1млраствора2000 мкг активной субстанции, следует приготовить навеску 30 мг порошковидной формы канамицина моносульфата = 22,5 мг активного начала и растворить ее в 11,3 мл стерильной дистиллированной воды – 2 мг/мл = 2000 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (40 пробирок по 5 мл) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 3 мл раствора А + 197 мл среды = 30 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора А, а затем добавить в нее расчетное количество питательной среды. Тщательно перемешать содержимое круговыми движениями колбы, а затем разлить его в 40 пробирок по 5 мл в каждую. Пробирки поместить в наклонном положении в аппарат для свертывания, добиваясь равномерной величины косяков (примерно 8–10 см), и проводить процедуру свертывания питательной среды в обычном порядке.
Протионамид (этионамид)
Оба препарата плохо растворяются в воде.
Активность препарата: в 1 г чистой субстанции – 990 мг активного начала. Препарат нерастворим в дистиллированной воде, поэтому для приготовления рас-
твора А следует приготовить навеску препарата весом 20 мг вещества и растворить ее в 3 мл ректифицированного этилового спирта 96° или диметил-сульфоксида, а затем добавить к раствору 6,9 мл стерильной дистиллированной воды – 2000 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл ×40) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 3 мл раствора А + 197 мл среды = 30 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора А, а затем добавить в нее расчетное количество питательной среды. Перемешивание, разливание и коагулирование производят так же, как и в предыдущем случае.
Капреомицин
Содержание активного начала в препарате – 840 мг в 1 г.
Растворы капреомицина отличаются нестабильностью, поэтому их готовят непосредственно перед приготовлением сред.
Приготовить навеску 20 мг вещества. Затем приготовить раствор А: 20 мг капреомицина + 8,4 мл Н2О – 2000 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл × 40) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 3 мл раствора А + 197 мл среды = 30 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора А, а затем расчетное количество питательной среды. Перемешивание, разливание и коагулирование производят так же, как с канамицином.
Циклосерин (D-cycloserin)
В 1 г препарата содержится 980 мг активного начала.
Растворы циклосерина отличаются нестабильностью, поэтому их готовят непосредственно перед приготовлением сред.



 182 Культуральные методы диагностики туберкулеза
182 Культуральные методы диагностики туберкулеза

Для приготовления раствора А следует приготовить навеску препарата весом 20 мг вещества и растворить в 9,9 мл стерильной дистиллированной воды – 2 мг/мл = 2000 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл × 40) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 3 мл раствора А + 197 мл среды = 30 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора А, а затем расчетное количество питательной среды. Перемешивание, разливание и коагулирование производят так же, как с канамицином.
ПАСК
Активность препарата: в 1 г чистой субстанции – 877,2 мг активного начала. Для примера расчета возьмем среднюю величину активности, равную 880 мг в 1 г.
Чтобы получить исходный рабочий раствор А, содержащий в 1 мл раствора 1,0 мг активной субстанции, следует взвесить 20 мг порошковидной формы ПАСК = 17,6 мг активного начала и растворить навеску в 17,6 мл стерильной дистиллированной воды – 1 мг/мл = 1000 мкг/мл.
Затем готовят раствор Б: к 18 мл стерильной дистиллированной воды добавить 2 мл раствора А – 100 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл ×40) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 2 мл раствора Б + 198 мл среды = 1 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора Б, а затем расчетное количество питательной среды. Перемешивание, разливание и коагулирование производят так же, как с канамицином.
Офлоксацин
Активность препарата: в 1 г чистой субстанции – 1000 мг активного начала. Офлоксацин нерастворим в дистиллированной воде, для его растворения при-
меняется 0,1N раствор NaOH. Для приготовления указанного раствора к навеске 0,4 г NaOH добавляют 100 мл стерильной дистиллированной воды = 0,1N раствор NaOH. Далее готовят растворы:
А: приготовить навеску препарата весом 20 мг вещества и растворить ее в 20 мл
0,1N раствора NaOH – 1 мг/мл = 1000 мкг/мл;
Б: к 12 мл стерильной дистиллированной воды добавить 3 мл раствора А –
200 мкг/мл.
Приготовление питательной среды. Для приготовления 200 мл питательной среды на 40 культур (5 мл ×40) необходимо в стерильную промаркированную колбу стерильной пипеткой налить последовательно: 2 мл раствора Б + 198 мл среды = 2 мкг/мл.
Желательно вначале налить в колбу расчетное количество раствора Б, а затем расчетное количество питательной среды. Перемешивание, разливание и коагулирование производят так же, как с канамицином.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
183 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

 Приложение 4
Приложение 4
Видовая идентификация нетуберкулезных микобактерий
Все культуры, которые дали рост на среде Левенштейна–Йенсена с салициловым натрием или на среде с ПНБК, относятся к нетуберкулезным микобактериям и подлежат идентификации до вида.
Видовая идентификация НТМБ по степени сложности применяемых методик подразделяется на первичную и окончательную.
Первичная идентификация основана на морфологических и фенотипических свойствах МБ и проводится в базовых лабораториях ПТД. При осуществлении первичной идентификации своими силами бактериолог в наиболее короткий срок может установить принадлежность выделенной культуры к патогенным, потенциаль- но-патогенным, сапрофитным микобактериям или к группе родственных микроорганизмов. Знание видовой принадлежности микобактерий определяет дальнейшую тактику лечащего врача. Так, однократное выделение из диагностического материала потенциально-патогенных микобактерий требует повторного бактериологического обследования больного. Частые находки сапрофитных микобактерий, широко распространенных в природе, в материале от больных, особенно M. gordonae, могут указывать на контаминацию материала при взятии анализа, на загрязнение водопроводной или дистиллированной воды.
Окончательная идентификация основана на углубленном изучении биохимических свойств и культуральных потребностей МБ и осуществляется в лабораториях научных учреждений.
Первичная идентификация НТМБ
Первичная идентификация основана на таких признаках, как:
скорость роста;
способность образования пигмента;
способность роста при различных температурах.
Для выявления этих признаков не требуется специального оборудования и реактивов, поэтому их можно изучать в бактериологических лабораториях ПТД. Рекомендуется иметь дополнительный термостат с температурой 45 °С.
Скорость роста
Скорость роста микобактерий – это время, необходимое для формирования видимых, зрелых колоний на плотной среде.
МБ, которые формируют такие колонии в течение 7 дней, называются быстрорас тущими. К группе быстрорастущих МБ относятся М. fortuitum и M. chelonae, для полного роста которых требуется не более 5 дней. Однако при выделении из патологического материала быстрорастущие МБ могут иметь более продолжительный период роста.
МБ, которым для формирования колоний необходим более длительный период времени, называются медленнорастущими. К ним относятся M. avium, M. kansasii,



 184 Культуральные методы диагностики туберкулеза
184 Культуральные методы диагностики туберкулеза

M. xenopi и др. В то же время избыток посевного материала может быть причиной быстрого появления роста медленнорастущих МБ. Кроме того, учет скорости роста необходимо проводить по времени образования сформированных колоний, а не по появлению инициального роста.
Скорость роста МБ оценивают по скорости роста субкультуры.
Методика выполнения
0,1 мл суспензии исследуемой культуры в стандартном разведении засевают на среду Левенштейна–Йенсена, инкубируют при температуре 37 °С. Наблюдение за культурой первые 5–7 дней ежедневное, далее – еженедельно, до момента появления сформированных колоний.
За скоростью роста культуры можно наблюдать при определении лекарственной чувствительности микобактерий. Читать результаты лекарственной чувствительности быстрорастущих микобактерий можно через 5–7 дней, медленнорастущих – через 21 день.
Рост микобактерий при разных температурах. Определение способности роста при разных температурах
Методика выполнения
1.Приготовить суспензию исследуемой культуры в физиологическом растворе по стандарту мутности № 5.
2.Развести в десять раз (0,5 мл суспензии прибавить к 4,5 мл физиологического раствора).
3.Засеять по 0,2 мл суспензии на 4 пробирки со средой Левенштейна–Йенсена.
4.Инкубировать засеянные пробирки при 22 (комнатная температура), 28, 37 и 45 °С.
Почти все виды НТМБ хорошо растут при 22 °С. При температуре 45 °С растут 86% культур М. avium и все культуры М. xenopi.
Способность продуцировать пигмент
Колонии НТМБ могут иметь как кремовую, так и интенсивную желто-оранжевую окраску. В зависимости от окраски колоний и способности образования пигмента под действием света нетуберкулезные микобактерии делятся на 3 группы.
1.Фотохромогенные МБ. Продуцируют желтый пигмент только под действием света, в темноте они имеют кремовый цвет. Типичным представителем этой группы является М. kansasii.
2.Скотохромогенные МБ. Продуцируют пигмент от интенсивно-желтого до оранжевого цвета при росте как на свету, так и в темноте. К ним относятся М. gordonae
и М. xenopi.
3.Нехромогенные МБ. Не образуют пигмент, их колонии имеют только беловатые или кремовые оттенки. В эту группу входят М. avium, M. malmoens, M. terrae complex и др. Среди них встречаются культуры, которые изменяют окраску в процессе старения или при неблагоприятных условиях роста (22 °С).
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
185 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

Определение фотохромогенных свойств микобактерий
Методика выполнения
1.Приготовить суспензию исследуемой культуры в физиологическом растворе по стандарту мутности № 5.
2.Развести в десять раз (0,5 мл суспензии прибавить к 4,5 мл физиологического раствора).
3.Засеять по 0,2 мл суспензии на 2 пробирки со средой Левенштейна–Йенсена. Завернуть обе пробирки в алюминиевую фольгу (для защиты от воздействия света в термостате).
4.Инкубировать при температуре 37 °С.
5.Через 8–10 дней появляется инициальный рост культуры. Взять одну из пробирок, освободить от фольги и поместить на 2 часа под яркий солнечный или электрический свет. После окончания воздействия света пробирку маркировать надписью «свет» и продолжить инкубацию в термостате при температуре 37 °С.
6.Через 1–2 дня проверяют окраску культуры. Если под воздействием света куль-
тура в пробирке «свет» приобрела желтую окраску, а в контрольной пробирке осталась кремовой, то это фотохромогенная культура.
На основании применения самых простых бактериологических методов, позволяющих выявить специфические признаки НТМБ, а также используя уже описанные выше салицилатный тест и определение нитратредуктазы, можно провести первичную идентификацию МБ.
|
|
|
|
|
|
Т а б л и ц а 1 |
|
Характеристика наиболее часто встречающихся в клиническом материале |
|||||||
|
видов нетуберкулезных микобактерий |
|
|||||
|
|
|
|
|
|
|
|
Виды |
Скорость |
Пигмен- |
Рост |
Восстанов- |
Деградация |
||
при температуре |
|||||||
микобактерий |
роста |
тация |
|
|
ление |
салицилата |
|
колоний |
|
|
нитратов |
натрия |
|||
22 °С |
45 °С |
||||||
|
|
||||||
|
|
|
|
|
|
|
|
M. avium |
M |
H |
+ |
+ |
– |
– |
|
M. intracellulare |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
M. xenopi |
M |
C |
– |
+ |
– |
– |
|
|
|
|
|
|
|
|
|
M. kansasii |
M |
Ф |
+ |
– |
+ |
– |
|
|
|
|
|
|
|
|
|
M. malmoense |
M |
H |
+ |
– |
– |
– |
|
|
|
|
|
|
|
|
|
M. scrofulaceum |
M |
C |
+ |
– |
+ |
– |
|
|
|
|
|
|
|
|
|
M. gordonae |
M |
C |
+ |
– |
– |
– |
|
|
|
|
|
|
|
|
|
M. terrae complex |
M |
H |
+ |
– |
+ |
– |
|
|
|
|
|
|
|
|
|
M. fortuitum |
Б |
Н |
+ |
– |
+ |
+ |
|
|
|
|
|
|
|
|
|
M. chelonae |
Б |
Н |
+ |
– |
– |
+ |
|
|
|
|
|
|
|
|
|
M. flavescens |
Б |
С |
+ |
– |
+ |
– |
|
|
|
|
|
|
|
|
|
Примечание. М – медленнорастущие, Б – быстрорастущие, С – скотохромогенные, Ф – фотохромогенные, Н – нехромогенные.



 186 Культуральные методы диагностики туберкулеза
186 Культуральные методы диагностики туберкулеза

Так, если быстрорастущая МБ показала деградацию салицилового натрия, то это может быть M. fortuitum или M. chelonae.
Следует определить наличие нитратредуктазы: положительная реакция у
M. fortuitum, отрицательная – у M. chelonae.
Медленнорастущая нехромогенная МБ – M. avium (наиболее частый возбудитель микобактериоза) и M. terrae complex (сапрофитные МБ).
Следует определить способность роста выделенной МБ при различных температурах: при температуре 45 °С растут M. avium и не растут представители M. terrae complex.
Таким образом, на основании знания нескольких свойств микобактерий можно провести первичную идентификацию. Для окончательной идентификации выделенные культуры направляют в лаборатории научно-исследовательских институтов.
Окончательная идентификация
Окончательная идентификация с применением сложных биохимических исследований проводится в специализированных лабораториях. Идентификация проводится на основании определения активности ферментов (амидазы, арилсульфатаза, каталаза), толерантности к различным химическим агентам, способности к гидролизу Твина 80, восстановлению нитратов и теллурита калия, усвоению железа, росту на среде с хлористым натрием.
Результаты первоначальных исследований МБ позволяют выбрать биохимические тесты, необходимые для окончательной идентификации НТМБ (схемы 1, 2, 3, 4).
Схема 1
Непигментированные медленнорастущие микобактерии
Экспозиция на свету
Фотохромогенные |
Нехромогенные |
(желтый пигмент) |
(гладкие, мелкие, куполообразные колонии) |
M. kansasii |
Гидролиз Твина 80 |
|
M. marinum |
|
|
M. simiae |
+ |
– |
M. asiaticum |
M. terrae complex |
M. avium complex |
|
M. gastri |
M. haemophilum |
|
M. malmoense |
|
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
187 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|

Схема 2
Скотохромогенные медленнорастущие микобактерии (желтые или оранжевые)
Восстановление нитратов
+ |
|
– |
M. szulgai |
|
|
M. flavescens |
Гидролиз Твина 80 |
|
M. thermoresistibile |
|
|
– |
|
+ |
M. scrofulaceum |
M. gordonae |
|
|
|
M. xenopi |
Схема 3
Непигментированные быстрорастущие микобактерии Трехдневная арилсульфатаза
+ |
|
|
|
|
|
– |
|
|
|
|
|
|
|
|
|
||||
M. fotuitum |
complex |
|
M. smegmatis |
||||||
|
|
|
|
|
|
|
M. agri |
|
|
|
|
|
|
|
|
|
M. fallax |
||
|
|
|
|
|
|
||||
Усвоение железа |
|
M. porcinum |
|||||||
Восстановление нитратов |
|
M. pulveris |
|||||||
|
|
|
|
|
|
|
M. moriokaense |
||
+ |
|
|
|
– |
|
M. tsukamurella |
|||
M. fortuitum |
M. chelonae |
|
|
|
|
||||
Схема 4 |
|
|
|
|
|
|
|
||
|
|
|
Пигментированные быстрорастущие микобактерии |
||||||
Скотохромогенные |
|
Фотохромогенные |
|||||||
Появление пигмента |
Позднее |
Невысокая |
Высокая |
||||||
одновременно |
|
|
фотохромогенная |
фотохромогенная |
|||||
с ростом |
|
|
|
активность |
активность |
||||
|
|
|
|
|
|
|
|
|
|
M. flavescens |
|
M. smegmatis |
M. marinum |
M. vaccae |
|||||
M. aurum |
|
|
|
M. parafortuitum |
M. neoaurum |
||||
M. phlei |
|
|
|
|
|
|
|
||
M. thermoresistibilae |
|
|
|
|
|
|
|||
M. gadium |
|
|
|
|
|
|
|
||
M. chubuense |
|
|
|
|
|
|
|
||
M. gilvum |
|
|
|
|
|
|
|
||
M. poriferae |
|
|
|
|
|
|
|
||
M. komossense |
|
|
|
|
|
|
|
||
M. sphagni |
|
|
|
|
|
|
|
||
M. obuense |
|
|
|
|
|
|
|
||
M. aichiense |
|
|
|
|
|
|
|
||
M. tokaiense |
|
|
|
|
|
|
|
||
M. austroafricanum |
|
|
|
|
|
|
|||



 188 Культуральные методы диагностики туберкулеза
188 Культуральные методы диагностики туберкулеза
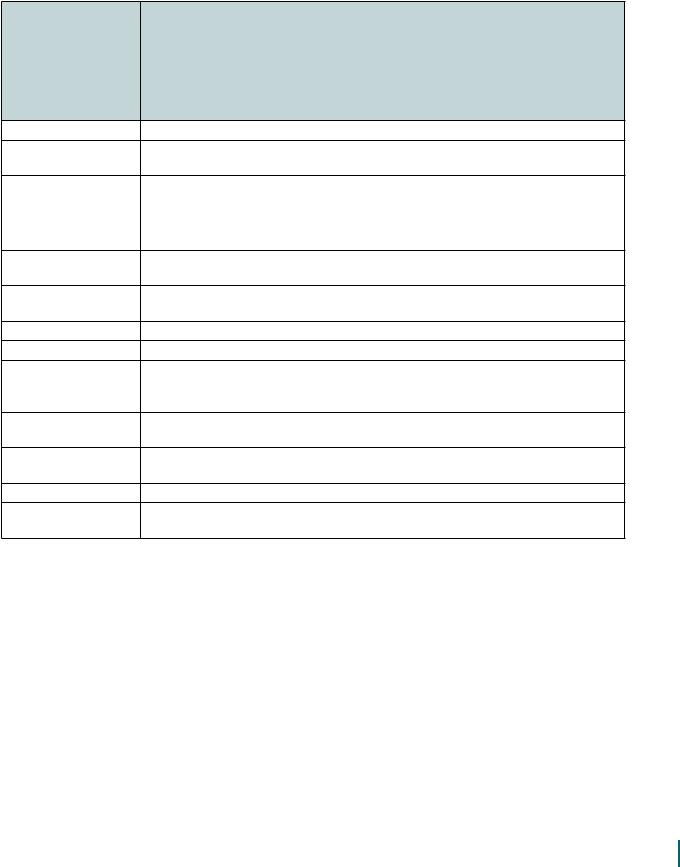
Биохимический профиль и морфологические свойства испытуемого штамма следует сопоставить с данными таблицы 2, чтобы определить вид МБ.
Т а б л и ц а 2
Характеристика наиболее часто встречающихся в клиническом материале видов нетуберкулезных микобактерий
Свойство
культуры
Скорость роста
Пигментация колоний
Рост
при темпtратуре: 22 °С 45 °С
Восстановление
нитратов
Деградация салицилового натрия
Каталаза (68 °С)
Уреаза
Восстановление теллурита калия в течение 3 дней
Гидролиз Твина 80
Рост на среде с 5% NaCl
Усвоение железа
Арилсульфатаза 3 дня
М. avium |
M. xenopi |
M. kansasii |
M. malmoense |
M. scrofulaceum |
M. terrae complex |
M. gordonae |
M. fortuitum |
M. сhelonae |
M. simiae |
M. smegmatis |
M. vaccae |
М |
М |
М |
М |
М |
М |
М |
Б |
Б |
М |
Б |
Б |
Н |
С |
Ф |
Н |
С |
Н |
С |
Н |
Н |
Ф |
Н |
С |
± |
± |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
± |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
+ |
– |
– |
– |
+ |
– |
– |
± |
– |
+ |
– |
– |
+ |
+ |
– |
– |
– |
– |
– |
– |
– |
+ |
± |
– |
– |
– |
+ |
± |
+ |
± |
+ |
+ |
+ |
+ |
± |
+ |
+ |
+ |
– |
– |
+ |
+ |
– |
– |
– |
+ |
+ |
+ |
|
|
+ |
– |
– |
– |
± |
– |
– |
± |
± |
– |
+ |
+ |
– |
– |
+ |
+ |
– |
+ |
+ |
– |
– |
– |
+ |
+ |
– |
– |
– |
– |
– |
± |
– |
+ |
В |
– |
+ |
В |
– |
– |
– |
– |
– |
– |
– |
+ |
– |
– |
+ |
+ |
– |
– |
– |
– |
– |
± |
– |
+ |
+ |
– |
– |
– |
|
|
|
|
|
|
|
|
|
|
|
|
Примечание. М – медленнорастущие, Б – быстрорастущие, Н – нехромогенные, С – скотохромогенные, Ф – фотохромогенные, В – варьирует.
Биохимические методы идентификации микобактерий
Каталаза – внутриклеточный фермент, способный расщеплять перекись водорода на воду и кислород. Наличие фермента определяется путем добавления перекиси водорода в исследуемую культуру МБ и наблюдения за образованием пузырьков кислорода. Фактически все МБ, за исключением М. gastri, изониазид-устойчивых МБТ, М. bovis и некоторых непатогенных штаммов М. kansasii, имеют этот фермент. Виды каталазопродуцирующих МБ различаются по степени каталазной активности, которую определяют у интактных клеток полуколичественным методом, и по термостабильности фермента, которую определяют при нагревании культуры до 68 °С.
Учебное пособие для проведения базового курса обучения |
|
|
|
|
|
|
|
189 |
|
|
|
|
|
|
|
специалистов бактериологических лабораторий учреждений противотуберкулезной службы |
|
|
|
|
|
|
