
- •Клинико-патогенетическое обоснование применения экстракта из культуры термофильного штамма золотистого стафилококка в комплексной терапии токсидермий
- •Глава 1. Обзор литературы
- •Глава 3. Клиническая характеристика больных
- •Глава 1. Обзор литературы.
- •Распространенность, классификация, клинические проявления токсидермии.
- •Современные подходы к лечению токсидермии.
- •Глава 2. Собственные методы исследования и лечения.
- •Методы исследования у больных токсидермией.
- •Методика лечения больных токсидермией.
- •Глава3. Клиническая характеристика больных токсидермией.
- •Глава 4. Динамика основных показателей иммунитета у больных токсдермией под воздействием экстракта из культуры термофильного штамма золотистого стафилококка.
- •Состояние регуляции иммунного ответа у больных токсидермией.
- •Влияние экстракта из культуры термофильного штамма золотистого стафилококка на иммунологические показатели у больных токсидермией.
- •Глава 5. Клиническая эффективность экстракта из культуры термофильного штамма золотистого стафиококка у больных токсидермией.
Глава 5. Клиническая эффективность экстракта из культуры термофильного штамма золотистого стафиококка у больных токсидермией.
Для лечения токсидермий с тяжелым и рецидивирующим течением применяют системную терапию. Объем лечения зависит от тяжести общего состояния и степени выраженности поражений кожи. Назначения включают антигистаминные препараты, энтеросорбенты, кортикостероидные гормоны в средних и больших дозах, кортикостероиды пролонгированного действия, гемодез, местное применение кортикостероидных мазей и анилиновых красителей, а так же различные средства и методы воздействия на основные патогенетические звенья.
Проведенные исследования показали, что у пациентов с длительно протекающей токсидермией наблюдаются различные иммунные нарушения. Применение у таких пациентов иммуномодуляторов позволяет значительно повысить эффективность проводимой терапии.
Мы применили в комплексной терапии больных токсидермией препарат с иммуномодулирующей направленностью - экстракт из культуры термофильного штамма золотистого стафилококка.
Всего под нашим наблюдением находилось 56 пациентов.
При включении больных в исследование для проведения различных методов лечения по поводу токсидермии были использованы следующие критерии:
клинические проявления токсидермии на момент первичного
обращения;
отсутствие иммуномодулирующей терапии в течение последних двенадцати месяцев.
Для проведения исследования не включались следующие группы больных:
Пациенты младше 18 лет;
Беременные и кормящие женщины;
Пациенты с сахарным диабетом либо с нарушенной толерантностью к глюкозе;
Пациенты с тяжелыми соматическими заболеваниями;
Пациенты с нарушениями функции печени. Контролем являлось повышение уровня АлАТ и АсАТ более чем в 3 раза относительно верхней границы нормы в биохимических анализе крови;
Пациенты с нарушением функции почек. Контролем являлось повышение уровня креатинина более 1,5 мг/мл в биохимическом анализе крови.
В группы больных, получавших лечение, равномерно включались пациенты с различными формами токсидермии, однородные по возрастному составу, что позволяло сделать объективные выводы о сравнительной клинической эффективности использованных в работе методов лечения (табл. 23).
Таблица 23
Распределение больных по возрастному составу, получавших различные
виды лечения
Возраст |
I группа |
II группа |
Всего: |
|||
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
До 20 |
2 |
4 (7) |
1 |
2 (3) |
3 |
5,4 |
20-29 |
4 |
7 ( 14) |
4 |
7 (15) |
8 |
14,3 |
30-39 |
5 |
9 (17) |
3 |
5 (10) |
8 |
14,3 |
40-49 |
7 |
12 (24) |
5 |
10 (19) |
12 |
21,4 |
50-59 |
8 |
14 (28) |
8 |
14 (30) |
16 |
28,6 |
≥ 60 |
3 |
5 (10) |
6 |
11 (23) |
9 |
16 |
Итого: |
29 |
51 (100) |
27 |
49 (100) |
56 |
100 |
В зависимости от проводимой терапии пациенты были распределены на 2 группы (табл. 24). Первую группу составили пациенты, получавшие комплексное лечение, включавшее антигистаминную,
десенсибилизирующую, дезинтоксикационную терапии и экстракт из культуры термофильного штамма золотистого стафилококка. Вторую группу составили пациенты, получавшие стандартную десенсибилизирующую, дезинтоксикационную терапии, наружно - кортикостероидные мази.
Таблица 24
Распределение пациентов в зависимости от получаемого лечения
№ группы |
Метод лечения |
Количество пациентов |
1 |
Комплексная терапия и рузам |
29 (52%) |
2 |
Стандартная терапия |
27 (48%) |
В группе пациентов, получавших комплексную терапию (табл. 25) у 15 (52%) наблюдался пятнисто-папуллезный тип токсидермии, у 12 (41%) токсидермия с выраженным экссудативным компонентом, у 2 (7%) пациентов с проявлениями геморрагических высыпаний.
Таблица 25
Распределение пациентов первой группы по клиническим
разновидностям токсидермии
-
Клинические разновидности
Количество пациентов
Абс.
%
Первая разновидность: пятнисто-
папуллезный тип
15
52
Вторая разновидность: токсидермия с
выраженным экссудативным компонентом
12
41
Третья разновидность: с проявлением
геморрагических высыпаний
2
7
Всего
29
100
Препаратами выбора являлись: тавегил 1,0 в/м, гемодез 400,0 в/в, глюконат кальция 10% 10,0 в/в, в тяжелых случаях (у трех больных)
преднизалон 60 мг/сут. Длительность проводимой терапии составляла от 21
день.
В составе комплексной терапии пациенты получали экстракт из культуры термофильного штамма золотистого стафилококка по схеме 1,0 подкожно 1 раз в неделю, на курс лечения всего 3 инъекции.
У большинства пациентов (79%) в процессе лечения отмечалась положительная динамика. Так, на 2-3 день проводимой терапии удавалось достигнуть стабилизации в состоянии патологического процесса: купировать появление новых элементов, явления интоксикации, значительно снизить интенсивность островоспалительных явлений. Наиболее выраженная положительная динамика наблюдалась у пациентов с пятнисто- папулезным типом токсидермии (52%), представленный фиксированной эритемой, центробежной эритемой, высыпаниями тождественными клиническими проявлениями красного плоского лишая. На 2-3 день лечения новые элементы не появлялись, отмечалось незначительное улучшение в виде регресса очагов инфильтрации и эритемы. Через 3-7 дней после начала лечения происходило разрешение элементов с образованием гиперпигментированных пятен, которые вскоре бесследно исчезали.
У 12 пациентов (41%) со второй разновидностью токсидермии с выраженным экссудативным компонентом. Данная разновидность заболевания отличалась островоспалительным распространенным полиморфным характером. В клинической картине превалировали явления отечной эритемы, везикуляции, мокнутия, высыпания по типу многоформной экссудативной эритемы. Течение заболевания сопровождалось явлениями общей интоксикации в виде подъема температуры, озноба, потливости, общей слабости. В целом в ряде случаев генерализация процесса приводила к состоянию эритродермии. Положительная динамика отмечалась на 3-5 день терапии. Происходила практически полная эпителизация высыпаний, инфильтрация и островоспалительные явления постепенно регрессировали.
Отмечалось улучшение общего состояния пациентов, уменьшение болезненности в области высыпаний, прекращение зуда.
У больных с третьей разновидностью токсидермии патологический процесс характеризовался появлением геморрагических высыпаний, распространенных, сливных, длительно существующих уртикарных элементов. Отмечался резкий подъем температуры, общая слабость, головная боль, потливость, боли в мелких и крупных суставах. Обратная эволюция элементов происходила в течение 7-10 дней комплексного подхода к лечению. Однако уже на 2-3 день отмечалось стихание симптомов общей интоксикации на фоне регресса небольших по размерам элементов. Интенсивность эритемы уменьшилась. Полное разрешение кожного процесса наблюдалось на 10-12 день проводимой терапии: купировался зуд, полная эпителизация эрозий, на их месте сохранились очаги гиперпигпентации.
Клиническое выздоровление (табл. 26), характеризующееся полным разрешением кожного процесса, достигнуто отмечается у 23 пациентов первой группы (79%),получавших комплексную терапию с использованием экстракта из культуры термофильного штамма золотистого стафилококка.
Таблица 26 Эффективность комплексной терапии токсидермий с использованием экстракта из культуры термофильного штамма золотистого
стафилококка
Клиническая эффективность комплексной терапии |
Количество пациентов |
|
Абс. |
% |
|
Клиническое выздоровление |
23 |
79 |
Значительное улучшение |
4 |
14 |
Улучшение |
2 |
7 |
Без эффекта |
- |
- |
Всего |
29 |
100 |
Значительное улучшение с регрессом большей части элементов получено у 4 больных (14%), улучшение в динамике кожного процесса, выражающееся в прекращении появления новых элементов наблюдалось у 2 пациентов (7%). Каких-либо побочных действий и осложнений в процессе лечения у данной группы (первой группы) больных токсидермий не выявлено.
Во второй группе больных, получавших стандартную комплексную терапию (табл. 27), у 13 пациентов (48%) наблюдалась фиксированная эритема и высыпания схожие с клиническими проявлениями красного плоского лишая, у 12 больных (44%) в клинической картине отмечались явления отечной эритемы, везикуляции, мокнутия и у 2 пациентов (8%) диагностирована третья разновидность токсидермии с появлением геморрагических высыпаний, сливных уртикарных элементов, узловато- гиподермальных некротизирующихся образований.
Таблица 27
Распределение пациентов, получавших стандартную терапию по формам
клинического течения
-
Клинические разновидности
Количество пациентов
Абс.
%
Первая разновидность: пятнисто-
папуллезный тип
13
48
Вторая разновидность:
токсидермия с выраженным экссудативным компонентом
12
44
Третья разновидность с
проявлением геморрагических высыпаний
2
8
Всего
27
100
Пациенты, как первой, так и второй группы получали антигистаминные препараты (диазолин, тавегил, супрастин), десенсибилизирующую терапию
(тиосульфат натрия 30% по 10 мл в/в; глюконат кальция 10%). Во второй группе у трех больных с островоспалительным характером течения патологического процесса, по типу эритродермии, сопровождающейся явлениями общей интоксикации, в комплекс лечебных мероприятий был включен преднизалон по 60 мг/сут с постепенным снижением до полной отмены. По показаниям были назначены препараты, улучшающие микроциркуляцию: трентал по 5 мл в 200 мл хлорида натрия, 0,9% гемодез. Проводилась наружная терапия: обработка очагов поражения 2% спиртовыми (водными) растворами анилиновых красителей, кортикостероидные мази (адвантан).
На фоне проводимой терапии у пациентов второй группы отмечалась положительная динамика кожного процесса. Наиболее выраженный клинический эффект наблюдался при лечении пациентов с пятнисто- папуллезным типом. К 3-4 дню терапии отмечалась стабилизация кожного процесса с прекращением появления новых высыпаний, значительным уменьшением интенсивности воспаления и пятна приобретают гиперпигментный характер. Полная обратная эволюция элементов отмечалась к 12-14 дню терапии.
У пациентов со второй и третьей разновидностью токсидермий на 3-4 день отмечалось улучшение общего состояния, уменьшение выраженности воспалительной реакции, отечности, гиперемии в очаге поражения. Сроки полного разрешения кожного процесса у большинства пациентов составляли 14-16 дней от момента начала терапии. Купирование симптомов общей интоксикации: уменьшение температуры тела, зуда, озноба, потливости, общей слабости. Полный регресс таких явлений как отечная эритема, везикуляция, мокнутия.
В целом, клинический эффект от проводимой стандартной терапии у пациентов 2-й группы с тяжелыми формами токсидермии был менее выражен по сравнению с пациентами 1-й группы. Период регресса кожного процесса у
этих больных проходил медленнее (в среднем на 2-6 день), по сравнению с пациентами, получавшими комплексную терапию.
Клиническое выздоровление (табл. 28) наблюдалось у 14 пациентов второй группы (52%), значительное улучшение у 8 пациентов (30%), улучшение у 4 больных (15%), отсутствие клинического эффекта у 1 пациента (3%).
Таблица 28
Эффективность стандартной терапии у пациентов с токсидермией
Клиническая эффективность стандартной терапии |
Количество пациентов |
|
Абс. |
% |
|
Клиническое выздоровление |
14 |
52 |
Значительное улучшение |
8 |
30 |
Улучшение |
4 |
15 |
Без эффекта |
1 |
3 |
Всего |
27 |
100 |
Дальнейшее наблюдение в интервале от 1 месяц до 1 года показало, что у 20 пациентов (69%) первой группы отмечалась стойкая клиническая ремиссия в течение всего периода наблюдения (более 1 года), у 7 больных (24%) ремиссия сохранялась в течение полугода (табл. 29).
Таблица №29 Сроки клинической ремиссии у пациентов
Группы |
Сроки клинической ремиссии у пациентов |
Кол-во пациентов |
|||||||||||||
1 мес. |
3 мес. |
6 мес. |
>1 года |
Абс |
% |
||||||||||
Абс |
% |
Абс |
% |
абс |
% |
Абс |
% |
|
|
||||||
I группа Комбинированная терапия |
- |
- |
2 |
7 |
7 |
24 |
20 |
69 |
29 |
100 |
|||||
IIгруппа Стандартная терапия |
4 |
15 |
10 |
37 |
10 |
37 |
3 |
11 |
27 |
100 |
|||||
У 2 пациентов (7%) отмечены обострения кожного процесса в течение 2 месяцев от момента окончания лечения. Рецидив, который возникал из-за употребление в пищу некачественной продукции, самостоятельного прерывания курса назначенных лечебных мероприятий и другое, характеризовался появлением локализованных эритематозных высыпаний легко купирующимися наружной терапией (кортикостероидные мази).
У пациентов второй группы отмечались более частые рецидивы кожного процесса. Так, после применения стандартной терапии у 10 пациентов (37%) ремиссия сохранялась в течение полугода, а у 14 пациентов в течение 1-3 месяцев (52 %) отмечался рецидив заболевания, и лишь у трех больных (11%) наблюдалась стойкая клиническая ремиссия в течение всего периода наблюдения (более 1 года).
Таким образом, анализ данных показал, что, несмотря на положительное влияние стандартной терапии на течение патологического процесса, ее применение не приводило к увеличению периода ремиссии. Применение комбинированной терапии (кортикостероидные средства и экстракта из культуры термофильного штамма золотистого стафилококка) способствовало не только более быстрому разрешению клинической симптоматики, но и удлинению периода ремиссии с невысоким числом рецидивов заболевания.
Проведенные исследования свидетельствуют о целесообразности включения экстракта из культуры термофильного штамма золотистого стафилококка в схемы лечения больных с различными клиническими формами токсидермии.
В качестве иллюстрации приводим следующие клинические наблюдения.
Больной М., 73 года поступил в отделение дневного стационара Московского Научно-Практического Центра Дерматовенерологии и Косметологии Департамента Здравоохранения г.Москвы филиал
Черемушкинский с жалобами на высыпания, сопровождающиеся сильным зудом.
Anamnes morbi: Считает себя больным около 10 дней, когда впервые появились зудящие высыпания. Начало заболевания связывает с избыточным приемом меда и приемом цетрина. Обратился в поликлинику по месту жительства, где проходил амбулаторное лечение: глюконат калиция, акридерм, без видимого положительного эффекта. В связи с чем госпитализирован в дневной стационар с предварительным диагнозом токсидермия.
Перенесенные заболевания: ОРВИ, детские инфекции.
Сопутствующие заболевания: хронический тонзилит, хронический холецистит, хронический гастрит.
Объективно: Состояние средней тяжести. Телосложение правильное, температура тела 36,8 градусов. Сознание ясное. Ориентирован во времени и пространстве. Регионарные лимфотические узлы не увеличены. Костно- суставная и мышечная система без особенностей. Дыхание везикулярное, частота дыхательных движений 18 в 1 минуту, границы сердца в пределах нормы, частота сердечных сокращений 70 в 1 минуту, артериальное давление 110/60 мм.рт.ст., аскультативно шумов нет. Язык свободен от высыпаний. Границы печени в пределах нормы, пальпация безболезненна. Мочеиспускание свободное, безболезненное. Физиологические отправления в норме.
St. localis: Патологический процесс на коже носит распространенный островоспалительный характер, локализуется преимущественно на коже туловища, верхних и нижних конечностей и характеризуется разнообразной в морфологическом отношении сыпью. На коже туловища и конечностей высыпания представлены многочисленными пятнистыми, уртикарными, папулезными, папуловезикулезными элементами. Ногтевые пластины обеих костей визуально не изменены. Ногтевые пластины пальцев обеих стоп желтого цвета, с явлениями подногтевого гиперкератоза
(Рис.15).

Рисунок 15. Больной М. Диагноз: токсидермия. До начала лечения.
Анализ крови на lues, ВИЧ-инфекцию, маркеры гепатита В и С отрицательный.
Исследование на определение специфических антител к Treponema pallidum методом ИФА - не обнаружена.
Общий анализ крови: лейкоциты 32,7 х 10^3/мкл, лимфоциты 25,3 х
10^3/мкл, гемоглабин 11,4 г/дл, эритроциты 3,73 х 10^6 мкл, гематокрит 33%.
Иммунологическое обследование крови: IL1β – 28,1 пг/мл, IL1-RA – 186,3 пг/мл, ФНО-α- 85,6пг/мл, Г-ЛСФ- 96,4пг/мл, IL8 – 265,3 пг/мл, IL10 –
6,9 пг/мл, МИФ-34,3 нг/мл, sCD50-211,3 U/мл, sCD54- 31,2U/мл, CD50+ -
83,5%, CD54+ - 86,2, NO- 33,5 мкмоль/мл.
Больному назначено лечение: гемодез 400,0 в/в №10; глюконат кальция
10% 10,0 в/в №10; тавегил 1,0 в/м №10; рузам 1,0 подкожно 1раз в неделю
№3; пимафукорт наружно на очаги; "циндол" болтушка на тело.
На фоне проводимой терапии отмечалось выраженное улучшение в виде значительного регресса очагов инфильтрации и эритемы (Рис. 16).

Рисунок 16. Тот же Больной М. Спустя 7 дней после начала лечения.
Иммунологическое обследование крови: IL1β – 27,1 пг/мл, IL1-RA – 148,5 пг/мл, ФНО-α- 34,6 пг/мл, Г-ЛСФ- 27,6 пг/мл, IL8 – 37,8 пг/мл, IL10 –
12,8 пг/мл, МИФ-7,1 нг/мл, sCD50-230,1 U/мл, sCD54- 34,7U/мл, CD50+ -
60,3%, CD54+ - 63,1%, NO- 19,7 мкмоль/мл.
Спустя две недели после окончания лечения патологический процесс полностью регрессировал. После проведенного лечения выписан со стойким клиническим выздоровлением. При последующем наблюдении в течение года рецидивов заболевания не выявлено.
Больной У., 1959 года рождения поступил в отделение дневного стационара Московского научно-практического центра дерматовенерологии и косметологии департамента здравоохранения Москвы (филиал
Черемушкинский) в марте 2013 с диагнозом токсидермия. При поступлении предьявлял жалобы на чувство жжения и зуда в области лица.
Анамнез заболевания: Считает себя больным около двух недель, когда впервые появились высыпания в области лица и кистей, которые сопровождались значительным зудом и болезненностью в местах высыпаний. Начало заболевания связывает с нарушением диеты и приемом лекарственных средств (энап). Лечился самостоятельно: телфаст, травокорт, без видимого улучшения. Обратился в КВД по месту жительства, в связи с чем был госпитализирован в дневной стационар с предварительным диагнозом токсидермия.
Перенесенные заболевания: ОРВИ, детские инфекции, язвенная болезнь двенадцатиперстной кишки.
Сопутствующие заболевания: хронический простатит.
Объективно: Состояние средней тяжести. Регионарные лимфоузлы не увеличены. Границы сердца не изменены. Артериальное давление 130/80 мм. рт. ст. Границы печени в пределах нормы. Слизистые свободны от высыпаний. Мочеиспускание свободное. Физиологические отправления в норме.
Status localis: Патологический процесс на коже носит распространенный островоспалительный характер, локализуется только на коже лица и кистей. Высыпания на коже лица представлены многочисленными пятнистыми, уртикарными, папуллезными, эритематозно- сквамозными элементами. Так же отмечается мелкопластинчатое шелушение в местах высыпаний и сильный зуд. Ногтевые пластины кистей и стоп визуально не изменены (Рис. 17).

Рисунок 17. Больной У. Диагноз: токсидермия. До лечения.
Анализ крови на сифилис, ВИЧ-инфекция, маркеры гепатита В и С отрицательны. При определении методом ИФА специфических антител к Treponema pallidum не обнаружено.
Общий анализ крови: гемоглобин 159 г/л, эритроциты 5,44 х 1012/л,
тромбоциты 270 х 109/л, лейкоциты 7,4 х 109/л, нейтрофиллы палочкоядерные 1%, нейтрофиллы сегментоядерные 63 х 109/л, эозинофиллы 1%, лимфоциты 22%, моноциты 8%, СОЭ 5 мм/ч.
Иммунологическое обследование крови: IL1β – 30,2 пг/мл, IL1-RA – 190,2 пг/мл, ФНО-α- 83,9пг/мл, Г-ЛСФ- 85,7пг/мл, IL8 – 249,4 пг/мл, IL10 –
7,1 пг/мл, МИФ-32,8 нг/мл, sCD50-215,7 U/мл, sCD54- 32,8U/мл, CD50+ -
85,4%, CD54+ - 83,6, NO- 32,4 мкмоль/мл
Больному назначено лечение: гемодез 400,0 мл внутривенно капельно
№10; тиосульфат натрия 30%- 10,0 внутривенно №10; телфаст 150 мг 1 раз в день №14; рузам 1 мл подкожно 1 раз в неделю №3; энтеросгель 1 столовая ложка 2 раза в день №5; целестодерм В на кожу кистей, пимафукорт наружно на лицо.
На фоне терапии отмечено выраженное улучшение в виде значительного утихания кожного процесса. Уменьшение эритемы, очагов инфильтрации, полного прекращения зуда, жжения и ощущения стягивания кожи (Рис. 18). Спустя 9 дней патологический процесс на коже полностью регрессировал.

Рисунок 18. Тот же Больной У. После лечения.
129,4 пг/мл, ФНО-α- 27,9 пг/мл, Г-ЛСФ- 26,3 пг/мл, IL8 – 32,9 пг/мл, IL10 –
12,9 пг/мл, МИФ-8,1 нг/мл, sCD50-229,2 U/мл, sCD54- 38,7U/мл, CD50+ -
62,1%, CD54+ - 60,0%, NO- 20,1 мкмоль/мл
При последующем наблюдении в течение полугода рецидивов заболевания не выявлено.
Больная Р., 1949 года рождения (64 года) поступила в отделение дневного стационара Московского научно-практического центра дерматовенерологии и косметологии Департамента здравоохранения Москвы (филиал Черемушкинский) с жалобами на высыпания, которые сопровождаются сильным зудом.
Анамнез заболевания: Считает себя больной около 8 дней, когда впервые появились высыпания на передней поверхности бедра, коленных суставах, которые сопровождались сильным зудом и покраснением. Начало заболевания связывает с использованием мази вольтарена и свечей вольтарена. Лечилась самостоятельно гидрокортизоновой мазью- без видимого эффекта. Обратилась в поликлинику по месту жительства, откуда была направлена в КВД №23 с диагнозом токсидермия.
Перенесенные заболевания: ОРВИ, детские инфекции.
Сопутствующие заболевания: хронический гастрит, гипертоническая болезнь, хронический цистит.
Обективно: Состояние средней тяжести. Сознание ясное, ориентирована во времени и пространстве. Регионарные лимфотические узлы не увеличены. Дыхание везикулярное, хрипов нет. Границы сердца в пределах допустимых значений. Артериальное давление 135/80 мм. рт. ст., аускультативно шумов нет. Слизистые оболочки визуально не изменены. Мочеиспускание свободное, безболезненное, физиологические отправления в норме.
Status localis: Патологический процесс на коже носит распространенный островоспалительный характер, локализуется
преимущественно на коже нижних конечностей (передняя поверхность бедра, область коленных суставов). Высыпания характеризуются выраженной гиперемией, отечностью, сильным зудом, шелушением. Так же сыпь представлена пятнистыми, уртикарными, папулезными, папуловезикузными элементами, многочисленными экскориациями. Ногтевые пластинки кистей не изменены. Ногтевые пластины стоп желтого цвета, с явлениями гиперкератоза (Рис. 19).

Рисунок 19. Больная Р. Диагноз: токсидермия. До начала лечения.
Анализ крови на ВИЧ, сифилис, гепатиты отрицательны. Общий анализ крови: в пределах нормы.
185,2 пг/мл, ФНО-α- 84,9пг/мл, Г-ЛСФ- 86,6пг/мл, IL8 –269,7 пг/мл, IL10 –
7,4 пг/мл, МИФ-33,6 нг/мл, sCD50-214,3 U/мл, sCD54- 33,8 U/мл, CD50+ -
87,4%, CD54+ - 82,9, NO- 32,0 мкмоль/мл.
Больная получила лечение: физиологический раствор 200,0 внутривенно №10; преднизалон 30 мг внутривенно №1; тиосульфат натрия 30%- 10, 0 внутривенно №10; тавегил 1,0 внутримышечно №10; рузам 1мл подкожно 1 раз в неделю №3; синафлан наружно.
На фоне проведенной терапии отмечено выраженное улучшение в виде значительного регресса очагов инфильтрации, уменьшение отечности, прекращения зуда (Рис. 20).
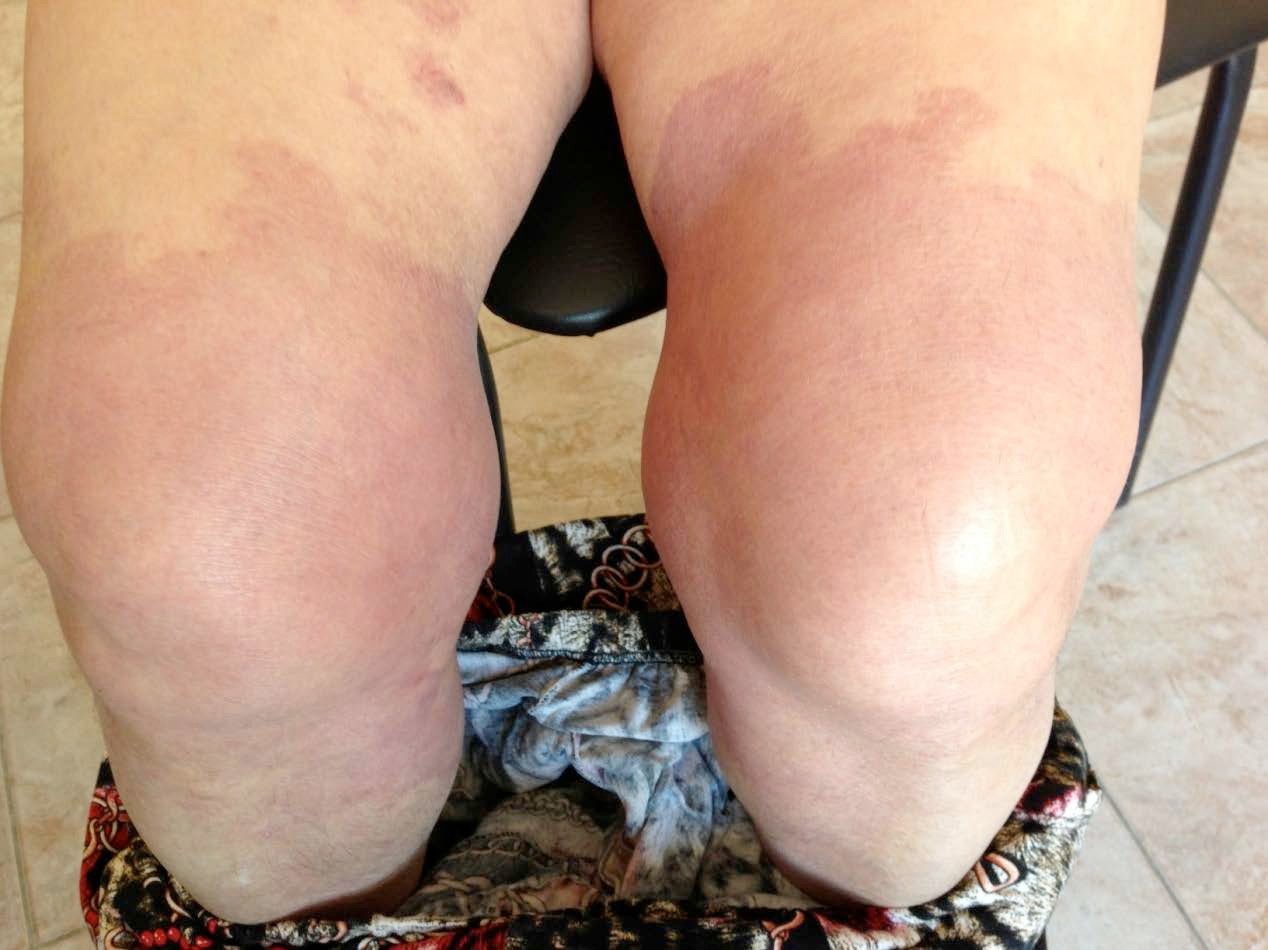
Рисунок 20. Та же больная спустя 8 дней после лечения.
Иммунологическое обследование крови: IL1β – 26,7 пг/мл, IL1-RA – 128,9 пг/мл, ФНО-α- 25,1 пг/мл, Г-ЛСФ- 24,9 пг/мл, IL8 – 33,9 пг/мл, IL10 –
12,0 пг/мл, МИФ-9,1 нг/мл, sCD50-223,2 U/мл, sCD54- 37,7U/мл, CD50+ -
63,1%, CD54+ - 60,9%, NO- 20,0 мкмоль/мл
Спустя 14 дней после окончания лечения патологический процесс полностью регрессировал и пациентка выписана со стойким клиническим выздоровлением. В течении года рецидивов заболевания не выявлено.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ.
Токсидермия наиболее часто встречающийся дерматоз и занимает одно из ведущих мест в общей структуре всех заболеваний кожи. Значение частоты встречаемости колеблются до 44% среди кожных заболеваний и являются одной из наиболее частых причин обращения за медицинской помощью. Течение токсидермии отличается широкой вариабельностью: от локализованных форм до разновидностей, характеризующихся, не только обширным поражением кожных покровов, но и вовлечением в процесс других органов и систем, что приводит к росту заболеваемости, а также увеличению расходов государства на здравоохранение. Выявленные при токсидермии стойкие нарушения со стороны иммунной системы, успешное применение иммуномодуляторов различного происхождения для лечения токсидермии показали перспективность дальнейших исследований в этом направлении, что позволит иметь объективные представления о механизмах развития этого заболевания и разработать новые более эффективные программы его лечения.
Вышеизложенные факты определили цель (патогенетически обосновать применение экстракта из культуры термофильного штамма золотистого стафилококка, оценить его клиническую эффективность и безопасность в комплексной терапии больных токсидермией) и задачи нашего исследования (изучить особенности клинического течения токсидермии на современном этапе; оценить влияние экстракта из культуры термофильного штамма золотистого стафилококка на интерлейкинзависимую регуляцию гуморального иммунитета у больных токсидермией, исследовать состояние системы естественных клеток киллеров, динамику продукции оксида азота и молекул адгезии у больных токсидермией в процессе применения экстракта из культуры термофильного штамма золотистого стафилококка, изучить клиническую эффективность и безопасность применения экстракта из культуры термофильного штамма золотистого стафилококка и разработать показания для его применения у
больных токсидермией).
Группа пациентов, находившаяся под нашим наблюдением, составила
56 человек (25 мужчин и 31 женщина) в возрасте от 20 до 75 лет. Все больные были распределены на 2 группы однородные по возрастному составу и клиническим разновидностям токсидермии. Первую группу составили пациенты, получавшие комплексное лечение, включавшее кортикостероидную, антигистаминную терапии и рузам. Вторую группу составили пациенты, получавшие стандартную кортикостероидную и антигистаминную терапии. Лечение проводилось в условиях дневного стацинара и амбулаторно в филиале Черемушкинский Московского Научно- Практического Центра дерматовенерологии и косметологии.
В возрастной структуре больных наибольший удельный вес приходился на пациентов, находящихся в наиболее трудоспособном возрасте (20-50 лет) - 31 больных (55%).
У значительного числа пациентов токсидермия носила хронический рецидивирующий характер. При изучении причинных факторов заболевания обращает на себя внимание широкая палитра медикоментозных средств. Наибольший риск возникновения токсико-аллергических реакций прослеживается при приеме антибактериальных препаратов (44%). Что происходит от бесконтрольного использования вышеуказанных медикоментозных средств. В ряде случаев отмечались больные с пятнисто- папулезной разновидностью токсидермии, так называемая "сульфаниламидная группа" – 7 пациентов (16%). В этом случае токсидермия возникала, как правило, после применения сульфаниламидных и анальгизирующих препаратов. патологический процесс протекал без выраженных изменений общего самочувствия больных. Так же выявлено, что наибольшая угроза возникновения токсидермии возникала в случае одновременного применения двух или трех лекарственных средств.
У большинства наблюдаемых – 28 пациентов (50%) - была диагностирована пятнисто-папуллезная форма токсидермии, при других
вариантах токсидермии патологический процесс принимал мономорфный характер с выраженным экссудативным компонентом - 24 пациента (43%). При последнем варианте на коже имели место быть одновременно элементы как экссудативного, так и пролиферативного генеза - 4 пациента (8%) .
У многих больных наблюдались явления общей интоксикации. Учитывая разнообразие клинических проявлений токсидермии, у пациентов в клинической картине заболевания преобладали явления отечной эритемы - 28 пациентов (50%), везикуляция, мокнутие - 24 пациента (43%), наличие
геморрагических высыпаний – 4 пациента (8%).
Сбор анамнеза с последующим анализом факторов, провоцирующих возникновение токсидермии, показал, что наибольший удельных вес в структуре сопутствующих заболеваний приходился на заболевания органов пищеварения (гастриты, холециститы и др.) - 17 пациентов (30%). Вместе с тем следует отметить, что только у 3 наблюдавшихся (5%) сопутствующих заболеваний не выявлено.
Рецидивы заболевания отмечались на фоне приема антибиотикотерапии у 19 больных (44%), сульфаниламидных препаратов - 7 больных (16%), анальгезирующих средств, НПВС - 5 больных (12%).
Таким образом, полученные данные свидетельствовали о том, что патологический процесс у большей части наблюдавшихся нами больных носил длительный хронический рецидивирующий характер, торпидный к ранее проводимым терапевтическим мероприятиям.
Проведенные исследования показали, что течение токсидермии сопровождалось различными нарушениями со стороны лабораторных анализов. Чаще всего выявлялись анемия, лейкоцитоз, со сдвигом лейкоцитарной формулы влево, ускорение СОЭ, нарушение биохимических анализов крови.
Комплексные иммунологические исследования, проведенные у больных с различными клиническими разновидностями токсидермии,
позволили выявить разнообразные нарушения в деятельности иммунной системы.
Уровень в сосудистом русле ФНО-α у больных с токсидермией значительно превышал аналогичные референтные значения (21,3±2,1 пг/мл, достигая 85,6±3,8 пг/мл. Повышенное содержание ФНО-α оказывало стимулирующее влияние на процессы активации макрофагов, лимфоцитов, усиливало поступление активированных мононуклеаров в очаги воспаления.
Поскольку, у обследованных больных токсидермией было значительное повышение по сравнению с референтными значениями (23,8±2,2 пг/мл) уровня в сосудистом русле Г-КСФ до 96,4±8,5 пг/мл, который является основным гемопоэтическим фактором роста, который обеспечивает пролиферацию, дифференцировку и терминальное созревание миелоидных предшественников нейтрофильных гранулоцитов, а также стимулирует разнообразные функции зрелых нейтрофилов. Увеличение концентрации Г-КСФ может способствовать гиперактивации нейтрофильных лейкоцитов попадающих в кожу и вследствие этого поддерживать иммунное воспаление в дермо-эпидермальном пространстве больных токсидермией.
У больных токсидермией уровень IL-8 (265,3±15,6 пг/мл) значительно повышен по сравнению с аналогичными значениями у здоровых доноров (26,9±2,7 пг/мл). Учитывая, что IL-8 обладает способностью индуцировать молекулы адгезии, осуществляющие взаимодействие лейкоцитов и эндотелиальных клеток с последующим привлечением нейтрофилов и в меньшей степени макрофагов в зону воспаления, подъем уровня данного цитокина усиливал воспалительные изменения в дермо-эпидермальном пространстве.
Определение количественного содержания IL-10, продуцируемого Тh1/ Th2 дало возможность объективной оценки состояния регуляторного звена иммунной системы у больных токсидермией. Проведенные исследования позволили определить снижение уровня IL-10 до 6,9±1,6 пг/мл, при 13,2±2,3 пг/мл - у здоровых доноров. Снижение уровня IL-10 в крови способствует
хронизации воспалительных явлений в зоне пораженной кожи, усилению клеточного ответа по Тh2 пути с усиленной продукцией антител и возникновению патоморфологических изменений эпидермиса и дермы определяющих клиническую симптоматику токсидермии.
Проведенные исследования показали, что количественное содержание МИФ в крови в среднем по группе больных токсидермией статистически достоверно превышала (34,5 ± 2,9 нг/мл) аналогичный показатель у здоровых доноров (6,3 ± 0,6 нг/мл). Наиболее высокий уровень МИФ в периферической крови (38,8 ± 2,9 нг/мл) выявлено у больных с островоспалительным течением заболевания. Вместе с тем, резкий подъемом концентрации МИФ в крови отмечался при возникновении узлоподобных элементов и клинических проявлениях васкулита.
Спонтанное высвобождение МИФ культурой моноцитов больных токсидерией было статистически достоверно выше (14,4 ± 1,3 нг/мл), чем у здоровых доноров (4,3 ± 1,1 нг/ мл). При стимуляции моноцитов больных токсидермией конковалином А продукция МИФ составила 65,3 ± 8,9 нг/мл, что статистически достоверно выше референтных значений (23,5±1,7 нг/мл).
При оценке площади миграции клеток, которая определялась балансом МИФ и МСФ было установлено, что у больных токсидермией площадь миграции была значительно меньше (вследствие подавления миграции) таковой у здоровых доноров (более чем на 24%). У пациентов с обширными очагами поражения и явлениями общей интоксикации подавление миграции было максимальным. Индекс клеточной миграции, величина которого варьировала в интервале от 10% до 39% , возрастал при распространенных, островоспалительных формах токсидермии до 36 - 39%.
Таким образом, основываясь на результатах проведенных исследований, можно сделать вывод о том, что воспаление в дерме и эпидермисе как острое, так и хроническое при токсидермии в значительной степени связано с избыточной продукцией МИФ.
Механизмы естественной цитотоксичности (ЕЦТ) играют важную роль в уничтожении клеток-мишеней и в регуляции гуморального иммунитета. Оценка функциональной активности естественных клеток- киллеров ( ЕКК) у больных с различными клиническими вариантами течения токсидермии значительно повышена по сравнению с референтными значениями. Наиболее высокие показатели ЦИ (79,1±4,9% при 84,7±10,1%) прослеживались у больных с островоспалительными распространенными формами токсидермии.
В реализации воспаления важную роль играют антигены адгезии (ICAM-1, ICAM-3, LFA-1, VCAM-1). Основная функция молекул адгезии заключается в поддержании межклеточных взаимодействий, миграции клеток в очаг воспаления и инициации иммунного ответа. Антигены адгезии существуют как в растворимом состоянии, так и в мембрано-связанной форме на поверхности клеточных мембран. Проведенные до лечения исследования показали, что у больных токсидермией уровень сывороточного содержания антигенов sCD50 равный 211,3±35,9 U/мл и sCD54 - 31,2±3,5 U/мл был понижен по сравнению с референтными значениями (соответственно 233,2±36,1 U/мл и 35,4±3,6 U/мл). Однако эта разница была незначительной и не носила статистически достоверный характер. В то время как относительное количество мононуклеарных клеток CD50+ и CD54+ (83,5±6,1% и 86,2±6,4%) в сосудистом русле больных токсидермией статистически достоверно превышало референтные значения (60,3±4,8% и 63,0±4,9%). Функция растворимых антигенов CD50 и CD54 заключается в модуляции иммунологических реакций, протекающих с участием мембранных форм этих антигенов. Растворимые антигены CD50 и CD54 способны тормозить активацию клеток и процессы адгезии, связанные с клеточной миграцией. Растворимый антиген CD54 конкурирует с мембранным ICAM-1 эндотелиальных клеток за связывание с LFA-1 и тем самым снижает адгезию лейкоцитов к эндотелию. Поэтому выявленный дисбаланс в системе антигенов адгезии, характеризующийся понижением
растворимых молекул адгезии на фоне значительного роста мембранных форм данных антигенов являлся одним из причинных факторов возникновению и поддержанию воспаления у больных токсидермией.
При должном уровне естественной резистентности в организме стимулируется выработка индуцибельной NO-синтазы (iNOS) через транскрипцию гена. В таких случаях синтезируемый оксид азота (NO) влияет на перекисное окисление липидов при развитии воспалительного процесса. Учитывая, что оксид азота занимает одно из ведущих мест в системе неспецифической резистентности, немаловажным представлялось провести количественный анализ содержания NO в сыворотке крови у больных токсидермией. Изучение эндогенного NO проведено у 20 больных токсидермией и 15 здоровых доноров. Проведенные исследования показали, что результатом воспалительных и функциональных изменений при токсидермии приводило к увеличению выработки эндогенного NO до 33,5±2,8 мкмоль/л (18,9±1,5 мкмоль/л у здоровых доноров). Вместе с тем, резкое повышение оксида азота по сравнению с референтными значениями, переходящее рамки протективного иммунитета, способствовало поддержанию воспалительных явлений у больных токсидермией.
Результаты проведенных иммунологических исследований свидетельствовали о положительных изменениях в цитокиновом профиле больных токсидермией, которым назначался экстракт из культуры термофильного штамма золотистого стафилококка.
В процессе лечения экстрактом из культуры термофильного штамма золотистого стафилококка у больных токсидермией произошло резкое снижение в сосудистом русле провоспалительных цитокинов (ФНО-α - до 23,4±2,4 пг/мл), IL-1RА с 186,3±16,3 пг/мл до 130,8±15,5 пг/мл при 125,9±15,5 пг/мл - у здоровых доноров. Содержание IL-1β осталось практически на том же уровне (соответственно 28,1±2,4 пг/мл до 26,3±2,3 пг/мл при 24,5±2,3 пг/мл ).
Положительное воздействие экстракта из культуры термофильного штамма золотистого стафилококка на состояние цитокинового статуса больных токсидермией характеризовалось также значительным снижением количественного содержания Г-КСФ, играющего значительную роль в поддержании воспалительной реакции в дермо-эпидермальном пространстве, с 96,4±8,5 пг/мл до 27,6±2,3 пг/мл при 23,8±2,2 пг/мл - у здоровых доноров.
Снижение концентрации IL-8 (с 265,3±15,6 пг/мл до 37,8±2,9 пг/мл при 26,8±2,7 пг/мл – у здоровых доноров), что оказывало тормозящее действие на избыточный хемотаксис мононуклеаров нейтрофильных лейкоцитов в эпидермис пораженных участков кожи.
После окончания лечения экстрактом из культуры термофильного штамма золотистого стафилококка у больных токсидермией наблюдалось значительное повышение уровня IL-10 с 6,9±1,6 пг/мл до 12,8±2,2 пг/мл при 13,2±2,3 пг/мл – у здоровых доноров. Увеличение концентрации IL-10 на фоне резкого снижения уровня ФНО-α и IL-1RА у больных токсидермией приводила к нормализации соотношения провоспалительных и противовоспалительных интрлейкинов, восстановлению адекватного регуляторного ответа.
Проведенные исследования показали, что концентрация МИФ в крови больных токсидермией после применения экстракта из культуры термофильного штамма золотистого стафилококка статистически достоверно уменьшилась с 34,5±2,9 нг/мл до 7,10,6 нг/мл, практически не отличаясь от референтных значений (6,3±0,6 нг/мл).
Применение экстракта из культуры термофильного штамма золотистого стафилококка обеспечивало выраженное уменьшение спонтанного высвобождение МИФ культурой моноцитов больных токсидермией (с 14,4 ± 1,3 нг/мл – в исходном фоне до 4,1± 1,1 нг/ мл при 4,3±1,1 нг/ мл у здоровых доноров). Отмечалось снижение продукция МИФ моноцитами больных токсидермией при стимуляции их конковалином А с 65,3 ±8,9 нг/мл до 26,0 ± 1,7 нг/мл при 23,5 ± 1,7 нг/мл – у здоровых доноров.
В результате применения экстракта из культуры термофильного штамма золотистого стафилококка площадь миграции клеток определяемая балансом МИФ и МСФ у больных токсидермией увеличилась более чем на 18%. Индекс клеточной миграции, значительно уменьшившись, варьировал при различных по тяжести течения токсидермии от 2,9±0,5% до 6,9±0,7%. Наиболее значимым падение индекса клеточной миграции прослеживалось у пациентов с распространенным островоспалительным характером течения патологического процесса.
Таким образом, на основании результатов проведенных исследований можно сделать вывод о том, что положительный клинический эффект экстракта из культуры термофильного штамма золотистого стафилококка у больных токсидермией в немалой степени обусловлен нормализацией продукции МИФ.
Проведенные клинико-лабораторные исследования выявили высокую тропность экстракта из культуры термофильного штамма золотистого стафилококка к иммунокомпетентным клеткам. Применение экстракта из культуры термофильного штамма золотистого стафилококка у больных токсидермией оказывало стабилизирующее влияние на процессы синтеза и экспрессии цитокинов, что способствовало нормализации интерлейкинзависимой клеточной кооперации иммунокомпетентных клеток.
Функциональная активность ЕКК у больных с различными клиническими вариантами течения токсидермии после проведенного лечения экстрактом из культуры термофильного штамма золотистого стафилококка значительно снизилась по сравнению с исходными данными (до 47,1±3,3%), что блокировало процессы цитотоксичности к эпидермоцитам и нормализации продукции сывороточных антител.
После проведенного лечения экстрактом из культуры термофильного штамма золотистого стафилококка у больных токсидермией выявлен значительный рост концентрации в сосудистом русле антигенов sCD50 до 230,6±41,8 U/мл и sCD54 до 38,4±7,7 U/мл. Повышенные концентрации
растворимых антигенов CD50+ и CD54+ являлось результатом интенсивного шеддинга с поверхности антигенположительных клеток. Следствием такого процесса являлось статистически достоверное снижение относительного количества CD50 и CD54-положительных мононуклеарных клеток происходящее вследствие уменьшения плотности экспрессии данных антигенов на клеточной мембране (соответственно до 64,4±4,2 U/мл и 63,6±4,2 U/мл). Повышение сывороточных концентраций растворимых антигенов ICAM-1и ICAM-3 свидетельствовали о возникновении нормализующего процесса, направленного на торможение избыточной миграции воспалительных клеток в область пораженной кожи и купирования воспалительного процесса.
Выявлено, что применение экстракта из культуры термофильного штамма золотистого стафилококка у больных токсидермией способствовало уменьшению выработки эндогенного NO (с 33,5±2,78 мкмоль/л до 19,7±1,5 мкмоль/л). Наиболее значительным было снижение уровня оксида азота у больных токсидермией сопровождавшейся явлениями общей интоксикации.
Понижение содержания оксида азота по сравнению с исходным уровнем свидетельствовало о нормализации функционально-метаболической активности фагоцитов и мононуклеаров.
Таким образом, проведенные исследования показали, что оксид азота может рассматриваться как маркер степени активности и распространенности патологического процесса у больных токсидермией.
Отмечены положительные изменения в иммунном статусе больных токсидермией под влиянием экстракта из культуры термофильного штамма золотистого стафилококка.
В зависимости от проводимой терапии пациенты были распределены на 2 группы. I группу составили пациенты, получавшие комплексное лечение, включавшее кортикостероидную, антигистаминную терапии и экстракт из культуры термофильного штамма золотистого стафилококка. II
группу составили пациенты, получавшие стандартную кортикостероидную и антигистаминную терапии.
В I группе пациентов, получавших комплексную терапию у 15 (52%) наблюдался пятнисто-папуллезный тип токсидермии, у 12 (41%) токсидермия с выраженным экссудативным компонентом, у 2 (7%) пациентов с проявлениями геморрагических высыпаний.
Препаратами выбора являлись: тавегил 1,0 в/м, гемодез 400,0 в/в, глюконат кальция 10% 10,0 в/в, пимафукорт наружно на очаги. Длительность проводимой терапии составляла от 7 до 21 дня.
В составе комплексной терапии пациенты получали рузам по схеме 1,0
подкожно 1 раз в неделю, на курс лечения всего 3 инъекции.
У большинства пациентов в процессе лечения отмечалась положительная динамика. Так, на 2-3 день проводимой терапии удавалось достигнуть стабилизации в состоянии патологического процесса: купировать появление новых элементов, явления интоксикации, значительно снизить интенсивность островоспалительных явлений. Наиболее выраженная положительная динамика наблюдалась у пациентов с пятнисто- папулезным типом токсидермии. На 2-3 день лечения новые элементы не появлялись, отмечалось незначительное улучшение в виде регресса очагов инфильтрации и эритемы. Через 3-7 дней после начала лечения происходило разрешение элементов с образованием гиперпигментированных пятен, которые вскоре бесследно исчезали.
У пациентов со второй разновидностью токсидермии с выраженным экссудативным компонентом. Положительная динамика отмечалась на 3-5 день терапии. Происходила практически полная эпителизация высыпаний, инфильтрация и островоспалительные явления постепенно регрессировали. Отмечалось улучшение общего состояния пациентов, уменьшение болезненности в области высыпаний, прекращение зуда.
У больных с третьей разновидностью токсидермии патологический процесс регрессировал в течение 7-10 дней комплексного подхода к лечению.
Однако уже на 2-3 день отмечалось стихание симптомов общей интоксикации на фоне регресса небольших по размерам элементов. Интенсивность эритемы уменьшилась. Полное разрешение кожного процесса наблюдалось на 10-12 день проводимой терапии: купировался зуд, полная эпителизация эрозий, на их месте сохранились очаги гиперпигпентации.
Клиническое выздоровление, характеризующееся полным разрешением кожного процесса, достигнуто отмечается у 23 пациента (79%).
Значительное улучшение с регрессом большей части гнойничковых элементов получено у 4 больных (14%), улучшение в динамике кожного процесса, выражающееся в прекращении появления новых элементов наблюдалось у 2 пациентов (7%). Каких-либо побочных действий и осложнений в процессе лечения у данной группы (первой группы) больных токсидермий не выявлено.
Во II группе больных, получавших стандартную комплексную терапию, у 13 пациентов (48%) наблюдалась фиксированная эритема и высыпания схожие с клиническими проявлениями красного плоского лишая, у 12 больных (44%) в клинической картине отмечались явления отечной эритемы, везикуляции, мокнутия, буллезные элементы и у 2 пациентов (8%) диагностирована третья разновидность токсидермии с появлением геморрагических высыпаний, сливных уртикарных элементов, узловато- гиподермальных некротизирующихся образований.
Пациенты получали антигистаминные препараты (диазолин, тавегил, супрастин), десенсибилизирующую терапию (тиосульфат натрия 30% по 10 мл в/в; глюконат кальция 10%). По показаниям были назначены препараты, улучшающие микроциркуляцию: трентал по 5 мл в 200 мл хлорида натрия, 0,9% гемодез. Проводилась наружная терапия: обработка очагов поражения 2% спиртовыми (водными) растворами анилиновых красителей, кортикостероидные мази (адвантан).
На фоне проводимой терапии у пациентов второй группы отмечалась положительная динамика кожного процесса. Наиболее выраженный
клинический эффект наблюдался при лечении пациентов с пятнисто- папуллезным типом. К 3-4 дню терапии отмечалась стабилизация кожного процесса с прекращением появления новых высыпаний. Полная обратная эволюция элементов отмечалась к 12-14 дню терапии.
У пациентов со второй и третьей разновидностью токсидермий на 3-4 день отмечалось улучшение общего состояния, уменьшение выраженности воспалительной реакции, отечности, гиперемии в очаге поражения. Сроки полного разрешения кожного процесса у большинства пациентов составляли 14-16 дней от момента начала терапии.
В целом, клинический эффект от кортикостероидной терапии у пациентов II группы с тяжелыми формами токсидермии был менее выражен по сравнению с пациентами I группы. Период регресса кожного процесса у этих больных проходил медленнее (в среднем на 2-6 день), по сравнению с пациентами, получавшими комплексную терапию.
Клиническое выздоровление наблюдалось у 14 пациентов второй группы (52%), значительное улучшение у 8 пациентов (30%), улучшение у 4
больных (15%), отсутствие клинического эффекта у 1 пациента (3%).
Дальнейшее наблюдение в интервале от 1 месяц до года показало, что у
20 пациентов (69%) первой группы отмечалась стойкая клиническая ремиссия в течение всего периода наблюдения (более 1 года), у 7 больных (24%) ремиссия сохранялась в течение полугода.
У 2 пациентов (7%) отмечены обострения кожного процесса в течение
2 месяцев от момента окончания лечения. Рецидив легко купировался наружной терапией.
У пациентов второй группы отмечались более частые рецидивы кожного процесса. Так, после применения стандартной терапии у 10 пациентов (37%) ремиссия сохранялась в течение полугода, а у 14 пациентов в течение 1-3 месяцев (52 %) отмечался рецидив заболевания, и лишь у трех больных (11%) наблюдалась стойкая клиническая ремиссия в течение всего периода наблюдения (более 1 года).
Таким образом, анализ данных показал, что, несмотря на положительное влияние стандартной терапии на течение патологического процесса, ее применение не приводило к увеличению периода ремиссии. Применение комбинированной терапии (кортикостероидные средства и экстракта из культуры термофильного штамма золотистого стафилококка) способствовало не только более быстрому разрешению клинической симптоматики, но и удлинению периода ремиссии с невысоким числом рецидивов заболевания.
Выводы.
Анализ клинико-анамнестических данных 56 больных токсидермией показал, что все наблюдавшиеся пациенты были в активном трудоспособном возрасте (средний возраст 29 лет) с преобладанием женщин, с длительностью заболевания от 2 недель до 1 года. Выявлено, что в большинстве случаев патологический процесс носил полиморфный характер, отмечалась выраженная тенденция к затяжному характеру течения токсидермии и нарастающей резистентности к стандартным методам лечения.
Применение экстракта из культуры термофильного штамма золотистого стафилококка у больных токсидермией оказывало оптимизирующее действие на процессы интерлейкинзависимой клеточной кооперации, нормализуя уровень МИФ, соотношение провоспалительных (ФНО-α, IL-1β, IL-8) и противовоспалительных (IL-10) цитокинов.
Терапия экстрактом из культуры термофильного штамма золотистого стафилококка направлена на нормализацию процессов естественной цитотоксичности (уменьшение цитотоксического индекса с 73,4±9,9% до 41,4±3,3% при норме 41,4±3,3%), снижение продукции оксида азота (с 33,5±2,8 мкмоль/л до 19,7±1,5 мкмоль/л при норме 18,9±1,5 мкмоль/л) и повышение сывороточных концентраций растворимых антигенов ICAM-1и ICAM-3 (с sCD50 211,3±35,9 U/мл до sCD50 230,6±41,8 U/мл при норме 233,2±36,1 U/мл, соответственно sCD54 - 31,2±3,5 U/мл - sCD54 до 38,4±7,7 U/мл при норме 35,4±3,6 U/мл).
Патогенетически обоснованный метод лечения, включающий применение экстракта из культуры термофильного штамма золотистого стафилококка, отличается высокой кинической эффективностью, позволяя быстро и полностью купировать клинические проявления, в 79 % случаев вызывая клиническое излечение.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ.
Для определения тактики лечебных мероприятий и прогноза заболевания рекомендуется учитывать характеристику триггерных факторов, частоту и длительность рецидивов токсидермии, а также результаты исследования цитокиновой системы и иммунологических тестов к активационным маркерам иммунокомпетентных клеток.
Выявленная высокая клиническая эффективность экстракта из культуры термофильного штамма золотистого стафилококка позволяет рекомендовать данный вид терапии при различных клинических вариантах течения токсидермии.
В процессе лечения экстрактом из культуры термофильного штамма золотистого стафилококка больных токсидемией рекомендуется мониторинг состояния цитокинового профиля и естественной цитотоксичности.
Список литературы:
Агаджанян A.A. Клинико-гистологическая диагностика и лечение лекарственных поражений слизистой оболочки полости рта: автореф. дис. ... канд. мед. наук / А.А.Агаджанян. - М., 1987. - 24 с.
Андрианов П.Н. Лекарственная аллергия в полости рта после приема тетрациклина, фепранола, энтеросептола / П.Н.Андрианов, Н.Н.Сторожева, И.М.Любомирова // Теория и практика стоматологии. - М., 1980. - С. 5-8.
Антоньев A.A. К вопросу о взаимоотношении МЭЭ, синдромов Стивенса- Джонсона и ТЭН (синдром Лайелла) / А.А.Антоньев, В.Н.Шеварова // Вестник дерматологии и венерологии. - 1971. - № 7. - С. 29- 30.
Арефьев Ю.Л. Случай синдрома Лайелла / Ю.Л.Арефьев, В.А.Кармилов // Вестник дерматологии и венерологии. - 1980. - № 3. — С. 53-54.
Архангельская Е.И. Аутоиммунные нарушения при токсическом эпидермальном некролизе (синдром Лайелла) и их коррекция под влиянием комплексной терапии / Архангельская Е.И. , Т.В.Грибанова // Тез. докл. VI Всерос. Съезда дерматологов и венерологов, 25-26 сент., Челябинск. - М., 1989. - С. 407-408.
Бабаянц P.C. Кожные и венерические болезни жарких стран /
Р.С.Бабаянц. — М., 1984.-383 с.
Байтугаева Г.А. Лечение больных с синдромом Лайелла в условиях отделения реанимации и гравитационной хирургии крови / Г.А.Байтугаева, С.А.Полянский, Ю.П.Василенко // Сб. науч. тр. Пленума по проблемам скорой медицинской помощи, Омск, 20-22 дек. - М., 2000. - С. 457-460.
Балабян A.A. Синдром Лайелла / А.А.Балабян, М.В.Рогачев // Тр. Ленингр. науч. общ-ва патологоанатомов. - Л., 1984. - Вып. 25. - С. 48-49.
Банченко Г.В. Сочетанные поражения слизистой оболочки полости рта и кожи: атлас / Г.В.Банченко, С.С.Кряжева. - М.: Партнер, 1994. - 155 с.
Банченко Г.В. Физические методы лечения заболеваний слизистой оболочки полости рта / Г.В.Банченко, Н.В.Терехова, А.П.Безрукова // Актуальные вопросы рентгенологии, физиотерапии и функциональной диагностики в стоматологии: тр. ЦНИИС. — М., 1988.-Т. 19.-С. 51-53.
Бекетов A.M. О патогенезе токсикодермий / А.М.Бекетов, В.И.Прохоренков, М.В.Шапран // Вестник дерматологии и венерологии. - 1999. - № 6. — С. 23-25.
Белов A.C. Случай синдрома Стивенса-Джонсона / А.С.Белов, С.З.Витенчук // Вестник дерматологии и венерологии. - 1980. - № 6. - С. 59- 60.
Белявичене Т.Р. Токсический эпидермальный некролиз (синдром Лайелла) / Т.Р.Белявичене // Вестник дерматологии и венерологии. — 1977. -
№ 6. - С. 74-77.
Боровский Е.В. Атлас заболеваний слизистой оболочки полости рта /
Е.В.Боровский, Н.Ф.Данилевский. - М., 1981.-287 с.
Боровский Е.В. Заболевания слизистой оболочки полости рта /
Е.В.Боровский, А.Л.Машкиллейсон.-М., 1984.-С. 109-111.
Бородай Я.А. Клинико-иммунологические особенности аллергических дерматозов / Я.А.Бородай // Вестник дерматологии и венерологии. - 1998. - № 6. - С. 20-22.
Браиловский A.JI. По поводу статьи А.А.Каламкаряна и В.А.Самсонова «О МЭЭ, синдроме Стивенса-Джонсона ТЭН (синдром Лайелла) и их взаимоотношениях / А.Л.Браиловский // Вестник дерматологии и венерологии. — 1980. - № 11. — С. 29-31.
Бухарович М.Н. Некоторые аспекты взаимоотношений МЭЭ, ССД и Лайелла / М.Н.Бухарович // Вестник дерматологии и венерологии. — 1980. -
№ 9. — С. 33-34.
Вахрина И.А. Синдром Лайелла в стоматологической практике / И.А.Вахрина, М.А.Вахрин // Актуальные вопросы стоматологии: сб. ст. - Алма-Ата, 1989. - С. 97-98.
Воробьёв A.A. Иммуномодуляторы: принципы классификации и стратегии применения в медицине // Вест. РАМН. 2002. - №4. - С. 3-6.
Вульф К., Р. Джонсон, Д. Сюрмонд. Дерматология по Томасу Фицпатрику. Атлас- справочник// -М. -2007. С.- 636- 641.
Габдрахманова Ф.С. Случай синдрома Стивенса-Джонсона /
Ф.С.Габдрахманова. -Куйбышев, 1984.
Ганджа И.М. Коллагеновые болезни / И.М.Ганджа, В.М.Сахарчук. -
Киев, 1978. - 215 с.
Гасимов Ф.Г. Клиника и лечение острых форм стоматитов: лекция для врачей- курсантов / Ф.Г.Гасимов, В.Ю.Хитров, С.А.Хамидуллина. - Л., 1984. - 33 с.
Гаухман В.Д. Особенности синдрома Лайелла у детей первого года жизни / В.Д.Гаухман // Вестник дерматологии и венерологии. - 1986. - № 5. - С. 44-47.
Голик В.П. Реабилитация больных с острыми язвенными поражениями слизистой оболочки полости рта с учетом показателей резистентности организма / В.П.Голик, В.Ткаченко, Л.В.Воропаева // Актуальные вопросы реабилитации в стоматологии: тр. ЦНИИС. - М„ 1986. - Т. 16. - С. 48-49.
Голосова А.И. Случай синдрома Стивенса-Джонсона / А.И.Голосова, Е.В.Ашетова// Оказание медицинской помощи: тез. докл. - Владивосток, 1986. — С. 58-60.
Грибанова Т.В. Медикаментозные и профессиональные токсикодермии: автореф. дис. ... канд. мед. наук / Т.В.Грибанова. - Л., 1986. - 19 с.\
Гусаренко Л.А. Случай синдрома Стивенса-Джонсона, развившегося вслед за двумя абортивными атаками МЭЭ / Л.А.Гусаренко // Российский журнал кожных и венерических болезней. - 1998. - № 3. - С. 63-66.
Дубяга А.Н. Вопросы этиологии, патогенеза и лечения синдрома Лайелла / А.И.Дубяга, Е.П.Широковская, Л.Я.Шумилова // Советская медицина. - 1981. - № 7. - С. 117-219.
Дяченко Ю.В. Парадоксы стафилококковой инфекции в стоматологии
/ Ю.В.Дяченко // Стоматология. - 1999. - Т. 78, № 1. - С. 25-27.
Забелина H.A. Скорость слюноотделения и некоторые параметры ротовой жидкости у детей, больных аллергодерматозами / Н.А.Забелина // Современная стоматология. — 2000.-№ 1.-С. 32-33.
Заверная A.M. Реабилитация больных аллергическими поражениями слизистой оболочки полости рта / А.М.Заверная // Кратк. тез. V съезда стоматологов УССР. — Киев, 1978. - С. 118-119.
Заря Ж.Г. Случай синдрома Лайелла / Ж.Г.Заря, Я.В.Подольская, Т.Г.Кабакова // Астана медициналык журналы. - 2000. - № 2. - С. 134-135.
Зубков М.Н. Бактериальные инфекции кожи и подлежащих тканей: выбор антибиотикотерапии // Consilium medicum. 2001. - Т. 3. - №4. - С. 166- 172.
Иванов О. Л. Справочник Кожные и венерические болезни. -М., 2007,
-С. 270-271.
Иванов О. Л. Справочник Кожные и венерические болезни. -М., 2007,
-С.131-133
Иванов О. Л. Справочник Кожные и венерические болезни. -М., 2007,
-С.268-269.
Ильина Н.И., Латышева Т.В., Пинегин Б.В., Сетдикова Н.Х. Синдром вторичной иммунной недостаточности (протоколы диагностики и лечения) // Иммунология. 2000. - №5. - С. 8-9.
Инструкция по применению рузама,1995.
Исакова Т.И. Диагностика и коррекция лечения поражений слизистой полости рта у детей при пищевой и лекарственной аллергии: автореф. дис. ... канд. мед. наук / Т.И.Исакова. - Полтава, 1992. - С. 20.
Каламкарян A.A. О многоформной экссудативной эритеме, синдроме Стивенса- Джонсона, токсическом эпидермальном некролизе (синдроме Лайелла) и их взаимоотношениях / А.А.Каламкарян, В.А.Самсонов // Вестник дерматологии и венерологии. - 1980. - № 3. - С. 36-42.
Ковалев И.Е., Щипулина Н.В. Ковалентное связывание ксенобиотиков с белками организма как механизм адаптации. //Хим-фарм. журн. -1996 -Т.30,
№11. -С. 3-12.
Ковалева В. Л. Методические указания по изучению фармакологических веществ, предназначенных для терапии бронхиальной астмы и других обструктивных заболеваний дыхательных путей// Руководство по экспериментальномудополнительному (доклиническому) изучению новых фармакологических веществ. -М. -2000.
Колганова Н. А. Бронхиальная астма и мультисистемные проявления атопии. Новые терапевтические подходы. Автореферат докторской диссертации, Москва, 2001.
Колганова Н. А. Диссертация на соискание ученой степени доктора медицинских наук; Осипова Г. Л. Российский медицинский журнал. -2002. - М. №5. -С. 278-282.
Колесник К.А. Лечение токсико-аллергического стоматита с использованием им- муномодуляторов / К.А.Колесник // Вестник стоматологии. - 1998. - № 3. - С. 13-16.
Коновалова М.В. Многоформная экссудативная эритема: обзор литературы / М.В.Коновалова, В.Н.Гребенюк // Вестник дерматологии и венерологии. - 1992. - № 3. —
Кормейн Р.Х. Иммунология и болезни кожи: пер. с англ. /
Р.Х.Кормейн, С.С.Асгар. - М.: Медицина, 1983. - 255 с.
Королев Ю.Ф. К вопросу о МЭЭ, синдрома Стивенса-Джонсона и синдрома Лайелла и их взаимосвязь / Ю.Ф.Королев // Вестник дерматологии и венерологии. - 1981. - № 8.-С. 44-46.
Королев Ю.Ф. К вопросу об этиологии, патогенезе, клинике и лечении синдрома Стивенса-Джонсона / Ю.Ф.Королев // Вестник дерматологии. — 1975. - № 11. - С. 23.
Королев Ю.Ф. Медикаментозные токсикодермии / Ю.Ф.Королев, Л.Ф.Пильтиенко. - Минск: Беларусь, 1978. - С. 142.
Королев Ю.Ф. Синдром Лайелла / Ю.Ф.Королев // Здравоохранение Белоруссии. -1975 -11.-С. 73-75.
Королева Г.Н. Случай МЭЭ в практике врача-педиатра скорой медицинской помощи на догоспитальном этапе / Г.Н.Королева // Актуальные вопросы клинической медицины: материалы краев, науч. - практ. конф. - Комсомольск н/Амуре, 1998. - С. 301-302
Кузнецова Л.П. Случай синдрома Стивенса-Джонсона / Л.П.Кузнецова
// Вестник венерологии и дерматологии. - 1980. - № 11. - С. 41-42.
Лайбер Б. Клинические синдромы / Б.Лайбер, Г.Ольбрих. - М.: Медицина, 1974. - С. 477.
Латышева Т.В. Острые токсико-аллергические реакции на медикаменты (клинико-иммунологические и аллергологические характеристики, лечение и профилактика): автореф. дис. канд. мед. наук/ Т.В.Латышева. -М., 1990.
Лебедев К.А., Понякина И.Д. Иммунная недостаточность (выявление и лечение). Нижний Новгород: НГМА, 2003. - С. 443.
Лелис И.И. Стафилококковый и токсический синдромы «обожженной кожи» / И.И.Лелис // Вестник дерматологии и венерологии. - 1984. - № 10. - С. 117-149.
Лошкарев В.П. О клиническом течении МЭЭ и синдрома Стивенса- Джонсона / В.П.Лошкарев, З.В.Юдина // Актуальные вопросы научно- практической медицины. - материалы межобл. науч. конф., посвящ. 215- летию основания Орловской больницы. - Орел, 1997.-С. 208-209.
Лусс Л.В. Роль аллергии и псевдоаллергии в формировании аллергических заболеваний кожи / Л.В.Лусс // Аллергология. - 2000. - № 3. - С. 29-33.
Майчук Ю.Ф. Хронические аллергические конъюнктивиты /
Ю.Ф.Майчук // Лечащий врач. - 2001. - № 4. - С. 38-41.
Молочков В.А. Синдром Роуэлла / В.А.Молочков, И.Е.Шахнес, Н.Н.Катунцева // Российский журнал кожных и венерических болезней. - 2000. - № 2. - С. 21-23.
Наковкин О.Н. Клинический опыт применения синдрома Пентаглобулина при синдроме Лайелла у грудного ребенка / О.Н.Наковкин, В.С.Сорокин // Педиатрия. — 2000. -№ 1.-С. 69.
Нишнианидзе П.Г. К вопросу синдрома Лайелла / П.Г.Нишнианидзе, О.А.Коридзе, Т.В.Кацитадзе // Материалы VIII съезда терапевтов Грузии, 26- 28 окт. - Тбилиси, 1988. - С. 392-393.
Новикова Р.И. Гемосорбция в интенсивной терапии синдрома Лайелла / Р.И.Новикова, В.П.Шано, О.Н.Хмель// Современные проблемы анестезиологии, реаниматологии и интенсивной терапии: тез. VII респ. науч.
практ. конф. анестезиологов - реаниматологов Казахстана, Алма-Ата. -
Чимкент, 1989. - С. 256-258.
Овруцкий Г.Д. Введение в клинику заболеваний слизистой оболочки полости рта / Г.Д.Овруцкий, Н.А.Горячев. - Казань, 1990. - С. 104.
Овруцкий Г.Д. Клиника терапевтической стоматологии: руководство /
Г.Д.Овруцкий, Н.А.Горячев, Ю.Ф.Майоров. - Казань, 1991. - С. 239.
Островерхов Г.Е. Принципы патологической терапии печеночной недостаточности / Г.Е.Островерхов // Патогенез и методы лечения печеночной недостаточности. — М., 1979.-С. 3-8.
Панов В.Г. Эффективность тиосульфата натрия при лечении больных с лекарственной токсикодермией / В.Г.Панов, Л.Н.Панова // Избранные вопросы военной медицины: сб. науч. и науч. - практ. работ проф. —
преподав, состава воен. - мед. фак-та и врачей 432 гл. воен. клин. госп. -
Минск, 2000. - С. 64-66.
Пашков Б.М. Поражения слизистой оболочки полости рта и губ при некоторых дерматозах и сифилисе / Б.М.Пашков, Б.Г.Стоянов, А.Л.Машкилейсон. - М., 1970. - С. 156.
Поздняков A.M. Программа неотложной терапии при синдроме Лайелла у детей первого года жизни / А.М.Поздняков, В.З.Сидорова // Диагностика и комплексное лечение неотложных состояний и пороков развития у детей: сб. науч. тр. - Воронеж, 1988. - С. 2731.
Попадинец В.А. Случай синдрома Стивенса-Джонсона / В.А.Попадинец // Вестник дерматологии и венерологии. - 1992. - № 1. - С. 49- 50.
Попова Л.В. К этиологии, патогенезу и лечению МЭЭ: дис. канд. мед. наук / Л.В.Попова.-Воронеж, 1975.
Прибылова H.H. Применение гемосорбции в комплексном лечении больных с синдромом Лайелла / Н.Н.Прибылова, С.С.Рудь, Г.С.Кротова // Клиническая медицина. - 1985.-№6.-С. 121-123.
Пухлик Б.М. Лекарственная аллергия / Б.М.Пухлик. — Киев: Здоровья, 1989. - С. 95.
Ратникова Л.И. Новые аспекты фармакокоррекции иммунодепрессий инфекционного генеза: автореф. дис. . д-ра мед. наук. М., 1989. - С. 38.
Родионов А.Н. Справочник по кожным и венерическим болезням /
А.Н.Родионов. -СПб., 1999. - С. 247.
Рубинов Л.И. Лечение поражений слизистой оболочки полости рта у детей с учетом состояния местного иммунитета: автореф. дис. канд. мед. наук / Л.И.Рубинов. - Л., 1984. - С. 16.
Рыбаков А.И. Заболевания слизистой оболочки полости рта /
А.И.Рыбаков, Г.В.Банченко. - М., 1978. - С. 211.
Самгин M.А. Валтрекс в терапии больных МЭЭ, ассоциированной с
Herpes simplex / 2000. - № 2. - С. 34-36.
Самгин М.А., А.А.Халдин/ Российский журнал кожных и венерических болезней. - Слученкова Л.Д. Случай генерализованной формы герпетической инфекции, протекающей по типу синдрома Стивенса-Джонсона / Л.Д.Слученкова, А.А.Соловьева, Л.Н.Оксамитная // Педиатрия. - 1993. - № 1.
- С. 90-91.
Самцов В.И. Замечания по поводу острого эпидермального некролиза / В.И.Самцов, И.И.Подвысоцкая, Н.Д.Лисовская // Вестник дерматологии и венерологии. — 1980.-№ 11.-С. 31-33.
Сафиуллина A.M. Развитие транзисторных бактериемий после стоматологических вмешательств у больных с различным состоянием иммунной системы: автореф. дис. канд. мед. наук / А.М.Сафиуллина. - Казань, 1996. - С. 18.
Симочкина З.А. Случай синдрома Лайелла / З.А.Симочкина, Л.А.Великая, В.А.Михайлова // Врачебное дело. - 1989. - № 10. - С. 91-92.
Сирота Г.И. Профилактика неспецифических острых язвенных поражений слизистой оболочки полости рта / Г.И.Сирота // Проблемы стоматологии. - Ташкент, 1971. - Т. 2. - С. 96-98.
Скрипкин Ю.К. Аллергические дерматозы / Ю.К.Скрипкин, Б.А.Сомов, Ю.С.Бутов. - М.: Медицина, 1975. - С. 246.
Смирнова Г.Д. Киника, диагностика и лечения МЭЭ: учеб. пособие
/ЦИУВ. - М., 1986. - С. 26.
Смирнова Г.И. Современные технологии лечения тяжелых форм аллергодермато- зов у детей / Г.И.Смирнова // Вопросы современной педиатрии. - 2002. - Т. 1, № 3. - С. 66-72.
Солошенко Э.Н. О взаимосвязи многогранной экссудативной эритемы, синдромов Лайелла и Стивенса-Джонсона / Э.Н.Солошенко // Вестник дерматологии и венерологии. -1981.-№7.-С. 30-32.
Солошенко Э.Н. Современные подходы к профилактике лекарственной болезни / Э.Н.Солошенко //Международный медицинский журнал. -2001. - № 1. - С. 114-118.
Ставрова H.A. Два случая синдрома Стивенса-Джонсона/ Н.А.Ставрова
// Стоматология. - 1971. - № 2. - С. 93-94.
Тарасенко Г.Н. О синдроме Лайелла на прием фурациллина/ Г.Н.Тарасенко, В.Н.Терещенко, Н.А.Солнцева // Тез. докл. девятого Всесоюз. съезда дерматовенерологов, Алма-Ата, 23-27 сент. М., 1991. — С. 343.
Уджуху В. Ю. Новый взгляд на классификацию и патогенез лекарственной токсидермии/ Уджуху В. Ю. , Н. Г. Короткий, Т. В. Грязнова
// Российский журнал кожных и венерических болезней. -М. -1999. -С. 20-23.
Утц Н.В. Лечение больных с синдромом Лайелла в условиях отделения реанимации и интенсивной терапии / Н.В.Утц, А.А.Любченко, A.A.Светоч // Вестник интенсивной терапии. - 1994. - № 2. - С. 14-15.
Федоров С.М. Иммунные механизмы развития аллергических дерматозов / С.М.Федоров, А.Н.Гура // Вестник дерматологии и венерологии.
- 1999. - № 6. - С. 11-16.
Федорович C.B. Пищевая аллергия по типу синдрома Стивенса- Джонсона / С.В.Федорович, Б.Т.Виленчик, В.А.Нафранович // Патогенез и терапия кожных и венерических заболеваний: тез. докл. Второго съезда дерматологов и венерологов респ. Беларусь, г. Могилев, 1-2 окт. - Минск, 1992. - С. 180-182.
Федорович C.B. Синдромы Лайелла и Стивенса-Джонсона /
С.В.Федорович // Здравоохранение Беларуси. - 1993. - № 11. - С. 62-64.
Федорович C.B. Судебно-медицинские аспекты лекарственной аллергии в дерматологической практике / С.В.Федорович // Патогенез и терапия кожных и венерических заболеваний: тез. докл. - Минск, 1992. - С. 63-65.
Хазанова В.В. Микробная флора полости рта при клинических и экспериментальных стоматитах / В.В.Хазанова // Аутофлора здорового и больного организма. - Таллин, 1972.-С. 107.
Химкина Л.Н. Иммунологические реакции при синдроме Лайелла / Л.Н.Химкина // Тез. докл. V Всерос. съезда дерматологов и венерологов. - Владимир, 1983. - С. 197.
Хорошилова Н.В., Борисова A.M., Сетдикова Н.Х., Лактионова Л.В. Современные тенденции в иммунокоррегирующей терапии // Imm.unorehabilitation. 1998. - №8. - С. 5.
Цветкова Г.М. Патоморфологическая диагностика заболеваний кожи /
Г.М.Цветкова, В.Н.Мордовцев. - М., 1986. - С. 195.
Циснецкая A.B. Диссеминированное внутрисосудистое свертывание при синдромах Лайелла и Стивенса-Джонсона / А.В.Циснецкая, Л.Л.Лукасевич // Вестник дерматологии и венерологии. - 1990. - С. 12.
Чеботарев К.С. Острый эпидермальный некролиз (синдром Лайелла) у больной аутоиммунным тиреоидитом / К.С.Чеботарев, Н.И.Полянко, Ю.И.Кунаков // Вестник дерматологии и венерологии. - 1989. - № 8. - С. 56- 58.
Чобан М.А. Случай лекарственной аллергии с буллезным дерматитом по типу синдрома Лайелла / М.А.Чобан, Е.Г.Негряце // Актуальные вопросы теоретической и клинической медицины: сб. науч. работ сотр. и студ. ин-та. - Куйбышев, 1989. - С. 354.
Чучалин А.Г. Экстракорпоральная специфическая иммуносорбция в комплексной терапии у больных бронхиальной астмой с гиперчувствительностью к аллергену из домашней пыли / А.Г.Чучалин, Л.А.Раудла, А.Р.Татарский // Терапевтический архив. - 1984. -Т. LVI, № 6. - С. 24-27.
Чучалин А.Г., Ковалева В.Л., Колганова Н.А. Рузам-новый подход в лечении и профилактике аллергических заболеваний (экспериментальные и клинические данные). Российский Медицинский Журна. -2003. - №22. - С.- 1248-1252.
Шакиров P.P. Случай синдрома Стивенса-Джо неона / Р.Р.Шакиров, Л.Л.Свищев // Вестник дерматологии и венерологии. - 1981. - № 6. - С. 58.
Шевченко A.M. К вопросу о синдроме Лайелла / А.М.Шевченко, Г.И.Гарюк, В.Т.Лисовец // Вестник оториноларингологии. - 1990. - № 3. - С. 68-69.
Шелюженко A.A. Кожные болезни у лиц пожилого и старческого возраста / А.А.Шелюженко, А.Я.Браиловский. - Киев: Здоровья, 1982. - 198 с.
Шкоба Я.В. Синдром Лайелла / Я.В.Шкоба, Л.Д.Заводий, М.А.Мельник
// Журнал ушных, носовых и горловых болезней. - 1990. - № 4. - С. 63-65.
Шумский А.В. Лимфотропная медикаментозная и иммунокорригирующая терапия в комплексном лечении инфекционно- воспалительных заболеваний слизистой оболочки полости рта: дис. д-ра мед. наук / А.В.Шумский. - Самара, 1998. - С. 264.
Юлдашев У.И. О синдромах Лайелла и Стивенса-Джонсона/ У.И.Юлдашев, Е.Ш.Дымерец // Клиническая медицина. - 1978. - Т. 56, № 5. - С. 126-130.
Яговдик Н.З. Токсикодермия в результате применения серой ртутной мази / Н.З.Яговдик, М.В.Кальчук // Здравоохранение. - 1996. - № 4. - С. 50-51. Almeuda J. Drug. Reactions. XII. Cutaneous reactions to antiryeumatic drugs / J.Almeuda, H.Backer // Brit. J. Derm. - 1970. - Vol. 83, N 6. - P. 707-711.
Asghar Butt S. Monitoring mammary tumor progression and effect of tamoxifen treatment in MMTV-PymT using MRI and magnetic resonance spectroscopy with hyperpolarized [1-13 C]pyruvate./ Asghar Butt S, Søgaard LV, Ardenkjaer-Larsen JH, Lauritzen MH, Engelholm LH, Paulson OB, Mirza O, Holck S, Magnusson P, Akeson P.// Magn Reson Med. 2014 Jan 16.
Ayangco L. Oral manifestations of erythema multiforme / L.Ayangco, R.S.Rogers // Dermatol. Clin.-2003.-Vol. 21, N l.-P. 195-205.
Bachot N. Differential diagnosis of severe cutaneous drug eruptions / N.Bachot, J.C.Roujeau// Amer. J. Clin. Dermatol. - 2003. - Vol. 4, N 8. - P. 561- 572.
Barbaud A. The use of skin testing in the investigetion of toxidermia: from patophisiology to the results of skin testing /Barbaud A//Theraie. 2002 May-Jun: 57(3):258-62.
Barrett A.W. Erythema multiforme involving gingival / A.W.Barrett, C.M.Scully, J.W.Eveson // J. Periodontol. - 1993. - Vol. 64, N 9. - P. 910-913.
Beare M. Toxic epidermal necrolysis / M.Beare // Arch. Derm. - 1962. - Vol. 86, N 5. - P.638-653.
Beauquier B. Secondary dermatologic effects of serotonin reuptake inhibitor antidepressants: hypothesis of cross reacting allergy. Apropos of 2 cases.
/Beauquier B., Fahs H.// Encephale. 1998 Jan-Feb; 24(1):62-4.
Beltrani V.S. Counterpoint to the use of systemic corticosteroids in the Stevens-Johnson syndrome / V.S.Beltrani // Ann. Allergy Asthma Immunol. - 2000. - Vol. 85, N 5. - P. 422-423.
Bhatia R.S. Stevens-Johnson syndrome following a single dose of ciprofloxacin / R.S.Bhatia // J. Assoc. Physicians India. - 1994. - Vol. 42, N 4. - P. 344.
Brand R. Toxic epidermal necrolysis in Western Australia / R.Brand, J.B.Rohr // Aus- tralas J. Dermatol. - 2000. - Vol. 41, N 1. - P. 31-33.
Burrell C. Impact of a pharmacist-driven protocol to improve drug allergy documentation at a university hospital./ Burrell C., Tsourounis C., Quan D., Jue V., Tam E., Guglielmo BJ.// Hosp Pharm. 2013 Apr;48(4):302-7.
127. C.Huff// Am. Acad. Dermatol. - 1998.-Vol. 18, N 1, Pt. 2. - P. 197-199.
Carrozzo M. Erythema multiforme. A heterogenous pathologic phenotype / M.Carrozzo, M.Togliatto, S.Granddolfo // Minerva Stomatol. - 1999. - Vol. 48, N 5. - P. 217-226.
Caster O. Methylprednisolone-induced hepatotoxicity: experiences from global adverse drug reaction surveillance./ Caster O, Conforti A, Viola E, Edwards IR.// Eur J Clin Pharmacol. 2014 Jan 3.
Cataldo E. Pyostomatitis Vegetans / E.Cataldo, M.C.Covino, P.E.Tesone // Oral. Surg. -P 342-353.
Chosidow O. Drug-induced exanthemas / O. Chosidow // Rev. Prat. - 2000.
- Vol. 50, N 12. -P. 1310-1313.
Christen H.-J. Das staphylogene Lyell syndrome im Kindesalter / H.- J.Chisten, K.Heyne // Padiatr. Prax. - 1984. - Vol. 30, N 1. - P. 79-83.
Cisse M. Toxidermia during antiretroviral therapy in Conakry, Guinea./ Cisse M, So N, Keita M, Soumah MM, Camara A.// Med Trop (Mars). 2008 Apr; 68(2):203.
Cohen D.M. CinnamonOinduced oral erythema multiforme like sensitivity reaction / D.M.Cohen, J.Bhattacharyya // J. Amer. Dent. Assoc. - 2000. - Vol. 131, N 7. - P. 929-934.
Daveluy A. Fluindione and drug reaction with eosinophilia and sistemic symptoms: an unrecognised adverse effect /Daveluy A., Milpied B., Barbaud A., Lebrun-Vignes B., Gourfud A., Laroche ML., Ciobanu E., Begaud B., Moore N., Miremont-Salame G., Haramburu F.// Eur J Clin Farmacol. 2012 Jan; 68(1):101-5.
Dawe S. Toxic epidermal necrolysis complicated by delayed by delayed mucosal healing and haemorrhage mucositis / S.Dawe, R.Bentley, D.Creamer // Clin. Exp. Dermatol. — 2003. -Vol. 28, N4.-P. 454-455.
Demoulin N. Intraperitoneal urokinase and oral rifampicin for persisting asymptomatic dialysate infection following acute coagulase-negative staphylococcus peritonitis./ Demoulin N, Goffin E.// Perit Dial Int. 2009 Sep- Oct;29(5):548-53.
Deshpande RP. Adverse drug reaction profile of anti-snake venom in a rural tertiary care teaching hospital./ Deshpande RP, Motghare VM, Padwal SL, Pore RR, Bhamare CG, Deshmukh VS, Pise HN.// J Young Pharm. 2013 Jun;5(2):41-5.
Dobson C.M. Adult staphylococcal scalded skin syndrome: histological pitfalls and new diagnostic perspectives / C.M.Dobson, C.M.King // Br. J. Dermatol. - 2003. - Vol. 148, N 5. - P. 1068-1069.
Douros A. Flupirtine-induced liver injury-Seven cases from the Berlin Case-control Surveillance Study and review of the German spontaneous adverse drug reaction reporting database./ Douros A, Bronder E, Andersohn F, Klimpel A,
Thomae M, Orzechowski HD, Kreutz R, Garbe E.// Eur J Clin Pharmacol. 2013 Dec 24.
Eversol L.R. Immunopathology of oral mucosal ulcerative, olesquamative and bullons diseases. Selective review of the literature / L.R.Eversole // Oral Surg. Oral Med. Oral Pathol. - 1994. - Vol. 77, N 6. - P. 555-571
Fekih L. Hypersensitivity reactions to antituberculous therapy./ Fekih L, Fenniche S, Boussoffara L, Hassene H, Abdelghaffar H, Belhabib D, Megdiche Mohamed L.// Rev Mal Respir. 2010 Sep; 27(7):673-8.
Fontana RJ. Pathogenesis of Idiosyncratic Drug-Induced Liver Injury and Clinical Perspectives/ Fontana RJ.// Gastroenterology. 2013 Dec 31.
Galcin B. Stevens-Johnson syndrome associated with concomitant use of lamatrigine and valproic acid / B.Galcin, A.Karaduman // J. Am. Acad. Dermatol. - 2000. - Vol. 43, N 5, Pt. 2.-P. 898-899.
Gioglio P. Toxic epidermal necrolysis due to administration of celecoxib (Celebrex) / P.Giglio // South Med. J. - 2003. - Vol. 96, N 3. - P. 320-321
Gonski P.N. Stevens-Johnson syndrome induced by verapamil / P.N.Gonski
// Med. J. Australia. - 1992. - Vol. 156, N 4. - P. 672.
Goombs R.R.A. Classification of allergic reactions responsible for clinical hypersensitivity and disease / R.R.A.Goombs, P.Y.H.Gell // Clinical aspects immunology / ed. P.Y.H.Gell. -Oxford, 1975.-P. 761-781.
Hebert A.A. Intravenous immunoglobulin prophylaxis for recurrent Stevens-Jphnson syndrome / A.A.Hebert, M.A.Bogle // J. Am. Acad. Dermatol. - 2004. - Vol. 50, N 2. - P. 286-288.
Heelan K1. Wells syndrome (eosinophilic cellulitis): Proposed diagnostic
criteria and a literature review of the drug-induced variant./ Heelan K, Ryan JF, Shear NH, Egan CA.// J Dermatol Case Rep. 2013 Dec 30;7(4):113-20.
Hockett K.C. Stevens-Johnson syndrome and toxic epidermal necrolysis: on considerations / K.C.Hockett // Clin. J. Oncol. Nurs. - 2004. - Vol. 8, N 1. - P. 27- 30.
Horowitz S.B. Thalldomide-induced toxic epidermal necrolysis / S.B.Horowitz, A.L.Stirling // Pharmacotherapy. - 1999. - Vol. 19, N 10. - P. 1177- 1180.
Jiang J. Ruthenium(II)/Chiral Brønsted Acid Co-Catalyzed Enantioselective Four-Component Reaction/Cascade Aza-Michael Addition for Efficient Construction of 1,3,4-Tetrasubstituted Tetrahydroisoquinolines./ Jiang J, Ma X, Ji C, Guo Z, Shi T, Liu S, Hu W.// Chemistry. 2014 Jan 16.
Jongen-Lavrencic M. Ciprofloxacin-induced toxic epidermal necrolysis in a patient with systemic lupus erythematosus / MJongen-Lavrencic, P.M.Schneeberger, J.G.van der Hoeven // Infection. - 2003. - Vol. 31, N 6. - P. 428-429.
Kim , S. H., Lee, K. W., Song, W. J., Jee, Y. K., Lee, S. M., Kang, H. R.,
Park, S. H., Min, K. U. and Chang, Y. S.: Carbamazepine-induced severe cutaneous adverse reactions and hla genotypes in koreans. Epilepsy. Res., 97:190- 197, 2011.
Kleinhans D. Akute allergische kontaktstomatitis durch tetracain / D.Kleinhans, Th.Fuchs // Aktual. Dermatol. - 1983. - Bd. 9, N 6. - S. 241-242.
Koo E. In vitro methodica gyagiszerallergia diagnosisara / E.Koo // Borg. Vener. Izle. - 1971. - Vol. 47, N 3. -P. 122-124.
Kowalski B.J., Cody R.J. Stevens-Johnson syndrome associated with Carvedilol therapy / B.J.Kowalski, J.R.Cody // Amer. J. Cardiol. - 1997. - Vol. 80, N 5. - P. 669-670.
Legendre DP. Antibiotic Hypersensitivity Reactions and Approaches to Desensitization./ Legendre DP, Muzny CA, Marshall GD Jr, Swiatlo E.// Clin Infect Dis. 2013 Dec 23.
Ludwig C. Exudative erythema multiforme with transition to a toxic epidermal necrolysis after taking aceclofenac (Beofenac) / C.Ludwig, T.Brinkmeier, P.J.Frosch // Dtsch. Med. Wochenschr.-2003.-Bd. 128, N 10. - S. 487-490.
Majewski S. Etiopatogeneza stomatitis prothetica / S.Majewski // Postery Hig. Med. Dosw. - 1978. - Vol. 32, N 6. - P. 779-799.
Marrakchi H. Cutaneous manifestetions of AIDS. /Marrakchi H., Mokhtar I., Zarrouk H., Daghfous M., Kamoun MR.// Tunis Med. 1993 Mar; 71(3): 119-22.
Minciullo PL. Challenge test to bisphosphonates in patients with hypersensitivity reactions to drugs./ Minciullo PL, Allegra A, D'Angelo A, Musolino C, Gangemi S.// Allergol Immunopathol (Madr). 2014 Jan 7. pii: S0301- 0546(13)00283-8.
Nam YH. Drug reaction with eosinophilia and systemic symptoms syndrome is not uncommon and shows better clinical outcome than generally recognised./ Nam YH, Park MR, Nam HJ, Lee SK, Kim KH, Roh MS, Um SJ, Son CH.// Allergol Immunopathol (Madr). 2014 Jan 2.
Nedler A. Nystepowanie wrzodziejacogo zapalenia dziasel i blony sluzowej jamy ustnej u chjruch zoznej leci, wieku I w rosnych porach roku / A.Nedler // Czas. Stomat. - 1972. - Vol. 25, N 10.-P. 1027-1031.
Onteniente S. Palifermin in the preventive treatment of oral mucositis in autograft patients: data on efficacy and tolerance following marketing approval./ Onteniente S, Coullet V, Chemelle M, Lafont I, Pernot C, Guignard MH.// Therapie. 2008 Jan-Feb;63(1):37-42.
Ozeki, T., Mushiroda, T., Yowang, L., Takahashi, A., Kubo, M., Shirakata, Y., Ikezawa, Z., Lijima, M., Shiohara, T., Hashimoto, K., Kamatani, N. and Nakamura, Y.: Genome-wide association study identifies hla-a*3101 allele as a genetic risk factor for carbamazepine-induced cutaneous adverse drug reactions in Japanese population. Hum. Mol. Genet., 20: 1034-1041 (2011).
Packard K. Antipsychotic Use and Risk of Rhabdomyolysis./ Packard K, Price P, Hanson A.// J Pharm Pract. 2014 Jan 15.
Paquet P. Differential pathomechanisms of epidermal necrolytic blistering diseases / P.Paquet, G.E.Pierard // Int. J. Mol. Med. - 2002. - Vol. 10, N 6. - P. 695-699.
Pevny I. Mundschleimhaut-Kontaktallergien / I.Pevny, A.Binzenhofer // Z. Hautkr. - 1984. - Bol. 59, N 4. - P. 245-251.
Prendiville J. Stevens-Johnson syndrome and toxic epidermal necrolysis / J.Prendiville //Adv. Dermatol.-2002.-Vol. 18.-P. 151-173.
Puchker N. Stevens-Johnson syndrome in India — risk factors ocular manifestations and management / N.Pushker, R.Tandon, R.B.Vajpayee // Ophtalmologica. - 2000. - Vol. 214, N 4. -P. 285-288.
Rajkumar S.V. Life-theratening toxic epidermal necrolysis with thalidomide therapy for myeloma / S.V.Rajkumar, M.A.Gertz, T.E.Witzig // N. Engl. J. Med. - 2000. - Vol. 343, N 13. - P. 972-973.
Revuz J. Should we stop using the term "toxidermia" in pathology reports? / Revuz J.// Ann Dermatol Venereol. 1999 Apr; 126(4):376-9.
Ringheanu M. Toxic epidermal necrolysis in children - an update / M.Ringheanu, T.A.Laude // Clin. Pediatr (Phila). - 2000. - Vol. 39, N 12. - P. 687- 694.
Roujeau J.C. Epidermic necrolysis: advances in pathogenesis / J.C.Roujeau
// Ann. Dermatol. Venerol. - 2000. - Vol. 127, N 5. - P. 546-547.
Saiag P. Syndrome de Lyell / P.Saiag, J.-C.Roujeau, R.Touraine // Rev. Prat (Paris). - 1988.-Vol. 38, N23.-P. 1617-1622.
Saka B. Fixed drug eruption in dermatology setting in Lome (Togo): a retrospective study of 321 cases. /Saka B., Kombate K., Medougoub BH., Akakpo S., Mouhari-Toure A., Boukari T., Tchangai- Walla K., Pitche P.// Bull Soc Patol Exot. 2012 Dec; 105 (5): 384-7.
Scheifekd N. Phenytoin in cutaneous medicine: its uses, mechanisms and side effects / N.Scheifeld // Dermatol. Online J. - 2003. - Vol. 9, N 3. - P. 6.
Schmutz JL.The first case of lasting pigmented toxidermia induced by cetirizine (Zyrtec, Virlix) and ticlopidine./ Schmutz JL., Barbaud A., Trechot P.// Ann Dermatol Venereol. 2002 Apr; 129(4 Pt 1):458.
Scully C. A review of common mucocutaneous disorders affecting the mouth and lips / C.Scully // Ann. Acad. Med. Singapore. - 1999. - Vol. 28, N 5. - P. 7047.
Silbermann M. Stevens-Johnson syndrome: report of a case with possible systemic reaction to acute alcoholism / M.Silbermann, C.H.Doku, P.L.Maloney // J. oral. Med. - 1973. - Vol. 28, N l.-P. 14-17.
Smith N. Acute Stomatitis Medicamentosa. Two Case Reports / N.Smith // Aust. Dent. J. - 1978. - Vol. 23, N 4. - P. 305-307.
Smoot E.C. Treatment issues in the care of patients with toxic epidermal necrolysis / E.C.Smoot // Burns. - 1999. - Vol. 25, N 5. - P. 439-442.
Syrigou E. Giant tuberculin reaction associated with the homeopathic drug Tuberculinum: a case report./ Syrigou E, Giozos I, Dannos I, Grapsa D, Tsimpoukis S, Syrigos K.// Clin Infect Dis. 2014 Jan 14.
Tham L.S. A prediction model to identify risk of developing Stevens- Johnson syndrome or toxic epidermal necrolysis in patients with erythema multiforme / L.S.Tham, P.A.Tambyah // Ann. Acad. Med. Singapore. - 2003. - Vol. 32, N 5. - P. 46-48.
Vaillant L. Mechanisms of cutaneous drug reactions / L.Vaillant // Rev. Prat.
- 2000. - Vol. 50, N 12.-P. 1294-1299.
Vauthey L. Vancomycin-induced DRESS syndrome in a female patient
/Vauthey L., Uckay I., Abrassart S., Bernard L., Assal M., Ferry T., Djordjevic M., Roussos C., Vaudaux P.// Pharmacology. 2008; 82(2): 138-41.
Williams D.A. Stevens-Johnson syndrome after erythromycin therapy while developed at sea / D.A.Williams // Mil. Med. - 2000. - Vol. 165, N 8. - P. 636-637.
Witkowski J.A. Cutaneous reactions to antibacterial agents / J.A.Witkowski, L.C.Parish // Skinmed. - 2002. - Vol. 1, N 1. - P. 33-44.
Wolkenstein P. Toxic epidermal necrolysis / P.Wolkenstein, J.Revuz // Dermatol. Clin. – 2012. – Vol. 3, N 15. – P. 68-71.
Wong K.C. Clinical manifestations and outcomes in 17 cases of Stevens- Johnson syndrome and toxic epidermal necrolysis / K.C.Wong, P.J.Kennedy, S.Lee // Australas J. Dermatol.1999. - Vol. 40, N3,-P. 131-134.
Yang, L., Chen, J. and He, L.: Harvesting candidate genes responsible for serious adverse drug reactions from a chemical - protein interactome. PLOS Comput. Biol., 5: e1000441 (2009),-P. 114-116.
