
- •Клинико-патогенетическое обоснование применения экстракта из культуры термофильного штамма золотистого стафилококка в комплексной терапии токсидермий
- •Глава 1. Обзор литературы
- •Глава 3. Клиническая характеристика больных
- •Глава 1. Обзор литературы.
- •Распространенность, классификация, клинические проявления токсидермии.
- •Современные подходы к лечению токсидермии.
- •Глава 2. Собственные методы исследования и лечения.
- •Методы исследования у больных токсидермией.
- •Методика лечения больных токсидермией.
- •Глава3. Клиническая характеристика больных токсидермией.
- •Глава 4. Динамика основных показателей иммунитета у больных токсдермией под воздействием экстракта из культуры термофильного штамма золотистого стафилококка.
- •Состояние регуляции иммунного ответа у больных токсидермией.
- •Влияние экстракта из культуры термофильного штамма золотистого стафилококка на иммунологические показатели у больных токсидермией.
- •Глава 5. Клиническая эффективность экстракта из культуры термофильного штамма золотистого стафиококка у больных токсидермией.
Глава 4. Динамика основных показателей иммунитета у больных токсдермией под воздействием экстракта из культуры термофильного штамма золотистого стафилококка.
Состояние регуляции иммунного ответа у больных токсидермией.
В настоящей главе представлены результаты изучения динамики изменений основных показателей врожденного и приобретенного иммунитета у больных токсидермией под действием экстракта из культуры термофильного штамма золотистого стафилококка.
Анализ цитокинового профиля позволял определить особенности нарушений цитокин - опосредованной регуляции гуморального иммунитета, характер клеточно-опосредованных реакций у больных токсидермией и влияние на эти показатели экстракта из культуры термофильного штамма золотистого стафилококка. Уровень цитокинов в сосудистом русле исследован у 35 больных токсидермией и у 20 здоровых доноров. Из данных представленных в таблице 9 и на рисунке 1 видно, что уровень в сосудистом русле ФНО-α у больных с токсидермией значительно превышал аналогичные референтные значения 21,3±2,1 пг/мл, достигая 85,6±3,8 пг/мл. Наиболее высокая концентрация ФНО -α выявлена у больных с островоспалительным процессом и значительной площадью поражения. Повышенное содержание ФНО-α оказывало стимулирующее влияние на процессы активации макрофагов, лимфоцитов, усиливало поступление активированных мононуклеаров в очаги воспаления.
Таблица 9
Уровень противовоспалительных цитокинов в сыворотке крови
больных токсидермией
Больные токсидермией |
Количество больных |
Уровни цитокинов (пг/мл) |
||
IL-1β |
IL1-PA |
ФНО-α |
||
35 |
28,1±2,4 |
186,3±16,3 |
85,6±3,8 |
|
Здоровые доноры |
20 |
24,5±2,3 |
125,9±15,5 |
21,3±2,1 |
Проведенные исследования показали, что на фоне статистически достоверного по сравнению с контролем (125,9±15,5 пг/мл) повышения концентрации в сыворотке крови рецепторного антагониста IL-1PA до 186,3±16,3 пг/мл, уровень IL-1β (28,1±2,4 пг/мл) лишь незначительно отличался от референтных значений 24,5±2,3 пг/мл. Можно предположить, что выявленный избыток IL-1RA предотвращал повышенное накопление в сосудистом русле IL-1β.

Рисунок 1. Уровень противовоспалительных цитокинов в сыворотке крови у больных токсидермией.
Проведенные иммунологические исследования позволили выявить у обследованных больных токсидермией значительное повышение по сравнению с референтными значениями типа (23,8±2,2 пг/мл) уровня в сосудистом русле гранулоцитарного колониестимулирующего фактора (Г- КСФ) до 96,4±8,5 пг/мл (Рис. 2). Гранулоцитарный колониестимулирующий фактор является основным гемопоэтическим фактором роста, который обеспечивает пролиферацию, дифференцировку и терминальное созревание миелоидных предшественников нейтрофильных гранулоцитов, а также стимулирует разнообразные функции зрелых нейтрофилов.
Таким образом, увеличение концентрации Г-КСФ может способствовать гиперактивации нейтрофильных лейкоцитов попадающих в кожу и вследствие этого поддерживать иммунное воспаление в дермо- эпидермальном пространстве больных токсидермией.

Рисунок 2. Уровень Г-КСФ в сыворотке крови у больных токсидермией
Концентрация в крови IL-8 (265,3±15,6 пг/мл) оказалась значительно повышенной по сравнению с аналогичными значениями у здоровых доноров (26,9±2,7 пг/мл) (табл. 10, Рис. 3).
Таблица 10
Уровень IL-8 в сыворотке крови больных токсидермией
Больные токсидермией |
Количество больных |
Уровни цитокинов (пг/мл) |
IL-8 |
||
30 |
265,3±15,6 |
|
Здоровые доноры |
20 |
26,9±2,7 |
Учитывая, что IL-8 обладает способностью индуцировать молекулы
адгезии, осуществляющие взаимодействие лейкоцитов и эндотелиальных клеток с последующим привлечением нейтрофилов и в меньшей степени макрофагов в зону воспаления, подъем уровня данного цитокина усиливал воспалительные изменения в дермо-эпидермальном пространстве.

Рисунок 3. Уровень IL-8 в сыворотке крови больных токсидермией.
Изучение количественного содержания IL-10, продуцируемого Т- хелперами как 1 так 2 типа, дало возможность объективной оценки состояния регуляторного звена иммунной системы у больных токсидермией.
Проведенные исследования показали, что у больных токсидермией выявляется статистически достоверное снижение уровня IL-10 до 6,9±1,6 пг/мл, при 13,2±2,3 пг/мл - у здоровых доноров (табл. 11, Рис. 4). Так как IL-
10 защищает клетки от апоптоза, блокируя рецепторы эндоцитоза на их поверхности, а также ингибирует продукцию провоспалительных цитокинов, снижение его уровня в крови способствовало хронизации воспалительных явлений в зоне пораженной кожи, усилению клеточного ответа по Тh2 пути с усиленной продукцией антител и возникновению патоморфологических изменений эпидермиса и дермы, определяющих клиническую симптоматику токсидермии.
Таблица 11
Уровень IL-10 в сыворотке крови больных токсидермией
Больные токсидермией |
Количество
Больных |
Уровни цитокинов (пг/мл) |
IL-10 |
||
30 |
6,9±1,6 |
|
Здоровые доноры |
20 |
13,2±2,3 |
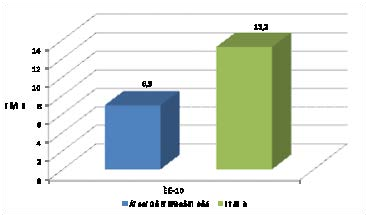
Рисунок 4. Уровень IL-10 в сыворотке крови больных токсидермией.
Таким образом, проведенные исследования показали важную роль дисбаланса цитокинов в формировании воспалительного характера иммунопатологических реакций при токсидермии.
В последние годы в многочисленных работах отечественных и зарубежных авторов показано большое значение нарушений продукции фактора ингибирования миграции макрофагов (МИФ) в патогенезе многих иммуноопосредованных заболеваний. В настоящее время доказано, что биологическое действие МИФ, синтезируемого Т-лимфоцитами, моноцитами и макрофагами, заключается в торможении миграции фагоцитирующих клеток. МИФ способствует поступлению фагоцитирующих клеток в очаг
воспаления, обладая и другими свойствами провоспалительных цитокинов. В связи с этим, большой интерес представляли результаты изучения уровня МИФ в сыворотке крови больных токсидермией, продукции МИФ периферическими мононуклеарными клетками, соотношения МИФ/МСФ (фактор стимуляции миграции фагоцитов), а также анализа спонтанной клеточной миграции у пациентов с различной степенью тяжести воспалительного процесса.
Содержание МИФ в сыворотке крови и продукцию МИФ периферическими мононуклеарными клетками измеряли методом энзимсвязанного иммуносорбентного анализа (ELISA). Для оценки соотношения МИФ/МСФ и анализа спонтанной клеточной миграции применяли скрининговый тест клеточной миграции из микрокультур (СМТК).
Данные исследования были проведены в общей сложности у 22
пациентов с токсидермией и у 12 здоровых доноров (табл. 12).
Таблица 12
Концентрация МИФ в крови больных различными формами
токсидермии
Пациенты |
Количество больных |
МИФ (нг/мл) |
Здоровые доноры |
12 |
6,3±0,6 |
Больные токсидермией |
22 |
34,5±2,9* |
* Различия достоверны по сравнению с референтными значениями (p < 0,05)
Проведенные исследования показали (Рис. 5), что количественное содержание МИФ в крови в среднем по группе больных токсидермией статистически достоверно превышала (34,5 ± 2,9 нг/мл) аналогичный показатель у здоровых доноров (6,3 ± 0,6 нг/мл). Наиболее высокий уровень МИФ в периферической крови (38,8 ± 2,9 нг/мл) выявлено у больных с островоспалительным течением заболевания. Вместе с тем резкий подъемом концентрации МИФ в крови отмечался при возникновении узлоподобных элементов и клинических проявлениях васкулита (40,1±3,1 нг/мл).

Рисунок 5. Концентрация МИФ в крови больных токсидермией.
Спонтанное высвобождение МИФ культурой моноцитов больных токсидерией было статистически достоверно выше (14,4 ± 1,3 нг/мл), чем у здоровых доноров (4,3 ± 1,1 нг/ мл). При стимуляции моноцитов больных токсидермией конковалином А продукция МИФ составила 65,3 ± 8,9 нг/мл, что статистически достоверно выше референтных значений (23,5±1,7 нг/мл) (Рис. 6).

Рисунок 6. Уровень продукции МИФ моноцитами крови больных токсидермией до и после стимуляции конковалином А.
У 20 пациентов с различной тяжестью течения и площадью очагов поражения токсидермией и у 15 здоровых доноров была исследована площадь миграции клеток, которая определялась балансом МИФ и МСФ. Вследствие подавления миграции у больных токсидермией площадь миграции была значительно меньше таковой у здоровых доноров (более чем на 24%). У пациентов с островоспалительным и распространенным характером течения патологического процесса подавление миграции было максимальным. Индекс клеточной миграции, величина которого варьировала в интервале от 10% до 39%, возрастал при распространенных, островоспалительных формах токсидермии до 36 - 39% (табл. 13).
Таблица 13
Среднее значение индекса клеточной миграции у больных токсидермии
Пациенты |
Количество больных |
Индекс миграции (%) |
Больные токсидермией (в целом по группе) |
22 |
24,0±5,7* |
Больные с островоспалительными распространенными формами токсидермией |
8 |
37,0±6,1* |
* Различия достоверны по сравнению с референтными значениями (p < 0,05)
Таким образом, результаты проведенных исследований свидетельствуют о том, что возникновение иммунного воспаления в дермо- эпидермальном пространстве в значительной степени обусловлено избыточной продукцией МИФ.
Как известно, механизмы естественной цитотоксичности (ЕЦТ) играют важную роль, как в уничтожении клеток-мишеней, так и в регуляции гуморального иммунитета. Поэтому нам представлялось важным оценить активность естественных клеток - киллеров (ЕКК) у больных токсидермией (табл. 14).
Таблица 14
Активность естественных клеток - киллеров (ЕКК) у больных
токсидермией и здоровых доноров
Группа обследованных больных |
Показатели |
||
ЦИ % |
P< |
Характеристика ЕКК |
|
Больные токсидермией (в целом по группе) |
79,1±9,9 |
<0,05 |
Гиперфункция |
Больные с островоспалительным распространенным течением токсидермии |
84,7± 10,1 |
<0,05 |
Гиперфункция |
Группа здоровых доноров |
41,4± 3,3 |
- |
- |
Из представленных в таблице данных следует, что функциональная активность ЕКК у больных с различными клиническими вариантами течения токсидермии значительно повышена по сравнению с референтными значениями. Наиболее высокие показатели ЦИ (79,1±4,9% при 84,7±10,1%) прослеживались у больных с островоспалительными распространенными формами токсидермии.
Значимую роль в реализации воспаления играют антигены адгезии (ICAM-1, ICAM-3, LFA-1, VCAM-1). Основная функция молекул адгезии заключается в поддержании межклеточных взаимодействий, миграции клеток в очаг воспаления и инициации иммунного ответа. Антигены адгезии существуют как в растворимом состоянии, так и в мембрано-связанной форме на поверхности клеточных мембран (табл. 15).
Проведенные до лечения исследования показали, что у больных токсидермией уровень сывороточного содержания антигенов sCD50 равный 211,3±35,9 U/мл и sCD54 - 31,2±3,5 U/мл был понижен по сравнению с референтными значениями (соответственно 233,2±36,1 U/мл и 35,4±3,6 U/мл). Однако эта разница была незначительной и не носила статистически
достоверный характер. В то время как относительное количество мононуклеарных клеток CD50+ и CD54+ (83,5±6,1% и 86,2±6,4%) в сосудистом русле больных токсидермией статистически достоверно превышало референтные значения (60,3±4,8% и 63,0±4,9%). Известно, что функция растворимых антигенов CD50 и CD54 заключается в модуляции иммунологических реакций, протекающих с участием мембранных форм этих антигенов. Растворимые антигены CD50 и CD54 способны тормозить активацию клеток и процессы адгезии, связанные с клеточной миграцией. Растворимый антиген CD54 конкурирует с мембранным ICAM-1 эндотелиальных клеток за связывание с LFA-1 и тем самым снижает адгезию лейкоцитов к эндотелию.
Таблица 15
Уровень антигенов адгезии
Пациенты |
Количество больных |
Антигены адгезии ICAM-1 (sCD50), ICAM-3 (sCD54), LFA-1 (CD50+), VCAM-1 (CD54+) |
|||
sCD50 U/мл |
sCD54 U/мл |
CD50+% |
CD54+% |
||
Больные токсидермией |
30 |
211,3±35,9 |
31,2±3,5 |
83,5±6,1 |
86,2±6,4 |
Здоровые доноры |
23 |
233,2±36,1 |
35,4±3,6 |
60,3±4,8 |
63,0±4,9 |
Поэтому выявленный дисбаланс в системе антигенов адгезии, характеризующийся понижением растворимых молекул адгезии на фоне значительного роста мембранных форм данных антигенов являлся одним из причинных факторов возникновению и поддержанию воспаления у больных токсидермией.
При должном уровне естественной резистентности в организме стимулируется выработка индуцибельной NO-синтазы (iNOS) через транскрипцию гена. В таких случаях синтезируемый оксид азота (NO) влияет на перекисное окисление липидов при развитии воспалительного процесса.
Учитывая, что оксид азота занимает одно из ведущих мест в системе неспецифической резистентности, немаловажным представлялось провести количественный анализ содержания NO в сыворотке крови у больных токсидермией. Изучение эндогенного NO проведено у 20 больных токсидермией и 15 здоровых доноров. Результаты проведенных исследований представлены в таблице 16.
Таблица 16
Уровень эндогенного оксида азота у больных тосидермией
Пациенты |
Уровень оксида азота (мкмоль/л) |
Больные токсидермией (n=20) |
33,5±2,8 |
Группа здоровых доноров (n=15) |
18,9 ±1,5 |
* Примечание - различия статистически достоверны относительно группы здоровых
доноров (р<0,05)
Проведенные исследования показали, что результатом воспалительных и функциональных изменений при токсидермии приводило к увеличению выработки эндогенного NO до 33,52,8 мкмоль/л (18,91,5 мкмоль/л у здоровых доноров). Вместе с тем, резкое повышение оксида азота по сравнению с референтными значениями, переходящее рамки протективного иммунитета, способствовало поддержанию воспалительных явлений у больных токсидермией (Рис. 7).

Рисунок 7. Уровень эндогенного оксида азота у больных токсидермией.
