
4 курс / Дерматовенерология / Коллаген_в_косметической_дерматологии_Хабаров_В_Н
.pdfVinogradova O., Velyvis A., Velyviene A., Hu B. et al. A structural mechanism of integrin alpha(IIb)beta(3) «inside-out» activation as regulated by its cytoplasmic face
// Cell. 2002. Vol. 110, N 5. P. 587-597.
Wells J.M., Gaggar A., Blalock J.E. MMP generated matrikines // Matrix Biol. 2015.
Vol. 44-46. P. 122-129.
Williams K., Motiani K., Giridhar P.V., Kasper S. CD44 integrates signaling in normal stem cell, cancer stem cell and (pre)metastatic niches // Exp. Biol. Med. (Maywood). 2013. Vol. 238, N 3. P. 324-338.
Woltersdorf C., Bonk M., Leitinger B., Huhtala M. et al. The binding capacity ofa1p1-, α2β1-and α10β1-integrins depends on non-collagenous surface macromolecules rather than the collagens in cartilage fibrils // Matrix Biol. 2017 Feb 10. pii: S0945-053X(16)30314-6.
Xia W., Hammerberg C., Li Y., He T. et al. Expression of catalytically active matrix me-talloproteinase-1 in dermal fibroblasts induces collagen fragmentation and functional alterations that resemble aged human skin // Aging Cell. 2013. Vol. 12, N 4. P. 661-671.
Young H., Steele T., Bray R. et al. Human reserve pluripotent mesenchymal stem cells are present in the connective tissues of skeletal muscle and dermis derived from fetal, adult, and geriatric donors // Anat. Rec. 2001. Vol. 264. P. 51-62.
Zeltz C., Gullberg D. The integrin-collagen connection - a glue for tissue repair? // J. Cell Sci. 2016. Vol. 129, N 4. P. 653-664.
Zeltz C., Lu N., Gullberg D. Integrin α11β1: a major collagen receptor on fibroblastic cells // Adv. Exp. Med. Biol. 2014. Vol. 819. P. 73-83.
Zhong J., Hua N., Xiong X. et al. A novel promising therapy for skin aging: Dermal multipotent stem cells against photoaged skin by activation of TGF-b/Smad and p38 MAPK signaling pathway. URL: www.elsevier.com/locate/mehy.
Zhu C.C., Tang B., Su J., Zhao H. et al. Abnormal accumulation of collagen type I due to the loss of discoidin domain receptor 2 (Ddr2) promotes testicular interstitial dysfunction // PLoS One. 2015. Vol. 10, N 7. Article ID e0131947.
Zigrino P., Brinckmann J., Niehoff A., Lu Y. et al. Fibroblast-derived MMP-14 regulates collagen homeostasis in adult skin // J. Invest. Dermatol. 2016. Vol. 136, N 8.
P. 1575-1583.
Zitnay J.L., Li Y., Qin Z., San B.H.. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides // Nat. Com-
mun. 2017. Vol. 8. Article ID 14913.
Медицинские книги
@medknigi
Глава 3. Обновление матриксных структур дермы. Биохимический аспект координации синтеза и распада коллагена
Время жизни отдельной биомолекулы в организме отследить невозможно. Поэтому для характеристики жизнеспособности используют параметр, называемый периодом полураспада (Т1/2) - время, за которое происходит ферментативное расщепление 50% всего пула макромолекул. При испытываемом клеткой физико-химическом стрессе или вследствие патологических процессов равновесие между синтезом и распадом нарушается. Очень важно отметить, что координация процессов синтеза и распада различных биополимерных соединений имеет свои особенности. Она осуществляется регуляторными системами, которые согласовывают скорости ферментативного синтеза и распада, необходимые для физиологического функционирования и обновления ткани. Такой баланс и оценивается периодом полураспада (Т1/2). Существует множество факторов, которые смещают равновесие между этими процессами, вызывая различные патологические состояния.
Многие проблемы, с которыми сталкивается косметическая дерматология, тесно связаны с возможностями влияния на обмен молекул матриксных структур дермы через клеточные популяции, их функциональную активность и через активность матриксных ферментов, ответственных за сборку и обновление межклеточного матрикса.
3.1. ОБНОВЛЕНИЕ МАТРИКСНЫХ СТРУКТУР
Межклеточный матрикс дермы состоит из большого количества компонентов, которые обусловливают жёсткость, подвижность и упругость кожи. В их состав входят три основных класса белковых молекул: фибриллярные белки двух функциональных типов - семейства коллагена и эластина; адгезивные белки семейства фибронектина; протео-гликаны, гликопротеины. Белковые молекулы и ГК синтезируются и формируются постоянными клетками матрикса - фибробластами. На молекулярный состав матрикса оказывают влияние и транзиторные клетки (лимфоциты, нейтрофилы, моноциты, макрофаги и др.), которые мигрируют в дерму из крови в ответ на специфические стимулы. Межклеточный матрикс представляет собой внешнюю экологическую нишу, в которую клетки «делегируют» ферменты, а также их ингибиторы и активаторы, способные замедлять или ускорять сборку или распад межклеточных структур. Кроме того, он представляет собой резервуар сигнальных молекул, которые через рецепторы «сообщают» клеткам о состоянии матрикса и необходимых адаптивных синтезах в ответ на изменения в межклеточной нише. Так формируются чрезвычайно важные согласованные отношения клетка-матрикс и матрикс-клетка. Сигналы из межклеточного вещества контролируют дифференцировку, полярность, миграцию, выживаемость клеток, которые
Медицинские книги
@medknigi
выражаются в активации/замедлении синтезов фибробластами молекул для обновления матрикса. Динамический баланс между синтезом и распадом матриксных структур дермы играет решающую роль в сохранении здоровой кожи.
Ремоделирование дермы осуществляется не только в результате активного физиологического функционирования, но и в процессе синтеза/распада (обновления, турновера). Процессы деградации структур межклеточного матрикса являются важной составной частью физиологического ремоделирования ткани.
Коллагеновые белки постоянно повреждаются свободными радикалами, реакциями неферментативного гликирования (присоединения остатков глюкозы к аминокислотным остаткам белков), карбамили-рования, билирубинирования, протеолиза (см. гл. 4). Эти изменения структур приводят к нарушению взаимодействия и ориентации макромолекул. В зонах повреждений активируются металлопротеиназы (коллагеназы), которые разрушают неправильно структурированные или ориентированные макромолекулы. Фибробласты реагируют на изменения окружения увеличением или уменьшением синтеза и секреции макромолекул для ремоделирования матрикса. Наиболее быстрому синтезу и распаду подвергается ГК, период полураспада которой в дерме оценивается одними сутками (Evanko et al., 2007; Хабаров,
Бойков, 2016).
Из белковых компонентов межклеточного вещества наиболее долгоживущим является эластин. По ряду свойств эластин сходен с коллагеном (см. гл. 1). Подобно коллагену, эластин богат глицином и аланином. Основная субъединица фибрилл эластина - тропоэластин - имеет молекулярную массу приблизительно 72 000 Да и содержит примерно 800 аминокислот. Тропоэластин отличается от тропоколлагена тем, что содержит много остатков лизина и мало остатков пролина. Молекула тропоэластина состоит из богатых остатками глицина спиральных участков, разделенных более короткими участками, содержащими остатки лизина и аланина. Спиральные участки растягиваются при натяжении и возвращаются к исходной длине при снятии нагрузки. Области, содержащие остатки лизина, принимают участие в формировании поперечных ковалентных связей. Четыре R-группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин или в сходный по структуре изодесмо-зин. Эти аминокислоты обнаружены только в эластине. Центральная циклическая структура десмозина образуется путём взаимодействия R-групп четырёх остатков лизина, что приводит к возникновению поперечных связей между молекулами эластина (см. рис. 1.7, гл. 1). Таким путём полипептидные цепи тропоэластина объединяются в сети, способные обратимо растягиваться во всех направлениях (рис. 3.1).
Медицинские книги
@medknigi

Рис. 3.1. Ковалентные связи молекул в эластиновой сети (Алейникова и др.,
2003)
Эластин активно синтезируется фибробластами только в эмбриональный период развития. В зрелом возрасте эластиновая сеть лишь медленно деградирует. Период полураспада эластина составляет около 75 лет (Северин и др., 2008). Коллаген также относится к медленно обменивающимся белкам с периодом полураспада (Т1/2) в недели или месяцы, а по некоторым данным - до 15 лет (Verzijl et al., 2000). Такие большие временные различия в жизни разных биополимеров межклеточного вещества дермы усложняют координацию ремоделиро-вания матрикса. Поскольку все основные макромолекулы матриксных структур синтезируются фибробластами, а их активность в значительной степени определяется фокальными контактами с коллагеновыми волокнами (см. рис. 2.10, гл. 2), рассмотрение процессов координации синтеза и распада коллагеновой сети необходимо через призму взаимодействия клеточных структур с межклеточным веществом.
3.2. РЕГУЛЯЦИЯ ОБМЕНА КОЛЛАГЕНА
Характерная особенность дермы и других соединительных тканей состоит в том, что биосинтез основных макромолекул для межклеточного матрикса происходит внутри клеток обособленно (Turlier et al., 2013). Только после выхода макромолекул в межклеточное пространство между ними возникают взаимодействия, в результате которых образуются высокоорганизованные матриксные структуры. Это переносит координацию, сопряжение, интеграцию синтезов, функционирование и достижение гомеостаза ткани на уровень взаимодействия «клетка-ма-трикс» и «матрикс-клетка». Очевидно, что динамический баланс между синтезом и распадом коллагеновой сети дермы является ключевым звеном поддержания здоровой ткани в целом, а нарушения
Медицинские книги
@medknigi
динамического баланса между синтезом и распадом коллагена приводят к инициированию патологий.
В статьях, посвященных эстетической медицине, достаточно часто можно встретить термин «неоколлагенез». Он относится к индукции, протеканию и последствиям активации синтеза коллагена в результате различных косметологических процедур. В научной литературе обычно используются термины «ремоделирование», «турновер» (означающие скорости протекания процессов синтеза/распада коллагена) или параметры «период полужизни», «период полураспада» биополимеров. Чтобы придерживаться устоявшейся, привычной для врачей-дерматологов терминологии, введём определение «неофибриллогенез», а «неоколлагенез» в настоящем изложении будет означать внутриклеточную регуляцию синтеза проколлагена, его экзоцитоз во внеклеточное пространство. Дальнейшие реакции, от удаления концевых полипептидов от проколлагена и образования молекул тропоколлагена до формирования волокон коллагена, будем называть неофибриллогенезом. Таким образом, термин «неоколлагенез» относится к внутриклеточному синтезу коллагена, а «неофибриллогенез» означает сборку новых коллагено-вых структур в межклеточном матриксе. Такое разграничение понятий (терминов) позволяет объяснить имеющиеся в научной литературе противоречия. Так, о времени жизни коллагена в ряде работ приводятся разноречивые данные. По одним источникам, период полураспада (Т1/2) коллагена составляет недели или несколько месяцев (Алейникова и др., 2003). В других приводятся данные о полном обновлении коллагена за 300 дней (Северин и др., 2008). В третьих - период полураспада коллагена оценивается в 15 лет (Verzijl et al., 2000). Такие противоречия в результатах оценки времени полураспада коллагена связаны с тем, что скорость синтеза проколлагена в фибробластах значительно выше, чем скорости сборки/распада зрелых коллагеновых фибрилл в межклеточном компартменте (Canty, Kadler, 2005). Если предположить, что про-коллаген в процессе синтеза не распадается, то половина коллагена в дерме кожи будет синтезирована примерно за 28 дней (El-Harake et al., 1998; Kruglikov, 2013). В
реальной ситуации значительная часть вновь синтезирующегося коллагена (проколлагена) распадается и не используется для восстановления матриксных структур кожи. Процессы турновера проколлагена очень чувствительны и модулируются разными физическими и химическими факторами. Напротив, зрелый коллаген в межклеточном матриксе менее чувствителен к стрессфакторам и имеет период полураспада около 15 лет (Verzinjl et al., 2000). Следовательно, полная замена коллагена в коже может происходить в течение 30 лет (Carruthers et al., 2014). Такое длительное время функционирования коллагена относительно периода жизни самого организма обусловлено устойчивостью его структур к протеолитическому расщеплению и различным стресс-факторам, например к значительным перепадам температуры. Некоторое его количество будет неизбежно подвергаться расщеплению металлопротеиназами при нормальных физиологических условиях. Это
Медицинские книги
@medknigi
количество восполняется из пула постоянно синтезируемого проколлагена. В экспериментальных исследованиях обнаруживают значительные различия между индивидуумами в соотношении фракций проколлагена и зрелого коллагена в дерме. Именно функциональное состояние разветвлённой сети из фибрилл зрелого коллагена, которая формирует каркас внеклеточного матрикса, а не неоколлагенез, как принято считать, определяет внешний вид кожи. В силу протеолитической устойчивости этой сети и очень продолжительного времени турновера её естественное медленное ремоделирование возможно только через продукцию тропоколлагена и замену старых фибрилл на новые. Снижающаяся с возрастом активность фибробластов дермы может быть результатом снижения эффективности ремоделирования зрелого коллагена. Несмотря на то что турновер проколлагена и зрелого коллагена может существенно отличаться в разных дерматомах и условиях, из экспериментальных данных выводится примерный порядок величин. В зрелый коллаген включается только около 0,5 мг/г массы кожи вновь синтезированного проколлагена (Wirtschaftler, Bentley, 1962). А общее содержание коллагена составляет около 120 мг/г ткани
(Waterlow, Stephen, 1966; Kruglikov, 2013).
Сложность изучения процессов неоколлагенеза и неофибриллогенеза вызвана множественной последовательностью этапов синтеза, созревания, расщепления и обновления коллагеновых фибрилл. Чтобы понять эти процессы, рассмотрим клеточные и межклеточные регуляторные механизмы на стадиях синтеза коллагена в фибробластах, созревания и сборки фибрилл в межклеточном матриксе, повреждений, протеолиза и замены повреждённых коллагеновых волокон.
Активность турновера коллагена связана с возрастом. Коллаген называют белком молодости (рис. 3.2). Известно, что содержание коллагена в дерме постепенно уменьшается с возрастом и дополнительно в результате фотоповреждений, повторяющихся нарушений процессов ремоделирования и химических модификаций. В молодом организме обмен коллагена в коже оценивается примерно в 6 кг/год. В среднем возрасте восстановление коллагена снижается до 3 кг/год. После 2530 лет распад коллагена постоянно возрастает и начинает преобладать над синтезом. В результате с возрастом содержание коллагена в дерме постепенно уменьшается. Дисбаланс между синтезом и обменом зрелого коллагена состоит в том, что эти множественные стадии разнесены в пространстве и времени - синтез (неоколлагенез) происходит в клетках, а созревание, сборка (неофибриллогенез) и замена коллагеновых волокон - в межклеточном матриксе.
В молодости обмен коллагена протекает интенсивно, но с возрастом, особенно к старости, более заметно снижается неофибриллогенез. Увеличивается количество поперечных сшивок в коллагеновых волок-
Медицинские книги
@medknigi

Рис. 3.2. Схема хронологического «старения» коллагеновой сети межклеточного матрикса дермынах, а также увеличивается количество пучков (см. рис. 2.2), что затрудняет доступность коллагена для расщепления коллагеназой. О скорости этих процессов можно судить из следующих данных. Если у молодых людей в возрасте 10-20 лет содержание гидроксипролина в моче может достигать 200 мг в сутки, то с возрастом экскреция гидроксипролина снижается до 15-20 мг/сут (Алейникова и др., 2003). (Гидроксипро-лин встречается только в коллагене и является маркерной аминокислотой, по которой судят о скорости распада коллагена.) О «возрасте» коллагена можно судить также по количеству поперечных ковалентных связей в коллагеновых волокнах. Чем «моложе» коллаген, тем меньше поперечных связей в коллагеновых фибриллах, тем быстрее он разрушается, и наоборот. «Возраст» коллагена можно определять также по его растворимости в солевых растворах. На электрофореграмме солевого экстракта (0,14 М раствора NaCl) фрагмента грануляционной ткани (молодая ткань, образующаяся на месте повреждения) обнаруживаются две фракции с молекулярной массой, равной молекулярной массе одной цепи и димеру а-цепей коллагена. Выход этих фракций повышается, если коллагены экстрагировать 0,45 М раствором NaCl. «Молодой» коллаген, содержащий мало поперечных ковалентных связей, хорошо растворяется в солевых растворах, а «старение» - это процесс образования поперечных ковалентных связей, увеличения прочности фибрилл с одновременным снижением эластичности и уменьшения растворимости в солевых растворах. Поэтому обновление кожи главным образом связано с возможностями влияния на обмен макромолекул
Медицинские книги
@medknigi
коллагеновой фибриллярной сети. Рассмотрим эти процессы регуляции внутриклеточных этапов синтеза коллагеновых белков дермы.
3.2.1. Регуляция внутриклеточных этапов синтеза и процессинга коллагена (неоколлагенез)
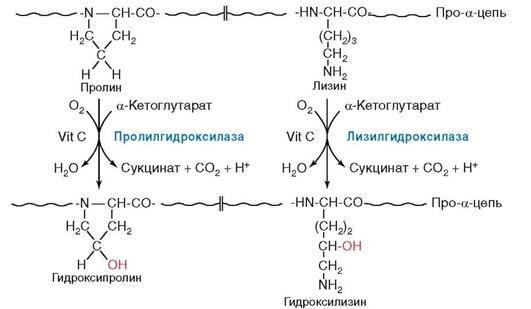
Синтез коллагена в дифференцированных фибробластах дермы регулируется разными способами. Прежде всего, сам коллаген и N-пропептиды после отщепления от С- и N-конца проколлагена концевых пептидов тормозят трансляцию коллагена по принципу отрицательной обратной связи (Алейникова и др., 2003). Аскорбиновая кислота (витамин С) активирует синтез и модификации коллагена. Она является коферментом гидроксилаз, а Fe+2, кетоглутарат и О2 - кофакторами. Железосодержащие (Fe+2) ферменты пролилгидроксилаза и ли-зилгидроксилаза осуществляют гидроксилирование остатков пролина и лизина с образованием гидроксипролина и гидроксилизина
(рис. 3.3).
Для поддержания восстановленной формы Fe+2 необходимо в качестве восстановителя постоянное присутствие аскорбиновой кислоты. Остатки гидроксипролина участвуют в образовании водородных связей, стабилизирующих трёхспиральную структуру коллагена. Лизин и гидроксилизин необходимы для образования ковалентных связей при сборе коллагеновых фибрилл. Эти химические модификации коллагена начинаются в период трансляции полипептидной цепи коллагена на полирибосомах шероховатого ЭПР (см. рис. 1.2, 1.3) и продолжаются до отделения её от рибосом.
Следующая посттрансляционная модификация - гликозилирование гидроксилизина - происходит с образованием галактозилглюкозы. Гликозилирование гидроксилизина обеспечивается трансгликозидазами, субстратами которых являются УДФ-глюкоза и УДФ-галактоза (рис. 3.4).
Рис. 3.3. Гидроксилирование радикалов пролина и лизина в молекулах препроколлагена
Медицинские книги
@medknigi

Рис. 3.4. Гликозилирование остатков гидроксилизина
Гликозилирование остатков гидроксилизина происходит одновременно с формированием трёхспиральной структуры и прекращается по завершении спирализации. Остатки глюкозы и галактозы к ОН-группам радикала гидроксилизина присоединяются в N-концевых участках, а в С-концевых участках присоединяются остатки маннозы (Северин и др., 2008). Реакции гликозилирования происходят в цистернах гладкого (агранулярного) цитоплазматического ретикулума (см. рис. 1.2, 1.3; гл. 1). Химические модификации коллагеновых полипептидов необходимы для правильного созревания коллагена. Этапы созревания - формирование различных структур коллагена из первичных полипептидных цепей - начинаются в цистернах шероховатого эндоплазматического ретикулума (ШЭР) и завершаются в межклеточном матриксе. Правильную ориентацию цепей относительно друг друга обеспечивают N- и С-концевые фрагменты проацепей, имеющие глобулярную структуру и содержащие остатки цистеина. Образование внутрицепочечных дисульфидных мостиков остатками цистеина в N-концевом участке молекулы препятствует спирализации фрагмента из 100 аминокислотных остатков. Межцепочечные дисульфидные связи в С-концевом фрагменте из 250 аминокислотных остатков обеспечивают правильную ориентацию про-а-цепей и в то же время мешают спирализации этого участка. Они также предотвращают образование коллагеновых фибрилл в клетках. Важную роль в фолдинге (структурной организации, складывании) молекул коллагена играют шапероны. Эти белки обеспечивают необходимое формирование вторичной, третичной и последующих структур коллагена. После гидроксилирования и гликозилирования три цепи проколлагена соединяются водородными связями и образуют тройную спираль проколлагена. Далее они транспортируются в аппарат Гольджи, включаются в секреторные пузырьки и по механизму экзоцитоза секретируются в межклеточное пространство.
3.2.2. Регуляция межклеточных этапов созревания и сборки коллагеновых фибрилл (неофибриллогенез)
Первой модификацией межклеточного этапа является протеолити-ческое отщепление N- и С-концевых неспирализованных фрагментов. Гидролиз пептидных связей сразу в 3 цепях катализируют специфические пептидазы. В результате из проколлагена образуются молекулы тропоколлагена, которые являются основными структурными единицами коллагеновых фибрилл. Тропоколлаген представляет собой палочкообразную макромолекулу, в которой три спирально навитые друг на друга полипептидные цепи из примерно 1000
Медицинские книги
@medknigi

аминокислотных остатков имеют равную длину в 300 нм. Объединению тропоколлагена в микрофибиллы предшествует ещё одна модификация остатков лизина в составе трёхспиральной молекулы - реакции дезаминирования лизина и гидроксилизина. Эти реакции катализируются Cu2+-содержащим ферментом лизилоксидазой. В результате образуются аллизин (альдегид лизина) и гидроксиаллизин (альдегид гидроксилизина), обладающие высокой реакционной способностью (рис. 3.5).
Фибриллогенез - образование коллагеновых фибрилл - самопроизвольный процесс. Молекулы тропоколлагена располагаются параллельными рядами (рис.
3.6)
Рис. 3.5. Дезаминирование лизина
Рис. 3.6. Укладка молекул тропоколлагена в коллагеновых фибриллах
Самосборка коллагеновых фибрилл - яркий пример подтверждения концепции матричного воспроизведения макромолекулярных структур, сформулированной Н.К. Кольцовым (Кольцов, 1936), которую можно считать идейным началом современной молекулярной биологии (Шноль, 1979). Структурная организация фибрилл стабилизируется путём самопроизвольного формирования
Медицинские книги
@medknigi
