
4 курс / Дерматовенерология / Коллаген_в_косметической_дерматологии_Хабаров_В_Н
.pdf
Рис. 5.10. Возможные пути формирования миофибробластов (Borthwick et al.,
2013)
Медицинские книги
@medknigi
Рис. 5.11. Основные четыре сигнальных пути, приводящие к перерождению некоторой фракции фибробластов в миофибробласты (Lighthouse, Small, 2016).
TGF-β - трансформирующий фактор роста; GPCR (G-protein coupled receptors) -
рецепторы связывания G-белков; Са2+ - ионы кальция; Smad2/3, Smad4 - усилители транскрипции; Smad6/7 - ингибиторы транскрипции; KLF5/15
(Kruppellike transcription factors) - факторы транскрипции, подобные фактору Круппеля; АТ1 - ангиотензин; RhoA (Ras homolog A) - белок, регулирующий натяжение нитей актина; ROCK (Rho-kinase) - Rho-зависимая киназа; MRTF - миокардин-подобный транскрипционный фактор; β-catenin - β-катенин; CnA, B (calcineurin А/В) - кальцинеурин; TAK (TGF-β-activated kinase) - киназа,
активируемая фактором TGF-β; SRF (serum response factor) - глобальный фактор транскрипции; TRPC 1/3/6 (transient receptor potential channel) - рецепторы,
регулирующие потенциал каналов для абсорбции ионов; NFAT (nuclear factor of activated T-cells ) - фактор транскрипции, производимый иммунными Т- клетками
Путь 1 (канонический путь). Механический стресс приводит к активации поверхностного рецептора RI (римская цифра I) и, через его внутриклеточный домен, - к активации фактора транскрипции TGF-p.
Параллельно ангиотензин АТ1 посредством KLF5 также активирует TGF-β, после чего обе фракции индуцируют фосфорилирование и активацию белковпосредников SMAD2/3. Далее SMAD2/3 в комплексе с SMAD4 входит в ядро и активирует транскрипцию ряда генов. Ингибитором этого процесса выступает
SMAD6/7.
Путь 2 (неканонический путь). Механический стресс приводит к активации поверхностного рецептора RII (римская цифра II) и через его внутриклеточный домен - к активации фактора транскрипции TGF-β. Затем TGF-β активирует киназы TAK1, MAPK14 (p38) и ERK, что приводит к запуску программы активации фенотипа миофибробластов.
Путь 3. Механический стресс приводит к отсоединению от мембраны белковпосредников β-катенинов. В норме они быстро деградируют, но наличие активированного TGF-β предохраняет их от деградации. Затем p-катенины переходят в ядро в комплексе с фактором MRTF и связываются с фактором SRF на промоторах ряда генов.
Путь 4. Этот путь пока выявлен только для миокарда, но, вероятно, имеет место и в других органах. Абсорбция ионов, в данном случае ионов кальция, регулируется через трансмембранные белки TRPC. Их активация посредством TGF-β приводит к высокому внутриклеточному уровню кальция и стимулирует связывание димеров кальцинеуринов Cn A/B с кальмодулином. Этот комплекс участвует в дефосфорили-ровании NFAT, что провоцирует переход NFAT в ядро и последующее связывание с промоторами ряда генов.
Результатом активности всех перечисленных выше сигнальных путей является запуск программы формирования фенотипа миофибро-бластов, которая приводит к активации фактора роста соединительной ткани CTGF (connective tissue growth factor) и росту фиброзной ткани.
Медицинские книги
@medknigi
Пролиферативная стадия процесса регенерации ткани характеризуется усилением синтеза коллагена, что и приводит в дальнейшем к фиброзу дермы. Накопленные экспериментальные данные свидетельствуют об общих биохимических этапах развития фиброза у различных органов, хотя исходный набор клеток, приводящий к появлению мио-фибробластов, различен (Martin et al., 2016). В случае повреждения кожи такими клетками-предшественниками служат клетки эпидермиса и дермальные фибробласты. Главным отличием миофибробластов от фибробластов является изменённая структура основного структурного внутриклеточного белка актина, получившая название «α-SMA» (рис. 5.12).
После модификации нити актина через специальную структуру, называемую фибронексусом, связываются с трансмембранными белками, которые, в свою очередь, связаны с белками и гиалуронаном внеклеточного матрикса
(Mirastschijski et al., 2004; Albeiroti et al., 2015, Хабаров, Бойков, 2016).
Благодаря этому миофибробласт способен стягивать на себя окружающий матрикс, действуя аналогично клеткам мускулов (очень возможно, что именно с этим связан лифтинг-эффект после проведения, например, лазерных процедур). Цель работы миофибро-бластов - заставить рану сузиться до минимально возможного размера (Wells et al., 2016). Формируется временный внеклеточный матрикс, структура которого отлична от нормального за счёт значительно увеличенной доли фибронектина и коллагена III типа. Фибронектин здесь выступает в качестве «мастера-регулятора», ибо именно через него происходит непосредственный контакт интегринов на поверхности клеток с другими компонентами внеклеточного матрикса.
Медицинские книги
@medknigi
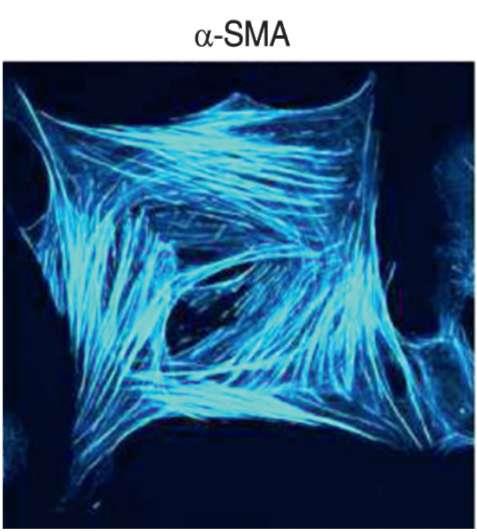
Рис. 5.12. Вид модифицированного актина в цитоплазме миофибробласта, полученный с помощью электронного микроскопа
В процессе заживления раны миофибробласты ускоренно синтезируют межклеточный матрикс из сложнопереплетённых коллагеновых фибрилл, необходимый как структурный каркас для последующего заполнения «правильными» клетками. Этот процесс можно назвать «хорошим» фиброзом. Если рана заживает достаточно быстро, происходит полная
репарация повреждённого участка (регенерация) до состояния «как было». Если же повреждение достаточно глубокое, то заживает оно дольше, поскольку разрушенная инфраструктура капилляров крови исключает своевременный приток питательньгх веществ и других факторов для поддержания совместной работы миофибробластов и фибробластов. Одновременно затруднён процесс переработки и удаления разрушенных клеток. За это время высока вероятность занесения инфекции, что вызовет длительное воспаление и ещё более отдалит полное заживление. При глубоких ранах восстановление повреждённого участка происходит по принципу «лишь бы не пустота», и этот процесс можно охарактеризовать как «плохой» фиброз. Как следствие, внутренняя часть глубокой раны представляет собой коллагеновый матрикс из пучков однонаправленных жёстких фибрилл. Именно из них в основном и состоит шрам (рубцовая ткань). Получившаяся ткань недостаточно функциональна,
Медицинские книги
@medknigi
поэтому такая репарация, в строгом смысле определения, физиологической регенерацией не называется, так как происходит избыточный синтез коллагена I типа, хотя именно коллаген I типа является основным компонентом полностью сформировавшейся фиброзной ткани шрама. Но как уже отмечалось, в формировании фибриллярной структуры принимает участие не только коллаген I типа, но и, хотя в меньшей степени, коллаген III, V и VI типов. При этом особенно важно подчеркнуть, что присутствие коллагена III, V и VI типов необходимо для формирования правильных структур коллагена I типа (Tracy et al., 2016). Интересен экспериментально зафиксированный факт, что присутствие коллагена V и VI типов подавляет апоптоз миофибробластов, которые в основном и продуцируют коллаген I типа при репарации ран. Можно предполагать поэтому, что своевременное выключение активности
генов COL5A2 и COL6A1, кодирующих коллаген V и VI типов соответственно, или инактивация их транскриптов могла бы предотвратить переход нормального репаративного процесса в фиброз.
На начальных стадиях репарации повреждения скорость синтеза нового коллагена превышает скорость его деградации коллагеназами, но впоследствии, иногда через недели, достигается равновесие этих процессов. С этого момента миофибробласты выполнили свою роль и начинают вступать в апоптоз, постепенно заменяясь нормальными фибробластами. До этого момента миофибробласты активно производили ингибитор металлопро-теиназ - TIMP, но теперь, с их уходом, временный внеклеточный матрикс начинает разрушаться и заполняться нормальными, переплетёнными в сложную сеть фибриллами коллагена I и III типов в комплексе с эластином. Это, однако, происходит только при условии, что отсутствуют стимулы для продолжения синтеза коллагена. При глубоких повреждениях или других причинах (продолжающееся воспаление, повторное физико-химическое воздействие, генетические дефекты) процесс производства коллагена не останавливается, становится неконтролируемым, что приводит к «избыточной репарации». При этом процессе миофибробласты не исчезают, а продолжают стягивание и сжимание внеклеточного матрикса, поскольку по-прежнему активный транскрипционный фактор TGF-β1 продолжает стимулировать модификацию нормального актина в его производную α-SMA (Hinz, 2016). В формирующейся фиброзной ткани преобладают коллагены I и III типов (Wells et al., 2016).
В случае особенно значительных повреждений кожи результатом репарации является гипертрофический шрам (рубец) (Chiang et al., 2016). Так, если после ожога участок не залечивается в течение 3 нед, у 50% пострадавших возникает необратимый фиброз с появлением гипертрофического шрама (Qian et al., 2016). Гистологический анализ показывает, что гипертрофический шрам отличается от «нормального» тем, что он содержит в основном фибронектин и коллаген III типа с гигантскими жёсткими фибриллами, расположенными параллельно поверхности эпидермиса (Martin et al., 2016). В нормальной коже коллагеновые фибриллы расположены практически перпендикулярно эпидермису (см. рис. 2.4). Гистологический анализ фиброзной ткани указывает на коллаген другого качества с образованием вследствие внутренних сшивок гораздо более жёстких фибрилл, которые ориентированы однонаправленно (Gurtner et al., 2008). Всё
Медицинские книги
@medknigi
это вызывает сжатие внеклеточного матрикса, механический стресс и воспаление, индуцирующее положительную обратную связь - начинается необратимый фиброз. При таком процессе происходит неконтролируемое образование фиброзной ткани, дальнейшее, уже не необходимое уплотнение дермы, которое приводит к нарушению её функционирования (Hinz, 2016). Так, механоэластичные свойства фиброзной структуры при повреждении кожи составляют менее 80% от свойств нормальной кожи (Morton et al., 2016). Это всегда необходимо знать практикующим врачам-дерматологам о возможных негативных последствиях проведения достаточно агрессивных косметологических процедур.
Первичным откликом организма на повреждение является реакция иммунной системы, запускающая активность ряда провоспалительных (проинфламаторных) клеток, в том числе макрофагов. В фиброзной ткани также отмечается присутствие макрофагов, которые, как предполагается, поддерживают процесс фиброза (Wynn, Vannella, 2016). Принципиальную роль воспаления в развитии фиброза показали исследования на мышах (Wong et al., 2012; Qian et al., 2016). У мышей с искусственно подавленной способностью к воспалительным реакциям заживление ран шло с минимальным образованием шрамов (Schwartzfarb, Kirsner, 2012).
Поэтому, преследуя цель добиться восстановления ткани без образования шрамов, нужно понять, какие именно разновидности макрофагов следует инактивировать. Так, например, одна субпопуляция макрофагов (названная М2) способна продуцировать коллаген I типа и фибронек-тин и стимулировать фиброз посредством трансформации фибробластов в миофибробласты через факторы TGF-β и PDGF (Wynn, Ramalingam, 2012). Другая субпопуляция (М1),
наоборот, ингибирует фиброз посредством активного продуцирования металлопротеиназ ММР-2, ММР-9 и ММР-12, разрушаюших фиброзный внеклеточный матрикс. Изучать формирование фиброза внутри человеческого организма на данный момент затруднительно по многим причинам, и одна из них - отсутствие молекулярных маркёров, которые были бы специфичны именно для фиброзной ткани. Вместе с тем уже сейчас формируется общий консенсус, что развитие фиброза в разных человеческих органах имеет общие ключевые этапы. Вследствие этого разрабатываются различные модельные системы как in vivo, так и in vitro (Zhang et al., 2015). Что касается животных моделей, то пока преждевременно судить, насколько близки к человеческим молекулярные процессы развития фиброза у лабораторных мышей и крыс. В этой области необходимы длительные рандомизированные клинические исследования, здесь без лабораторных животных, конечно, не обойтись, и, как было очень остроумно сказано в одной научно-популярной статье, «надейтесь, люди, держитесь, мыши!» Предстоит пройти путь сопоставления огромного количества информации о сходстве транс-криптом (глобальных карт транскрипции всего организма), протеом (глобальных карт трансляции белков всего организма), а также данных эпигенетики (Nanchahal, Hinz, 2016; Neary et al., 2015; Zeybel et al., 2017). Более того, всё больше внимания привлекает уникальная способность к регенерации значительных повреждений без образования фиброзной ткани у организма до рождения (внутриутробного
Медицинские книги
@medknigi
плода - фетуса) (Schwartzfarb, Kirsner, 2012). Характерной особенностью тканей плода является более высокая, чем у взрослого организма, доля коллагена III типа (Walmsley et al., 2015), и спектры активности ряда белков, участвующих в репарации, также значительно отличаются (Ho et al., 2014). В контексте вышесказанного очень интересны результаты недавних экспериментальных исследований, представленных в работе (Хабаров и др., 2018), где методами иммуногистохимического анализа изучали динамику экспрессии клетками кожи нейроэндокринных биомаркеров. В качестве объекта исследования служил операционный материал, полученный от 48-летней пациентки при пластической операции круговой подтяжки лица. Для иммуногистохимического исследования использовали следующие первичные моноклональные антитела: Collagen I,
Collagen III, MMP-9, Ki67. В качестве негативного контроля производилась иммуногистохими-ческая реакция без использования первичных антител. Специфичность антител подтверждали в контрольных экспериментах. Материалом для исследования стали 7 биоптатов - операционных образцов кожи человека с предварительно введёнными препаратами ГК с различными наполнителями. Все тестируемые гидрогели, относящиеся к классу биоревитализантов, в различных вариантах представляли собой ГК с концентрацией 0,8-1,0 масс.% в композиции с наночастицами золота, хлористым цинком, силикатом натрия, хлористым магнием, карнитином, липоевой и янтарной кислотами, глицином, гидрокси-пролином, лизином. Результаты экспериментальных исследований по влиянию препаратов ГК на экспрессию отдельных генов, кодирующих синтез коллагена I, III типов, матриксной металлопротеиназы (же-латиназы) ММР-9 и белка Ki67, представлены на рис. 5.13, А, Б, В, Г.
Очень важные, экспериментально установленные факты (Хабаров и др., 2018) состоят в том, что препараты 2, 6 и 7 стимулируют синтез коллагена III типа. По-видимому, происходит формирование временного внеклеточного матрикса за счёт значительно увеличенной доли фибронектина и коллагена III типа. При этом одновременно увеличивается количество металлопротеиназы ММР-9, которая, как уже упоминалось выше, разрушает фиброзный внеклеточный матрикс. Довольно невысокие уровни экспрессии белка Ki67 свидетельствуют о завершении роста клеточной популяции. [Ki67 - белок, экспрессия которого ассоциирована с пролиферацией клеток; уровень экспрессии этого белка является информативным показателем для определения интенсивности деления фибробластов кожи (Смирнова и др., 2005)]. Эти факты можно интерпретировать следующим образом. В связи с тем, что активный синтез коллагена III типа характерен для эмбриональных фибробластов, можно предполагать, что препараты 2, 6 и 7 увеличивают и/или ускоряют дифференцировку транзиторных стволовых клеток в повреждённых зонах кожи. Увеличение новых (возможно, юных) фибробластов и миофибробластов с активным геном коллагена III типа приводит к повышению коллагенеза и фибриллоге-неза на основе коллагена I и III типов, что и фиксируется маркерами к этим типам коллагена. Повышение активности ММР-9 (желатиназы) наблюдается при ремоделировании ткани (Рогова и др., 2011).
Медицинские книги
@medknigi

Рис. 5.13. Сравнение показателей относительной площади экспрессии маркеров коллаген I (А), коллаген III (Б), MMP-9 (В), Ki67 (Г) в образцах кожи с введёнными инъекционными материалами на основе ГК. Состав препаратов: 1 - «Голдгиал»: ГК 0,8% с НЧзолота; 2 - «Скинопротектор»: ГК 0,8%, хлористый цинк 0,025%; 3 - «Биоревитализант»: ГК 0,8%; 4 - «Тетраскил»: ГК 1,0%, карнитин 0,3%, липоевая кислота 0,2%, янтарная кислота 0,2%; 5 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%, гидроксипролин 0,3%,
хлористый магний 0,025%; 6 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%, гидроксипролин 0,3%, силикат натрия 0,025%; 7 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%, гидроксипролин 0,3%, хлористый цинк 0,025%
Медицинские книги
@medknigi

Рис. 5.13. Окончание. Сравнение показателей относительной площади экспрессии маркеров MMP-9 (В), Ki67 (Г) в образцах кожи с введёнными инъекционными материалами на основе ГК. Состав препаратов: 1 - «Голдгиал»: ГК 0,8% с НЧзолота; 2 - «Скинопротектор»: ГК 0,8%, хлористый цинк 0,025%; 3 - «Биоревитализант»: ГК 0,8%; 4 - «Тетраскил»: ГК 1,0%, карнитин 0,3%, липоевая кислота 0,2%, янтарная кислота 0,2%; 5 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%, гидроксипролин 0,3%, хлористый магний 0,025%; 6 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%, гидроксипролин 0,3%, силикат натрия 0,025%; 7 - «Ювента»: ГК 1,0%, лизин 0,3%, глицин 0,3%,
гидроксипролин 0,3%, хлористый цинк 0,025% матриксе с помощью металлопротеиназ ММР-1 и ММР-13. При этом стимулируется активность желатиназ ММР-2 и ММР-9 (Alameddine, Morgan, 2016). Образующиеся фрагменты водорастворимы. В межклеточном матриксе они денатурируют спонтанно и расщепляются дополнительно желатиназами (Fields, 2013; 2015).
Медицинские книги
@medknigi
После действия желатиназ большая часть мелких фрагментов коллагена I, II, III и IV типов поглощается клетками посредством эндоцитоза для дальнейшего расщепления до аминокислот в лизосомах. Аминокислоты используются фибробластами для синтеза нового коллагена. Таким образом, маркёры на коллаген III типа и матриксную металлопротеиназу ММР-9 указывают на стимуляцию ремоделирования дермы кожи препаратами 2, 6 и 7. Результаты этих исследований показывают важную роль ионов металлов в проявлении регуляторных функций: простыми методами ионных вариаций в составе гиалуронановых гидрогелей можно регулировать неоколлагенез и неофибриллогенез через активность металло-зависимых ферментов. Можно ожидать, что эти пока ещё единичные иммуногистохимические исследования по влиянию препаратов на основе гиалуронана на экспрессию различных генов в перспективе позволят сформировать стратегию индивидуального подхода для каждого пациента с учётом его возрастных особенностей.
Поскольку на избыточной активности миофибробластов лежит главная ответственность в развитии фиброза, идут поиски путей её остановки после завершения процесса репарации повреждения (Wynn, Ramalingam, 2012). Современные терапевтические подходы к подавлению активности миофибробластов показывают низкую эффективность. Обусловлено это главным образом тем, что, подобно фибробластам в нормальной ткани, в фиброзной ткани сосуществуют одновременно несколько типов миофибробластов с разной активностью (Driskell, Watt, 2015). Предполагается, что в предфиброзной и фиброзной тканях активны разные типы миофибробластов, и каждый тип имеет свои маркеры идентификации, однако пока такие маркеры не выявлены. Это важно для понимания того факта, какой именно тип (типы) клеток подавлять, поскольку активность миофибробластов абсолютно необходима на начальных этапах репарации раны. Соответственно, это затрудняет создание таргетных терапевтических средств.
В настоящее время на рынке или в клинических испытаниях находятся препараты против фиброза на основе следующих субстанций.
• Основной фактор роста фибробластов (Basic Fibroblast Growth Factor, bFGF,
FGF-2). Этот белок является конкурентом и антагонистом ключевого триггера появления миофибробластов - фактора трансформации TGF-β1. bFGF подавляет процесс модификации нормального цитоплазматического структурного белка актина в его производную a-SMA. • Интерферон IFN-γ. Этот цитокин производится Т-клетками и подавляет распространение воспаления и формирование α-SMA. •Interleukin IL-1. Этот цитокин подавляет функционирование уже образовавшегося α-SMA. •Ингибиторы активности гиалуронансинтетазы 2 (HYS2) и рецептора CD44. Оба этих белка проявляют существенно повышенную активность в фиброзных тканях (Хабаров, Бойков, 2016). Проводятся исследования и со многими другими субстанциями с целью ингибирования формирования фиброзов (Nanthakumar et al., 2015; Yoon et al., 2016). Так, например, подкожные инъекции гормона мелато-нина (1,2 мг на 1 кг веса) крысам с глубокими кожными ранами приводили к уменьшению размеров фиброзной ткани (Pugazhenthi et al., 2008). Мелатонин оказывает влияние на все
Медицинские книги
@medknigi
