
4 курс / Дерматовенерология / Коллаген_в_косметической_дерматологии_Хабаров_В_Н
.pdfPol. 2017. Vol. 64, N 2. P. 295-299. Kaminari A., Giannakas N., Tzinia A., Tsilibary E.C. Overexpression of matrix me-
talloproteinase-9 (MMP-9) rescues insulin-mediated impairment in the 5XFAD
model of Alzheimer's disease // Sci. Rep. 2017. Vol. 7, N 1. P. 683. Khavkin J., Ellis D.A. Aging skin: histology, physiology, and pathology // Facial Plast.
Surg. Clin. North Am. 2011. Vol. 19, N 2. P. 229-234. Kim C.R., Kim Y.M., Lee M.K., Kim I.H. et al. Pyropia yezoensis peptide promotes
collagen synthesis by activating the TGF-P/Smad signaling pathway in the human
dermal fibroblast cell line Hs27 // Int. J. Mol. Med. 2017. Vol. 39, N 1. P. 31-38. Kim J.A., Van Abel D. Neocollagenesis in human tissue injected with a polycaprolactonebased dermal filler // J. Cosmet. Laser Ther. 2015. Vol. 17, N 2. P. 99-101. Kim Z.H., Lee Y., Kim S.M., Kim H. et al. A composite dermal filler comprising cross-linked hyaluronic acid and human collagen for tissue reconstruction // J. Microbiol.
Biotechnol. 2015. Vol. 25, N 3. P. 399-406. Kligman A.M., Grove G.L., Hirose R., Leyden J.J. Topical tretinoin for photoaged
skin // J. Am. Acad. Dermatol. 1986. Vol. 15, N 4. Pt 2. P. 836-859. Knäuper V., López-Otin C., Smith B., Knight G. et al. Biochemical characterization of
human collagenase-3 // J. Biol. Chem. 1996. Vol. 271, N 3. P. 1544-1550.
Kruglikov I.L. Neocollagenesis in non-invasive aesthetic treatments // J. Cosmet. Dermatol. Sci. Appl. 2013. Vol. 3. P. 1-5. doi: 10.4236/jcdsa.2013.31A001. Published Online January 2013. URL: http://www.scirp.org/journal/jcdsa.
Kudo T., Takino T., Miyamori H., Thompson E.W. et al. Substrate choice of membrane-type 1 matrix metalloproteinase is dictated by tissue inhibitor of metallopro-teinase-2 levels // Cancer Sci. 2007. Vol. 98, N 4. P. 563-568.
Li J., Lin S.Y., Tang H.M. et al. Association study of MMP-9-1562C/T gene polymorphism with susceptibility to multiple autoimmune diseases: a meta-analysis // Arch. Med. Res. 2017. Vol. 48, N 1. P. 105-112.
Li Z., Takino T., Endo Y., Sato H. Activation of MMP-9 by membrane type-1 MMP/ MMP-2 axis stimulates tumor metastasis // Cancer Sci. 2017. Vol. 108, N 3. P. 347353.
Liang J., Pei X., Zhang Z., Wang N. et al. The protective effects of long-term oral administration of marine collagen hydrolysate from chum salmon on collagen matrix homeostasisin the chronological aged skin of Sprague-Dawley male rats // J. Food
Sci. 2010. Vol. 75. P. H230-H238.
Madala S.K., Pesce J.T., Ramalingam T.R., Wilson M.S. et al. Matrix metalloproteinase 12-deficiency augments extracellular matrix degrading metalloproteinases and attenuates IL-13-dependent fibrosis // J. Immunol. 2010. Vol. 184, N 7. P. 39553963. Malik R., Lelkes P.I., Cukierman E. Biomechanical and biochemical remodeling of stromal extracellular matrix in cancer // Trends Biotechnol. 2015. Vol. 33, N 4.
Медицинские книги
@medknigi
P. 230-236.
Manicone A.M., Gharib S.A., Gong K.Q., Eddy W.E. et al. Matrix metalloprotein- ase-28 is a key contributor to emphysema pathogenesis // Am. J. Pathol. 2017. Vol. 187, N 6. P. 1288-1300.
Manka S.W., Carafoli F., Visse R., Bihan D. et al. Structural insights into triplehelical collagen cleavage by matrix metalloproteinase 1 // Proc. Natl Acad. Sci. USA. 2012. Vol. 109, N 31. P. 12 461-12 466.
McKleroy W., Lee T.H., Atabai K. Always cleave up your mess: targeting collagen degradation to treat tissue fibrosis // Am. J. Physiol. Lung Cell Mol. Physiol. 2013. Vol. 304, N 11. P. L709-L721.
Melander M.C., Jürgensen H.J., Madsen D.H., Engelholm L.H. et al. The collagen receptor uPARAP/Endo180 in tissue degradation and cancer // Int. J. Oncol. 2015.
Vol. 47, N 4. P. 1177-1188.
Morry J., Ngamcherdtrakul W., Yantasee W. Oxidative stress in cancer and fibrosis: opportunity for therapeutic intervention with antioxidant compounds, enzymes, and nanoparticles // Redox Biol. 2016. Vol. 11. P. 240-253.
Mosig R.A., Dowling O., DiFeo A., Ramirez M.C. et al. Loss of MMP-2 disrupts skeletal and craniofacial development and results in decreased bone mineralization, joint erosion and defects in osteoblast and osteoclast growth // Hum. Mol. Genet. 2007. Vol. 16, N 9. P. 1113-1123.
Murphy G. Riding the metalloproteinase roller coaster // J. Biol. Chem. 2017. Vol. 292, N 19. P. 7708-7718.
Nagase H., Visse R., Murphy G. Structure and function of matrix metalloproteinases
and TIMPs // Cardiovasc. Res. 2006. Vol. 69, N 3. P. 562-573. Newby A.C. Metalloproteinase production from macrophages - a perfect storm leading
to atherosclerotic plaque rupture and myocardial infarction // Exp. Physiol. 2016.
Vol. 101, N 11. P. 1327-1337. Nigdelioglu R., Hamanaka R.B., Meliton A.Y., O'Leary E. et al. TGF-β promotes de
novo serine synthesis for collagen production // J. Biol. Chem. 2016. Vol. 291, N 53.
P. 27 239-27 251. doi: jbc.M116.756247.
Nkyimbeng T., Ruppert C., Shiomi T., Dahal B. et al. Pivotal role of matrix metalloproteinase 13 in extracellular matrix turnover in idiopathic pulmonary fibrosis // PLoS One. 2013. Vol. 8, N 9. Article ID e73279.
Ohuchi E., Imai K., Fujii Y., Sato H. et al. Membrane type 1 matrix metalloproteinase digests interstitial collagens and other extracellular matrix macromolecules // J. Biol. Chem. 1997. Vol. 272. P. 2446-2451.
Osako Y., Seki N., Kita Y., Yonemori K. et al. Regulation of MMP13 by antitumor microRNA-375 markedly inhibits cancer cell migration and invasion in esophageal squamous cell carcinoma // Int. J. Oncol. 2016. Vol. 49, N 6. P. 2255-2264.
Медицинские книги
@medknigi
Pavlaki M., Zucker S. Matrix metalloproteinase inhibitors (MMPIs): the beginning of phase I or the termination of phase III clinical trials // Cancer Metastasis Rev. 2003.
Vol. 22, N 2-3. P. 177-203.
Perles Z., Moon S., Ta-Shma A., Yaacov B. et al. A human laterality disorder caused by a homozygous deleterious mutation in MMP21 // J. Med. Genet. 2015. Vol. 52, N 12. P. 840-847.
Phillips T.M., Fadia M., Lea-Henry T.N., Smiles J. et al. MMP2 and MMP9 associate with crescentic glomerulonephritis // Clin. Kidney J. 2017. Vol. 10, N 2.
P. 215-220.
Qin Z., Voorhees J.J., Fisher G.J., Quan T. Age-associated reduction of cellular spreading/mechanical force up-regulates matrix metalloproteinase-1 expression and collagen fibril fragmentation via c-Jun/AP-1 in human dermal fibroblasts // Aging Cell. 2014. Vol. 13, N 6. P. 1028-1037.
Ra H.J., Parks W.C. Control of metalloproteinase catalytic activity // Matrix Biol. 2007.
Vol. 26. P. 587-596.
Radbill B.D., Gupta R., Ramirez M.C., DiFeo A. et al. Loss of matrix metallopro- teinase-2 amplifies murine toxin-induced liver fibrosis by upregulating collagen I expression // Dig. Dis. Sci. 2011. Vol. 56, N 2. P. 406-416.
Saarinen J., Welgus H.G., Flizar C.A., Kalkkinen N. et al. N-glycan structures of matrix metalloproteinase-1 derived from human fibroblasts and from HT-1080 fibrosarcoma cells // Eur. J. Biochem. 1999. Vol. 259. P. 829-840.
Sato H., Takino T. Coordinate action of membrane-type matrix metalloprotein-ase-1 (MT1-MMP) and MMP-2 enhances pericellular proteolysis and invasion // Cancer Sci. 2010. Vol. 101, N 4. P. 843-847.
Schmid D., Belser E., Meister S. Use of Soy Isoflavones for Stimulation of Skin Collagen Synthesis. Switzerland : Mibelle Biochemistry, 2008.
Shay G., Tauro M., Loiodice F., Tortorella P. et al. Selective inhibition of matrix me- talloproteinase-2 in the multiple myeloma-bone microenvironment // Oncotarget. 2017. Vol. 8, N 26. P. 41 827-41 840.
Shibuya S., Ozawa Y., Watanabe K., Izuo N. et al. Palladium and platinum nanoparticles attenuate aging-like skin atrophy via antioxidant activity in mice // PLoS One. 2014. Vol. 9, N 10. Article ID e109288.
Solomonov I., Zehorai E., Talmi-Frank D., Wolf S.G. et al. Distinct biological events generated by ECM proteolysis by two homologous collagenases // Proc. Natl Acad. Sci. USA. 2016. Vol. 113, N 39. P. 10 884-10 889.
Tam E.M., Moore T.R., Butler G.S., Overall C.M. Characterization of the distinct collagen binding, helicase and cleavage mechanisms of matrix metalloproteinase 2 and 14 (gelatinase A and MT1-MMP): the differential roles of the MMP hemopexin c
Медицинские книги
@medknigi
domains and the MMP-2 fibronectin type II modules in collagen triple helicase activities // J. Biol. Chem. 2004. Vol. 279. P. 43 336-43 344.
Taran K., Wnek A., Kobos J., Andrzejewska E. et al. Tissue and serum mRNA profile of MMPs-2/9 as a potential novel biomarker for the most individual approach in infantile hemangiomas and cancer disease // Immunobiology. 2017. Vol. 222, N 11.
P. 1035-1042. doi: S0171-2985(17)30098.
Tokito A., Jougasaki M. Matrix metalloproteinases in non-neoplastic disorders // Int. J. Mol. Sci. 2016. Vol. 17, N 7. Article ID E1178.
Turlier V., Delalleau A., Casas C., Rouquier A. et al. Association between collagen production and mechanical stretching in dermal extracellular matrix: in vivo effect of cross-linked hyaluronic acid filler. A randomised, placebo-controlled study //
J. Dermatol. Sci. 2013. Vol. 69. P. 187-94.
Uitto J., Kouba D. Cytokine modulation of extracellular matrix gene expression: relevance to fibrotic skin diseases // J. Dermatol. Sci. 2000. Vol. 24, suppl. 1. P. S60S69.
Van den Kerckhove E., Stappaerts K., Boeckx W., Van den Hof B. et al. Silicones in the rehabilitation of burns: a review and overview // Burns. 2001. Vol. 27. P. 205-214.
Van Doren S.R. Matrix metalloproteinase interactions with collagen and elastin // Matrix Biol. 2015. Vol. 44-46. P. 224-231.
Van Lint P., Libert C. Chemokine and cytokine processing by matrix metalloproteinases and its effect on leukocyte migration and inflammation // J. Leukoc. Biol. 2007.
Vol. 82. P. 1375-1381.
Verma S., Dixit R., Pandey K.C. Cysteine proteases: modes of activation and future
prospects as pharmacological targets // Front. Pharmacol. 2016. Vol. 7. P. 107. Verzijl N., DeGroot J., Thorpe S.R., Bank R.A. et al. Effect of collagen turnover on the
accumulation of advanced glycation end products // J. Biol. Chem. 2000. Vol. 275,
N 15. P. 39027-39031. doi: 10.1074/jbc.M006700200/ Warwick D., Arandes-Renú J.M., Pajardi G., Witthaut J. et al. Collagenase Clostridium
histolyticum: emerging practice patterns and treatment advances // J. Plast. Surg.
Hand Surg. 2016. Vol. 50, N 5. P. 251-261. Waterlow J.C., Stephen J.M.L. Adaptation of the rat to a low-protein diet: the effect
of a reduced protein intake on the pattern of incorporation of L-[14C] lysine // Br.
J. Nutr. 1966. Vol. 20, N 3. P. 461-484. doi: 10.1079/BJN19660047.
Wirtschaftler Z.O., Bentley A.S. The influence of age and growth rate on the extractable collagen of skin of normal rats // Lab. Invest. 1962. Vol. 11. P. 316-320.
Медицинские книги
@medknigi
Yamamoto K., Okano H., Miyagawa W., Visse R. et al. MMP-13 is constitutively produced in human chondrocytes and co-endocytosed with ADAMTS-5 and TIMP-3 by the endocytic receptor LRP1 // Matrix Biol. 2016. Vol. 56. P. 57-73.
Yu G., Kovkarova-Naumovski E., Jara P., Parwani A. et al. Matrix metalloprotein- ase-19 is a key regulator of lung fibrosis in mice and humans // Am. J. Respir. Crit. Care Med. 2012. Vol. 186, N 8. P. 752-762.
Zague V. A new view concerning the effects of collagen hydrolysateintake on skin properties // Arch. Dermatol. Res. 2008. Vol. 300. P. 479-483.
Zeng L., Rong X.F., Li R.H., Wu X.Y. Icariin inhibits MMP-1, MMP-3 and MMP-13 expression through MAPK pathways in IL-1P-stimulated SW1353 chondrosarcoma cells // Mol. Med. Rep. 2017. Vol. 15, N 5. P. 2853-2858.
Zhang Y., Stefanovic B. LARP6 meets collagen mRNA: specific regulation of type I collagen expression // Int. J. Mol. Sci. 2016. Vol. 17. P. 419-435.
Zhang Y.Z., Ran L.Y., Li C.Y., Chen X.L. Diversity, structures, and collagendegrading mechanisms of bacterial collagenolytic proteases // Appl. Environ. Microbiol. 2015. Vol. 81, N 18. P. 6098-6107.
Zhao Y., Marcink T.C., Sanganna Gari R.R., Marsh B.P. et al. Transient collagen triple helix binding to a key metalloproteinase in invasion and development // Structure. 2015. Vol. 23, N 2. P. 257-269.
Zigrino P., Brinckmann J., Niehoff A., Lu Y. et al. Fibroblast-derived MMP-14 regulates collagen homeostasis in adult skin // J. Invest. Dermatol. 2016. Vol. 136, N 8.
P. 1575-1583.
Zitnay J.L., Li Y., Qin Z., San B.H. et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides // Nat. Commun. 2017. Vol. 8. Article ID 14913.
Zucker S., Drews M., Conner C., Foda H.D. et al. Tissue inhibitor of metalloprotein- ase-2 (TIMP-2) binds to the catalytic domain of the cell surface receptor, membrane type 1-matrix metalloproteinase 1 (MT1-MMP) // J. Biol. Chem. 1998. Vol. 273, N 2. P. 1216-1222.
Медицинские книги
@medknigi
Глава 4. Естественная химическая трансформация коллагена и эластина, приводящая к постепенной деградации тканей
Кожа является тем органом, на котором наиболее наглядно прослеживаются процессы старения организма в целом. Совершенно очевидно, что свойства и функции кожных покровов с возрастом ухудшаются, что проявляется в постепенной деградации тканей. Причины этих негативных процессов связывают со множеством разнообразных, в том числе генетических и эпигенетических, факторов: снижением уровня регуляторных гормонов, падением скорости синтеза ГК и других гли-козаминогликанов, фрагментацией и дезориентацией коллагеновых и эластиновых волокон (Хабаров и др., 2012). Эти факторы в целом приводят к изменению структурных связей в межклеточном матриксе, что отрицательно сказывается на способности фибробластов нормально функционировать в дерме и производить коллаген и эластин (Cauble et al., 2015; Mora Huertas et al., 2016; Naval et al., 2014; Qin et al., 2014; Jung et al., 2015; Panich et al., 2016; Rinnerthaler et al., 2015; Sherratt, 2013;
Purohit et al., 2016; Guilbert et al., 2016; Weihermann et al., 2017). В совокупности это приводит к нарушению кожного гомеостаза и как следствие снижению тонуса кожных покровов (Tang et al., 2014; Varma et al., 2016). Конечными наглядными результатами являются атрофия, провисания, дряблость кожи, появление всё более заметных морщин.
Различного рода посттрансляционные модификации, которые претерпевают после синтеза в рибосомах практически все белки человеческого организма, совершенно обязательны для их нормального функционирования (Khoury et al., 2011). Эти процессы сложны и многообразны, протекают в норме с помощью различных ферментов под тщательным контролем множества эндогенных факторов. В случае коллагенового белка I типа именно посттрансляционные модификации формируют тройную спираль зрелой макромолекулы (Van den
Steen, 2001; Kadler, 2017).
Наряду с ферментативной модификацией внутриклеточные и внеклеточные белки претерпевают спонтанные локальные изменения своей химической структуры без участия ферментов (Vlassara et al., 1994; Ott et al., 2014; Panwar et al., 2016). Такие модификации по большей части, являются необратимыми и нерепарируемыми как собственными системами организма, так и современными лекарственными средствами (Tessier, 2010). Их появление и последующее накопление в зрелом коллагене происходит в результате избыточного образования поперечных ковалентных связей внутри и между коллагеновых фибрилл, что постепенно приводит к «старению» межклеточного матрикса и на молекулярном уровне проявляется в укрупнении, упрочнении, хрупкости коллагеновых и эластиновых фибрилл, волокон и пучков (Gkogkolou, Böhm, 2012; Golubev et al., 2017; Ahmed et al., 2017). Химические модификации коллагена и эластина, наиболее явно проявляющиеся при патологиях (диабет, гепатит, избыточное образование мочевины и др.), зависят от физиологической концентрации сахаров, мочевины, билирубина и некоторых других активных
Медицинские книги
@medknigi
метаболитов, диффундирующих в межклеточный матрикс. Описание основных известных на данный момент типов таких реакций приводится в настоящей главе. Хотя они могут оказывать влияние на гомеостаз практически всех органов и тканей в организме, ввиду сложности темы и малочисленности экспериментальных данных in vivo речь пойдёт в основном о коже.
4.1. ГЛИКИРОВАНИЕ
В норме преобладающей химической реакцией между восстанавливающими углеводами и свободными аминогруппами белков (реже - липидов) в организме человека является гликозилирование. В зависимости от того, к какому атому - азота или кислорода - присоединяется углевод, различают N- и O- гликозилирование соответственно. Оно может быть ферментативным или неферментативным, иметь место в различных структурах клетки, в цитоплазме и ядре. В качестве примера ферментативного гликозилирования (внутриклеточного, в цистернах ШЭР) можно привести модификацию остатков гидроксилизина при формировании а-цепей коллагена после завершения гидроксилирова-ния, но до спирализации (см. гл. 3). После образования тройной спирали проколлагена его внутриклеточное гликозилирование завершается. Фибриллогенез - формирование коллагеновых фибрилл из молекул тропоколлагена - происходит в межклеточном матриксе с помощью сходных ферментативных реакций гликозилирования. Структура образованных фибрилл стабилизируется путём формирования ковалентных сшивок молекул тропоколлагена (см. рис. 3.4, 3.7; Orgel et al., 2014). Ферментативное гликозилирование внеклеточных доменов мембранос-вязанных рецепторных белков регулирует константы связывания сигнальных молекул со своими рецепторами (Галенок и др., 1989).
Гликированием называют процесс добавления молекулы углевода к молекуле белка или липида, протекающий без участия ферментов. Чаще всего такими углеводами служат галактозилглюкоза или галактоза, реже - другие изомеры глюкозы: лактоза, фруктоза, рибоза, ман-ноза. Эти реакции, называемые реакциями Майяра (Maillard reactions), представляют собой сложные многоступенчатые процессы с участием карбонилсодержащих веществ и свободных аминогрупп белковых молекул. Различают обратимую и необратимую стадии последовательного ряда химических превращений (рис.
4.1).
При развитии реакции Майяра образуется большое количество промежуточных веществ, начиная с шиффовых оснований, которые далее подвергаются различным окислительным превращениям с формированием на заключительных стадиях темноокрашенных продуктов - мела-ноидинов (рис. 4.2).
Медицинские книги
@medknigi

Рис. 4.1. Схема принципиальных стадий реакции Майяра
Рис. 4.2. Последовательные стадии (шаги) возможных химических превращений в реакции Майяра
С химической точки зрения гликирование - это разновидность реакции карбонилирования, где карбонильная группа белка в пептидной связи выглядит следующим образом:
Неферментативные реакции карбонилирования осуществляются посредством так называемых активных карбонильных субстанций - RCS (reactive carbonyl species), которые образуются под влиянием АФК (ROS - активные окислительные субстанции) из двух основных источников - сахаров и липидов
Медицинские книги
@medknigi
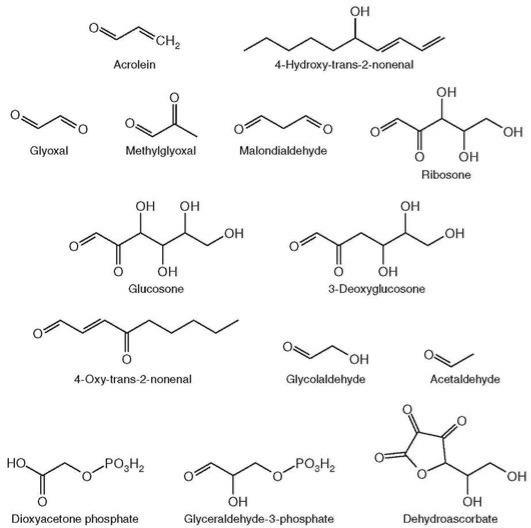
(рис. 4.3) (Dalle-Donne et al., 2006; Grimsrud et al., 2008; Pamplona, 2011; Wong et al., 2012; Noh et al., 2016).
В первом случае образуются AGE (Advanced Glycation End-products), а во втором - ALE (Advanced Lipoxidation End-products) (читателю следует иметь в виду, что нередко в научной литературе оба этих типа химических модификаций объединяют в один вид - AGE) (Visto-li et al., 2013). Образование AGE включает реакции между аргинином, лизином или цистеином и такими продуктами окисления углеводов, как глиоксаль (glyoxal, GO), метилглиоксаль
(methylglyoxal, MG) и 3-диоксиглюкозон (3-deoxyglucosone, 3-DG) (рис. 4.4).
Рис. 4.3. Структуры наиболее часто встречаемых биологических RCS
(Semchyshyn, 2014)
Формирование в молекуле белка (в том числе коллагена) ALE происходит посредством ковалентных связей с продуктами окисления липидов. В отличие от AGE, ALE формируются только одним путём - присоединения образованных после окисления липидов RCS к аргинину, лизину, гистидину или цистеину (Solis-Calero et al., 2015). Одним из наиболее изученных липидных производных
RCS является MDA (malondialdehyde):
Медицинские книги
@medknigi

Рис. 4.4. Химические сшивки в коллагене, образованные посредством различных AGE (Aldini et al., 2013): А - сшивки Lys-Arg; Б - сшивки Lys-Lys. GOLD - сшивки глиоксалем; MOLD - сшивки метилглиоксалем; GODIC - сшивки глиоксаль-имидазолем; MODIC - сшивки метилглиоксаль-имидазолем; Glucosepane - сшивки глюкозой
Процесс гликирования основного белка межклеточного матрикса, коллагена I типа, протекает в два этапа. Вначале глюкоза нефермен-тативно вступает в реакцию конденсации за счёт своей карбонильной (альдегидной) группы с различными аминогруппами и образует с ними шиффово основание (называемое также альдиминовым соединением или альдимином). Эта стадия реакции Майяра является обратимой. В дальнейшем эта промежуточная форма коллагена подвергается так называемой Амадори перегруппировке с образованием кетоамина. Эта стадия представляет собой необратимую реакцию с образованием гликированных продуктов - AGE - в результате последовательных реакций дегидратации (продукты пост-Амадори). Эти продукты очень устойчивы, их количество возрастает на протяжении всего многолетнего существования макромолекул зрелого коллагена. Следует отметить, что, кроме продуктов пост-Амадори, в организме протекают и другие реакции формирования AGE, на которых мы останавливаться не будем (Ishino et al., 2008; Ott et al., 2014; Davies, 2016; Wetzels et al., 2017). Отметим также, что кетоаминные связи с белками быстрее образуются с фосфатами сахаров. Так, гликозо-6-фосфат в 20 раз активнее глюкозы образует гликированный гемоглобин.
Медицинские книги
@medknigi
