
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (57)
.pdf
Содержание
Редакционная
В.Т. Ивашкин |
|
|
|
|
|
|
|
Иммунная система и повреждения печени при хронических гепатитах В и С....................... |
4 |
||||||
Оригинальные исследования |
|
|
|
|
|
|
|
В.Т. Ивашкин, Н.Л. Денисов |
|
|
|
|
|
|
|
Местный иммунитет и микробиоценоз при заболеваниях кишечника................................. |
11 |
||||||
В.Т. Ивашкин, А.А. Шептулин, А.С. Трухманов |
|
|
|
|
|
||
Клинические аспекты функциональной диспепсии и эффективность ганатона |
|
||||||
(итоприда гидрохлорида) в ее лечении.......................................................................... |
|
|
|
|
17 |
||
Е.В Онучина, Э.А. Горобец, А.А. Рожанский, В.В. Цуканов |
|
|
|
|
|||
Эффективность применения альгинатов в лечении изжоги у беременных.......................... |
23 |
||||||
С.А. Шутько, К.Р. Дудина, О.О. Знойко, Е.А. Климова, |
|
|
|
|
|||
В.И. Каширин, Д.С. Чешик, Н.Д. Ющук |
|
|
|
|
|
|
|
Клиническое значение динамического определения уровня вирусной нагрузки |
|
||||||
в крови у пациентов с естественным течением хронической HBV-моноинфекции................ |
28 |
||||||
С.Г. Шаповальянц, С.Е. Ларичев, М.Е. Тимофеев, Н.А. Солдатова |
|
|
|
||||
Оценка риска рецидива острой спаечной тонкокишечной непроходимости, |
|
||||||
разрешенной консервативным путем. |
............................................................................ |
|
|
|
|
34 |
|
Национальная школа гастроэнтерологов, гепатологов |
|
|
|
|
|||
Ю.О. Шульпекова, Е.К. Баранская |
|
|
|
RU |
|
||
|
|
|
|
|
|
||
Дифференциальная диагностика синдрома раздраженного кишечника |
|
||||||
и глютеновой энтеропатии |
|
|
|
. |
............................................ 39 |
||
....................................... |
|
-VESTI |
|
||||
Новости колопроктологии |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Е.Ю. Хомутова, Ю.Т. Игнатьев, В.Л. Полуэктов, Ю.Г. Филиппова |
|
|
|||||
Возможности виртуальной колоноскопии в скрининге колоректального рака |
|
||||||
и аденоматозных полипов............................................................................................ |
|
.M |
|
|
|
49 |
|
Методические рекомендации |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Дифференциальная диагностика и лечение болезни Вильсона.......................................... |
55 |
||||||
Обмен опытом |
WWW |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
М.В. Маевская |
|
|
|
|
|
|
|
Возможности применения пробиотиков в гастроэнтерологии. ........................................... |
|
65 |
|||||
Е.А. Федосьина, М.С. Жаркова, М.В. Маевская |
|
|
|
|
|
||
Бактериальная кишечная микрофлора и заболевания печени........................................... |
73 |
||||||
Информация |
|
|
|
|
|
|
|
Резюме диссертаций: информация из ВАК России.......................................................... |
|
|
|
82 |
|||
Перечень статей, опубликованных в 2009 г.................................................................... |
|
|
|
88 |
|||
Список авторов.......................................................................................................... |
|
|
|
|
|
|
91 |

Соntents
Editorials
V.T. Ivashkin |
|
|
|
|
Immune system and damages of liver at chronic hepatites B and C....................................... |
4 |
|||
Original investigations |
|
|
|
|
V.T. Ivashkin, N.L. Denisov |
|
|
|
|
Local immunodefence and microbiocenosis at bowel diseases............................................... |
11 |
|||
V.T. Ivashkin, A.A. Sheptulin, A.S. Trukhmanov |
|
|
|
|
Clinical aspects of functional dyspepsia and efficacy of ganaton |
|
|||
(itopride hydrochloride)............................................................................................... |
|
|
17 |
|
Ye.V Onuchina, E.A. Gorobets, A.A. Rozhansky, V.V. Tsukanov |
|
|
|
|
Efficacy of application of alginates in treatment of a heartburn at pregnant women............... |
23 |
|||
S.A. Shutko, K.R. Dudina, O.O. Znoyko, Ye.A. Klimova, V.I. Kashirin, |
|
|||
D.S. Cheshik, N.D. Yushchuk |
|
|
|
|
Clinical value of dynamic testing of viral load level in blood at patients |
|
|||
with natural course of chronic HBV-monoinfection........................................................... |
|
|
28 |
|
S.G. Shapoval’yants, S.Ye. Larichev, M.Ye. Timofeyev, N.A. Soldatova |
|
|||
Evaluation of risk of |
relapse of acute adhesive small-intestinal obstruction |
|
||
resolved in conservative way ........................................................................................ |
|
|
34 |
|
National college of gastroenterologist, hepatologist |
|
|
|
|
Yu.O. Shulpekova, Ye.K. Baranskaya |
|
RU |
|
|
|
|
|
||
Differential diagnostics of irritable bowel syndrome and celiac disease................................. |
39 |
|||
News of coloproctology |
|
. |
|
|
|
|
|
|
|
|
-VESTI |
|
|
|
Ye.Yu. Khomutova, Yu.T. Ignat’yev, V.L. Poluektov, Yu.G. Filippova |
|
|||
Potentials of virtual colonoscopy in screening of colorectal cancer |
|
|||
and adenomatous polyps............................................................................................... |
|
|
49 |
|
Guideline |
|
|
|
|
Differential diagnostics and treatment of Wilson disease.................................................... |
|
|
55 |
|
|
WWW |
|
|
|
Exchange of experience |
.M |
|
|
|
M.V. Mayevskaya |
|
|
|
|
Application of probiotics in gastroenterology................................................................... |
|
|
65 |
|
Ye.A. Fedosyina, M.S. Zharkova, M.V. Maevskaya |
|
|
|
|
Bacterial intestinal microflora and diseases of the liver...................................................... |
|
|
73 |
|
Information |
|
|
|
|
Thesis abstracts: information from the Higher attestation commission.................................. |
82 |
|||
The List of Articles published in 2009............................................................................ |
|
|
88 |
|
The List of Authors..................................................................................................... |
|
|
|
91 |

Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии
№ 6 • Том 19 • 2009
Russian Journal of
Gastroenterology,
Hepatology,
Coloproctology
Volume 19 • № 6 • 2009
Учредитель:
Российская
гастроэнтерологическая
ассоциация
Издатель:
ООО «Издательский дом «М-Вести»
E-mail: mvinfo@m-vesti.ru
Периодичность издания:
1 раз в 2 месяца
Тираж: 3000 экз.
Подписной индекс: 73538
Журнал зарегистрирован Комитетом РФ по печати 15.12.1994 г.
(Регистрационный № 013128)
Информация о журнале
находится в Интернете на сайтах
www.gastro-j.ru, www.m-vesti.ru
Адрес:
119146, г. Москва, а/я 31, «ГАСТРО», Российский журнал гастроэнтерологии,
гепатологии, колопроктологии
Телефон: 8-901562-2287
Эл. почта: editorial@gastro-j.ru
Журнал входит в Перечень ведущих научных журналов и изданий ВАК Министерства образования и науки России, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени доктора наук
Перепечатка материалов только с разрешения главного редактора и издателя
Ответственность за достоверность рекламных публикаций несут рекламодатели
Российский журнал гастроэнтерологии, гепатологии, колопроктологии
Состав редакционной коллегии и редакционного совета журнала
Главный редактор:
В.Т.Ивашкин
Исполнительный директор проекта:
Г.Г.Пискунов
Ответственный секретарь:
Т.Л.Лапина
(Эл. почта: editorial@gastro-j.ru)
Редакционная коллегия:
Е.К.Баранская А.О.Буеверов С.А.Булгаков П.С.Ветшев Г.И.Воробьев А.В.Калинин
(зам. главного редактора)
З.А.Лемешко А.Ф.Логинов И.В.Маев М.В.Маевская
(зам. главного редактора)
А.В.Охлобыстин |
RU |
|
А.С.Трухманов |
||
Ю.М.Панцырев |
|
|
С.И.Рапопорт |
. |
|
Ю.В.Тельных |
||
|
С.А.Чернякевич А.А.Шептулин
(зам. главного редактора)
Редакционный совет: |
|
|
С.А.Алексеенко |
-VESTIХабаровск |
|
О.Я.Бабак |
|
Харьков |
WWW |
|
|
Э.И.Белобородова.M |
Томск |
|
Э.Г.Григорян |
|
Ереван |
А.Р.Златкина |
|
Москва |
Г.Ф.Коротько |
|
Краснодар |
С.А.Курилович |
|
Новосибирск |
В.А.Максимов |
|
Москва |
С.Н.Маммаев |
|
Махачкала |
Ю.Х.Мараховский |
|
Минск |
Г.А.Минасян |
|
Ереван |
О.Н.Минушкин |
|
Москва |
И.А.Морозов |
|
Москва |
Ю.Г.Мухина |
|
Москва |
А.И.Пальцев |
|
Новосибирск |
Л.К.Пархоменко |
|
Харьков |
В.Д.Пасечников |
|
Ставрополь |
С.Д.Подымова |
|
Москва |
Г.В.Римарчук |
|
Москва |
В.И.Симоненков |
|
Санкт-Петербург |
А.В.Ткачев |
|
Ростов-на-Дону |
Е.Д.Федоров |
|
Москва |
И.Л.Халиф |
|
Москва |
Г.В.Цодиков |
|
Москва |
А.В.Шапошников |
|
Ростов-на-Дону |
Editor-in-chief:
V.T.Ivashkin
Production Manager:
G.G.Piskunov
Editorial Manager: T.L.Lapina
(E-mail: editorial@gastro-j.ru)
Editorial board:
Ye.K.Baranskaya
A.O.Bueverov
S.A.Bulgakov
P.S.Vetshev
G.I.Vorobiev
A.V.Kalinin
(deputy editor-in-chief) Z.A.Lemeshko A.F.Loginov I.V.Mayev M.V.Mayevskaya (deputy editor-in-chief) A.V.Okhlobystin Yu.M.Pantsyrev S.I.Rapoport Yu.V.Tel’nykh A.S.Trukhmanov S.A.Chernyakevich A.A.Sheptulin
(deputy editor-in-chief)
Editorial council: |
|
S.А.Alexeyenko |
Khabarovsk |
O.Ya.Babak |
Kharkov |
E.I.Byeloborodova |
Tomsk |
E.G.Grigoryan |
Yerevan |
A.R.Zlatkina |
Moscow |
G.F.Korot’ko |
Krasnodar |
S.A.Kurilovich |
Novosibirsk |
V.A.Maximov |
Moscow |
S.N.Mammaev |
Machachkala |
Yu.Kh.Marakhovsky |
Minsk |
G.A.Minasyan |
Yerevan |
O.N.Minushkin |
Moscow |
I.A.Morozov |
Moscow |
Yu.G.Mukhina |
Moscow |
A.I.Pal'tsev |
Novosibirsk |
L.K.Parkhomenko |
Kharkov |
V.D.Pasyechnikov |
Stavropol |
S.D.Podymova |
Moscow |
G.V.Rimarchuk |
Moscow |
V.I.Simonenkov |
Saint-Petersburg |
A.V.Tkachev |
Rostov-on-Don |
Ye.D.Fedorov |
Moscow |
I.L.Khalif |
Moscow |
G.V.Tsodikov |
Moscow |
A.V.Shaposhnikov |
Rostov-on-Don |

Редакционная |
6, 2009 |
УДК [616.36-002.12:578.891]-092
Иммунная система и повреждения печени при хронических гепатитах В и С
В.Т. Ивашкин
(Кафедра пропедевтики внутренних болезней Московской медицинской академии им. И.М. Сеченова)
Immune system and damages of liver at chronic hepatites B and C
V.T. Ivashkin
Цель обзора. Представить современные све- |
|
The aim of review. To present modern data on |
||
дения о роли адаптивного иммунитета в развитии |
|
a role of adaptive immunodefence in development of |
||
хронических вирусных повреждений печени и меха- |
|
chronic viral damage of liver and mechanisms of influ- |
||
низмы воздействия вирусов гепатитов В и С (HBV и |
|
|
RU |
|
|
ence of hepatitis viruses B and C (HBV and HCV) on |
|||
HCV) на функциональную активность цитотоксичес- |
|
functional activity of cytotoxic lymphocytes (CTL). |
||
ких лимфоцитов (CTL). |
|
|
. |
|
|
|
Original positions. There are some mechanisms of |
||
|
-VESTI |
|
||
Основные положения. Существует несколько |
|
HBV and HCV suppressing effect on immune response |
||
механизмов подавляющего влияния HBV и HCV на |
|
parts: exhaustion of virus-specific CTL functional activ- |
||
звенья иммунного ответа: истощение функциональ- |
|
ity as a result of persistence of high concentrations of |
||
ной активности вирусспецифических CTL в резуль- |
|
viral antigens; elevation of activity of regulatory Т-cells; |
||
тате персистенции высоких концентраций вирусных |
|
ability HBV to exist in the form of sustained endocellular |
||
антигенов; повышение активности регуляторных |
|
template – covalently closed circular DNA (ccc DNA); |
||
|
.M |
|
mutations of genome HCV, allowing «to escape» from |
|
Т-клеток; способность HBV к существованию в |
|
|||
форме устойчивой внутриклеточной матрицы – |
|
immune supervision; direct operation action of HCV |
||
|
WWW |
|
proteins on Т-cells. The role of activated platelets in |
|
ковалентно замкнутой циркулярной ДНК (ccc ДНК); |
|
|||
мутации генома HCV, позволяющие «ускользать» |
|
immunopathological reactions is also considered at |
||
от иммунного надзора; прямое действие белков |
|
chronic viral liver damage. |
||
HCV на Т-клетки. Рассматривается также роль акти- |
|
Conclusion. Application at chronic hepatitis B |
||
вированных тромбоцитов в иммунопатологических |
|
and C of up-to-date algorithms of antiviral therapy |
||
реакциях при хроническом вирусном повреждении |
|
including agents like interferon, ribavirin and nucleo- |
||
печени. |
|
|
tides/nucleosides analogues, does not allow to achieve |
|
Заключение. Применение при хронических |
|
at significant part of patients long-lasting suppression |
||
гепатитах В и С современных схем противовирус- |
|
of viral replication that can result in persistence of |
||
ной терапии, включающих препараты интерферона, |
|
replication HBV or HCV, activations of inflammatory |
||
рибавирин и аналоги нуклеотидов/нуклеозидов, не |
|
and necrotic processes in the liver, clinically manifest- |
||
позволяет у значительной части пациентов достичь |
|
ing as relapse of hepatitis with subsequent develop- |
||
стойкого подавлении вирусной репликации, что |
|
ment of liver cirrhosis and hepatocellular carcinoma. |
||
может приводить к персистенции репликации HBV |
|
Evaluation of efficacy of antiviral therapy with the help |
||
или HCV, активации воспалительно-некротических |
|
of dynamic assessment of viral load and other viral |
||
процессов в печени, клинически проявляющихся |
|
markers yields only indirect representation of activity |
||
обострением гепатита с последующим формиро- |
|
of pathological process. The recent scientific develop- |
||
ванием цирроза печени и гепатоцеллюлярной кар- |
|
ment offer idea of monitoring of parameters of innate |
||
циномы. Оценка эффективности противовирусной |
|
(congenital) and adaptive (acquired) immunodefence |
||
терапии с помощью динамического определения |
|
at patients with chronic viral hepatites at antiviral treat- |
||
вирусной нагрузки и других вирусных маркеров дает |
|
ment, and development of drugs, capable to sustain |
||
лишь косвенное представление об активности пато- |
|
quantitative and functional stability of virus-specific |
||
логического процесса. Новейшие научные разра- |
|
Т-cells. |
|
|
Ивашкин Владимир Трофимович – академик РАМН, доктор медицинских наук, профессор, зав. кафедрой пропедевтики внутренних болезней ГОУ ВПО ММА им. И.М. Сеченова Росздрава; контактная информация для переписки – v.ivashkin@gastro-j.ru; 119991, г. Москва, ул. Погодинская, д. 1, стр. 1, Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ГОУ ВПО ММА им. И.М. Сеченова Росздрава

6, 2009 |
Редакционная |
|
|
ботки предлагают идею мониторирования показателей иннатного (врожденного) и адаптивного (приобретенного) иммунитета у больных хроническими вирусными гепатитами в процессе противовирусного лечения, а также создание средств, способных поддерживать количественную и функциональную стабильность вирусспецифических Т-клеток.
Ключевые слова: вирусные гепатиты В и С, адаптивный иммунитет, вирусспецифические цитотоксические лимфоциты.
Key words: viral hepatites B and C, adaptive immunodefence, virus-specific cytotoxic lymphocytes.
Вирусные повреждения печени |
|
хроническом вирусном повреждении печени. Так, |
||
|
|
в исследовании M. Jannacone и соавт. продемонс- |
||
роникновение вируса гепатита В (HBV) |
трировано, что активированные тромбоциты при- |
|||
в организм человека приводит к разви- |
нимают участие в патогенезе повреждения печени |
|||
Птию острого или хронического гепатита, |
и клиренсе HBV и HCV с помощью привлечения |
|||
цирроза печени (ЦП) и гепатоцеллюлярной |
вирусспецифических CTL. В результате взаимо- |
|||
карциномы (ГЦК). Свыше 350 млн лиц, инфици- |
действия с тромбоцитами в синусоидах печени |
|||
рованных HBV, представляют собой источник его |
CТL могут выходить из сосудистого русла, дости- |
|||
распространения путем горизонтальной и верти- |
гать паренхиматозных клеток (например, гепато- |
|||
кальной передачи. HBV обладает способностью к |
цитов) и обеспечивать патогенетический и/или |
|||
репликации в гепатоцитах и не оказывает прямого |
противовирусный эффекты [7, 13]. |
|
||
цитопатического воздействия [7]. Повреждение |
Участие активированных тромбоцитов в при- |
|||
печени при HBV-инфекции имеет иммуноопосре- |
влечении вирусспецифических CTL дает основание |
|||
дованный характер [1]. Главная роль в развитии |
предположить, что фармакологическое воздействие |
|||
|
-VESTI |
|
|
|
иммунного ответа при инфицировании HBV при- |
на молекулы.RU, вовлеченные в активацию тромбоци- |
|||
надлежит реакциям адаптивного (приобретенного) |
тов, может предупредить миграцию CTL в печень |
|||
иммунитета, которые лежат в основе патогенеза |
и уменьшить степень повреждения гепатоцитов. |
|||
повреждений печени и клиренса HBV. Иннатный |
Экспериментальные исследования показали, что |
|||
(врожденный) иммунитет не вносит сколько |
комбинированная терапия низкими дозами аспи- |
|||
нибудь существенный вклад в последние. |
.M |
рина и клопидогреля (антитромбоцитарные препа- |
||
Основное значение в повреждении печени и |
раты, широко применяющиеся после проведения |
|||
разрешении HBV-инфекции принадлежит специ- |
чрескожных |
внутрикоронарных вмешательств у |
||
фическим цитотоксическим лимфоцитам (CTL). |
больных инфарктом миокарда или нестабильной |
|||
Персистенция HBV отражает неспособность CTL |
стенокардией) приводит к выраженному угнетению |
|||
к обеспечению адекватного иммунного ответа и |
обоих процессов [7]. При этом геморрагических |
|||
приводит к развитию хронического воспалительно- |
осложнений не отмечалось. Приведенные наблю- |
|||
некротического процесса в печени с последующим |
дения свидетельствуют, что, помимо предупреж- |
|||
формированием ЦП и/или ГЦКWWW[2]. Известно, |
дения чрезмерной активации иммунных реакций в |
|||
что ГЦК в большинстве случаев диагностируется |
печени (например, при фульминантном гепатите) |
|||
у пациентов с хроническим гепатитом В на фоне |
или замедления клиренса вирусов (что требует- |
|||
вялотекущего воспаления в печени и минималь- |
ся при проведении генной терапии посредством |
|||
ной деструкции гепатоцитов. Такое воспаление |
гепатотропных вирусных векторов), длительный |
|||
поддерживается функционально неполноценными |
прием аспирина и клопидогреля сопровождается |
|||
цитотоксическими вирусспецифическими Т-клет- |
«смягчением» тяжести CTL-индуцированного хро- |
|||
ками (CTL), не способными обеспечить клиренс |
нического повреждения печени и предупреждает |
|||
HBV в клетках печени. Таким образом, хрони- |
или замедляет темпы развития ГЦК. |
|||
ческое повреждение гепатоцитов вирусом гепа- |
У HBV-трансгенных мышей, представляющих |
|||
тита В рассматривается в качестве потенциально |
модель «здорового» носительства у человека, |
|||
предопухолевого процесса вследствие нарушения |
формируется |
иммунологическая |
толерантность |
|
баланса между регенерацией гепатоцитов (синтез |
к вирусным антигенам и не наблюдается разви- |
|||
клеточной ДНК) и воспалением (продукция мута- |
тия гепатита в течение жизни. При замещении |
|||
генов) [7, 13]. Длительный процесс регенерации и |
толерантной |
иммунной системы |
такой мыши |
|
воспаления в печени может приводить к возник- |
на иммунную систему сингенной нетрансген- |
|||
новению спонтанных и множественных генетичес- |
ной мыши, ранее иммунизированной белковыми |
|||
ких/хромосомных расстройств, ответственных за |
продуктами HBV, развивается CTL-зависимый |
|||
развитие ГЦК. |
|
хронический гепатит с низкой активностью, при- |
||
Помимо клеток иммунной системы в послед- |
водящий к возникновению ГЦК. Эти данные |
|||
ние годы установлена важная роль тромбоцитов в |
могут служить основой для разработки принци- |
|||

Редакционная |
6, 2009 |
пов применения антитромбоцитарных факторов в |
В основе такой эффективной системы самовос- |
|||||||||
качестве меры профилактики развития ГЦК. |
произведения лежит способность HBV создавать |
|||||||||
В настоящее время раскрыты многие механиз- |
очень стабильную эписомальную транскрипцион- |
|||||||||
мы немедленной активации и функционирования |
ную матрицу (рис. 1). |
|
|
|
|
|
||||
CD8+ Т-клеток при инфицировании HBV или |
Наличие большого количества вирусных анти- |
|||||||||
HCV. Вместе с тем менее понятна программа Т- |
генов, как правило, сопровождается нарастающей |
|||||||||
клеточной активности при персистенции вирусной |
недостаточностью (количественной и функци- |
|||||||||
инфекции. В этой связи рассматриваются кон- |
ональной) HВV-специфических Т-клеток, что |
|||||||||
цепции «истощения», «регуляции» и иммунного |
проявляется постепенным (в течение нескольких |
|||||||||
«ускользания» [8]. Под «истощением» понимают |
лет – десятилетий) уменьшением CD4+ и CD8+ |
|||||||||
феномен, отражающий дисфункцию CD4 и CD8 |
Т-клеточных популяций практически до неопре- |
|||||||||
Т-клеток при таких инфекциях, как HCV и ВИЧ. |
деляемого уровня. Недостаточность клеточного |
|||||||||
Угнетение функциональной активности Т-клеток |
иммунитета наблюдается у пациентов разных рас |
|||||||||
и их последующая гибель, наблюдаемые при |
(азиаты – европеоиды), инфицированных разны- |
|||||||||
высокой вирусной нагрузке, обусловлены экспрес |
ми генотипами HВV. При этом отмечается широ- |
|||||||||
сией молекулы программированной смерти-1 |
кий |
диапазон |
изменений |
HВV-специфических |
||||||
(Programmed Death-1, РD-1) активированными |
Т-клеток – от функциональной недостаточности |
|||||||||
и функционально неполноценными Т-клетками. |
вследствие угнетения потенциала пролиферации |
|||||||||
Роль этой молекулы при HCV-инфекции требует |
и снижения продукции цитокинов до избыточной |
|||||||||
дальнейшего изучения. В эксперименте установ- |
продукции проапоптогенных молекул [5]. |
|||||||||
лена специфическая экспрессия CD161 (рецептор |
До сих пор не вполне ясно, каким образом при |
|||||||||
NK) на HCV-специфических CD8+ Т-клетках, |
хронической HBV-инфекции вирусспецифичес- |
|||||||||
которая может иметь отношение к PD-1 [8, 10]. |
кие Т-клетки, недостаточные |
в количественном |
||||||||
Известно, что в угнетении вирусспецифичес- |
и функциональном отношениях, способны регу- |
|||||||||
кого иммунного ответа могут принимать участие |
лировать иммунологические процессы в печени. |
|||||||||
механизмы, подавляющие активность аутореак- |
Существует.RUмнение, что эпизоды обострения хро- |
|||||||||
тивных Т-клеток. Важная роль в этом процессе |
нического гепатита В отражают восстановление |
|||||||||
принадлежит Тreg клеткам. |
|
адекватного ответа HВV-специфических Т-кле- |
||||||||
Характерной особенностью HCV служит спо- |
ток. В целом указанная упрощенная точка зрения |
|||||||||
собность к «ускользанию» от иммунного ответа. |
не имеет экспериментальной основы и базируется |
|||||||||
Это свойство вируса |
при разработке лечебных |
на наблюдениях, указывающих на ограниченное |
||||||||
|
|
-VESTI |
|
|
|
|
|
|
||
стратегий может быть изменено, например, с помо- |
восстановление HВV-специфических Т-хелпер- |
|||||||||
щью снижения репликативной активности HCV. |
ных |
клеток непосредственно |
после обострения. |
|||||||
Противовирусные |
препараты |
.M |
Ранее было продемонстрировано, что HВV-спе- |
|||||||
позволяют |
||||||||||
осуществлять контроль вирусной репликации, |
цифический ответ CD8+ Т-клеток коррелирует со |
|||||||||
однако элиминация HBV наблюдается крайне |
способностью контролировать уровень виремии и |
|||||||||
редко. Причиной служит способность вируса к |
не коррелирует с выраженностью повреждения |
|||||||||
существованию в форме ковалентно замкнутой |
печени. Пока отсутствуют достоверные сведения |
|||||||||
циркулярной (covalently closedWWWcircular) ДНК |
об участии других компонентов иммунной систе- |
|||||||||
(сссДНК), которая может инициировать репли- |
мы, в частности иннатного иммунитета, и лишь в |
|||||||||
кацию HBV немедленно после прекращения про- |
последние годы получены данные о возможном |
|||||||||
тивовирусной терапии. Вследствие персистенции |
вовлечении NK-клеток при активации их цито- |
|||||||||
сссДНК элиминация HBV становится возможной |
кинами в процессе клеточного повреждения и |
|||||||||
лишь при индукции эффективного иммунного |
обострения хронического гепатита В [6]. |
|
||||||||
ответа. Подобный ответ может быть достигнут |
Понимание кинетики иммунного ответа при |
|||||||||
«настройкой» иммунной системы с помощью |
обострении хронического гепатита В |
возможно |
||||||||
иммуномодулирующих |
препаратов, |
адекватной |
с помощью анализа иммунологических показа- |
|||||||
вакцинацией или посредством Т-клеточной тера- |
телей |
после отмены |
противовирусной |
терапии |
||||||
пии с применением активированных или пере- |
(рис. 2). Известно, что препараты интерфе- |
|||||||||
программированных ex vivo Т-клеток [12]. |
рона-альфа (ИФН-α) и аналоги нуклеотидов/ |
|||||||||
|
|
|
нуклеозидов, подавляющие активность обратной |
|||||||
Иммунопатогенез HВV |
|
транскриптазы, |
в известной |
мере |
позволяют |
|||||
|
осуществлять контроль вирусной репликации, |
|||||||||
|
|
|
||||||||
Хроническая HВV-инфекция характеризуется |
однако элиминация |
HBV |
происходит |
редко. |
||||||
персистенцией в организме высоких концен- |
По этой причине прекращение противовирусной |
|||||||||
траций вируса (до 1010–12 копий ДНК/мл) и |
терапии приводит к быстрой активации репли- |
|||||||||
его частиц, содержащих поверхностный анти- |
кации HВV с последующим появлением кли- |
|||||||||
ген (HBsAg); продукция последних в 104–6 раз |
нических признаков обострения гепатита. Эти |
|||||||||
превышает концентрацию полных вирионов [4]. |
две фазы – активация репликации HBV и нача- |
|||||||||
|
|
6, 2009 |
|
|
Редакционная |
|
|
|
|
|
HBV |
|
|
|
|
|
1010–12 копий ДНК/мл |
|||
|
|
|
1014–18 частиц HBsAg/мл |
|||
|
|
ХРОНИЧЕСКИЙ ГЕПАТИТ |
|
НЕДОСТАТОЧНОСТЬ |
||
|
Репликация HBV |
|
|
АДАПТИВНОГО ИММУНИТЕТА |
||
|
|
|
Угнетение потенциала |
|||
|
cccДНК |
|
|
|||
|
|
|
пролиферации CTL печение |
|||
|
Активация синусоидальных тромбоцитов |
|
||||
|
|
Функциональная недостаточность CTL печени |
||||
|
|
|
|
|
||
|
|
|
ПРЕДОПУХОЛЕВЫЙ СТАТУС |
|||
|
|
|
Регенерация (пролиферация) гепатоцитов |
|||
|
|
|
Мутагенез |
|
||
|
|
|
Недостаточность апоптоза |
|||
|
|
|
Дисплазия гепатоцитов |
|||
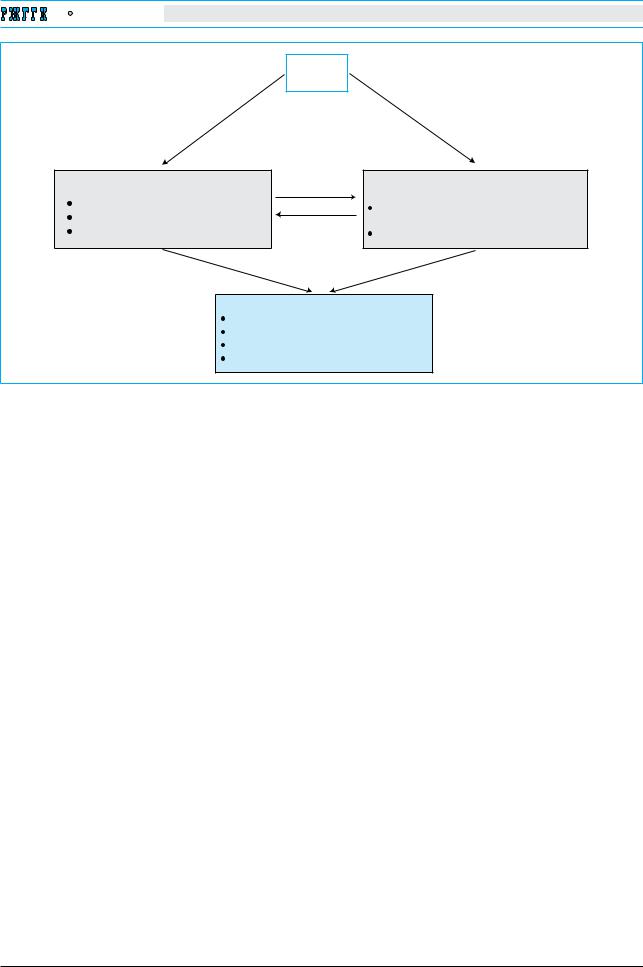
Рис.1. |
Патогенез хронического вирусного гепатита В. Высокая вирусная нагрузка служит ключевым фактором |
|||||
развития недостаточности адаптивного иммунитета, в частности цитотоксических Т-лимфоцитов (CTL) в пече- |
||||||
ни. Хронический воспалительно-некротический процесс в печени поддерживается постепенной репликацией |
||||||
|
|
|
|
|
. |
|
|
|
|
|
|
RU |
|
вируса на эписомальной (внехромосомной) матрице циклической ковалентно замкнутой циркулярной ДНК |
||||||
(cccДНК) и неспособностью функционально несостоятельных цитотоксических лимфоцитов печени элимини- |
||||||
ровать инфицированные вирусом клетки. Хроническое течение воспаления поддерживают активированные |
||||||
тромбоциты синусоидов, которые способствуют поступлению в печень цитотоксических лимфоцитов крови. |
||||||
Воспроизводство новых гепатоцитов сопровождается нарастанием мутаций в их геноме и диспластическими |
||||||
изменениями, а недостаточная элиминация гепатоцитов-VESTIс повреждением ДНК посредством апоптоза способ |
||||||
ствует возникновению предопухолевого статуса |
|
|||||
|
|
|
.M |
|
||
ло обострения гепатита – четко разграничены. |
у пациентов без активации репликации HВV |
|||||
В работе A. Bertoletti продемонстрировано, что |
(сохраняющийся контроль репликации) и при |
|||||
активация вирусной репликации после отмены |
отсутствии признаков повреждения печени. При |
|||||
противовирусного лечения не приводит к повреж- |
этом распознавание инфицированных гепатоцитов |
|||||
дению печени [4]. Иммунный ответWWWс появлением |
HВV-цитотоксическими лимфоцитами осущест- |
|||||
клинических признаков обострения гепатита раз- |
вляется посредством преимущественно CXCL-10 |
|||||
вивается лишь через 8–12 нед после отмены тера- |
и в меньшей степени CXCL-9; продукция гепа- |
|||||
пии. При этом иммунорегуляторные механизмы |
тоцитами последнего хемотоксина осуществляет- |
|||||
(например, IL-10 и Treg) не принимают участия |
ся дополнительными сигналами, регулируемыми |
|||||
в задержке иммунного |
ответа, так как уровни |
ИФН-α [9]. |
||||
IL-10 и Treg-лимфоцитов не повышаются немед- |
|
|||||
ленно |
после |
отмены |
противовирусных |
препа- |
Иммунопатогенез HCV |
|
ратов, а следуют за повышением активности |
||||||
|
||||||
аланинаминотрансферазы (АлАТ). Обострение |
Переходя к проблеме HCV-инфекции, следует |
|||||
хронического гепатита В отчетливо ассоциируется |
напомнить, что HCV представляет собой гепато |
|||||
с повышением в крови пациентов уровней хемо- |
тропный вирус, обладающий большим потенциа- |
|||||
токсинов CXCL-9 и CXCL-10, индуцируемых |
лом персистенции. HCV принадлежит к семейс- |
|||||
интерфероном-гамма (ИФН-γ) [9]. |
|
тву Flaviviridae, геном которого представлен |
||||
Сопоставление числа циркулирующих NK- |
покрытой оболочкой одноцепочечной спиральной |
|||||
клеток и вирусспецифических Т-клеток (наиболее |
РНК. В отличие от хорошо изученных структуры |
|||||
вероятных продуцентов ИФН-γ) не выявило зна- |
генов HCV, механизмов экспрессии полипротеи- |
|||||
чимой корреляции между активацией NK-клеток |
на и стадий процессинга, ранний и поздний этапы |
|||||
или наличием HВV-специфических Т-клеток и |
цикла репликации HCV нуждаются в дальнейшем |
|||||
началом обострения гепатита. Напротив, HВV- |
исследовании. Применение новых лаборатор- |
|||||
специфические Т-клетки обнаруживаются |
лишь |
ных технологий позволило получить интересные |
||||
Редакционная |
|
|
|
|
|
|
|
|
|
|
6, |
2009 |
|
|
Л е ч е н и е |
|
|
|
дукции интерферона I; |
|
core |
про- |
|||||
|
|
|
|
теин HCV (HCV core) может |
|||||||||
|
|
|
|
|
|||||||||
|
CTL(+) |
СХ СL 10 |
|
АлАТ |
блокировать |
|
реакции |
JAK-STAT |
|||||
АлАТ |
|
|
сигнального |
|
каскада, |
|
которые |
||||||
|
|
|
|
|
|
||||||||
[ДНК] |
|
CTL(–) |
ДНК |
служат важными звеньями в экс- |
|||||||||
|
прессии ISG. Помимо этого, HCV |
||||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||
Обратная |
|
|
|
|
может |
непосредственно |
противо- |
||||||
|
|
|
Обратная |
действовать специфическим фун- |
|||||||||
транскриптаза |
CTL(+) CTL(+) CTL(+) |
|
|||||||||||
|
|
транскриптаза |
кциям ISG (ингибировать проте- |
||||||||||
|
|
|
|
|
инкиназу R и 2′-5′ олигоаденилат- |
||||||||
|
|
|
|
|
синтетазу посредством NS5A и Е2) |
||||||||
|
|
|
|
|
и угнетать функцию компонентов |
||||||||
|
|
8–12 нед |
|
|
иннатного иммунитета – NK-кле- |
||||||||
|
|
|
|
ток и дендритных клеток. |
|
||||||||
|
|
|
|
|
|
||||||||
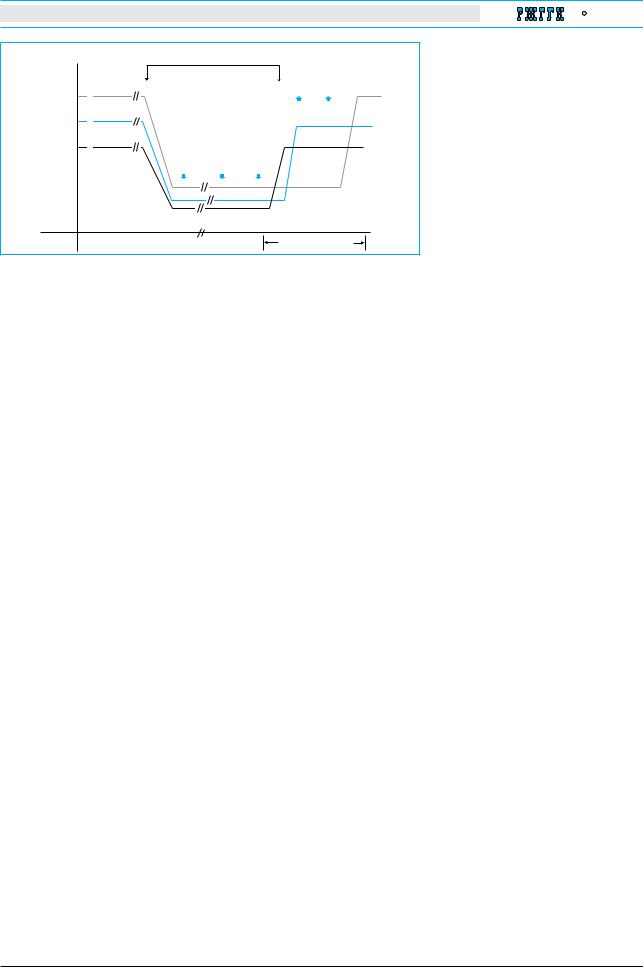
Рис. 2. Рецидив хронического гепатита В после отмены лечения. |
|
Вмешательство HCV в реак- |
|||||||||||
Прекращение противовирусной терапии сопровождается быстрым вос- |
ции иннатного иммунного ответа |
||||||||||||
становлением активности обратной транскриптазы и репликации DNA |
может |
приводить |
к нарушениям |
||||||||||
HBV. Однако начало обострения гепатита происходит через 8–12 нед |
в созревании клеток, осущест- |
||||||||||||
после отмены лечения. Этот процесс сопряжен с падением содержания |
вляющих адаптивный иммунитет, |
||||||||||||
HBV-специфических цитотоксических Т-клеток и с повышением в крови |
которые тесно взаимосвязаны с |
||||||||||||
пациентов хемокина CXCL-10, индуцируемого интерфероном-гамма |
активностью |
иннатного |
иммуни- |
||||||||||
|
|
|
|
|
тета. |
Результаты |
исследований |
||||||
данные. Например, оказалось, что липидные |
указывают на то, что, несмотря на раннее начало |
||||||||||||
структуры играют важную роль в морфогенезе |
репликации HCV, индукция HCV-специфических |
||||||||||||
вириона, и «сборка» HCV осуществляется в тес- |
Т-клеток происходит спустя продолжительный |
||||||||||||
ном контакте с молекулами липопротеинов очень |
временной.RUинтервал от момента инфицирования |
||||||||||||
низкой плотности (ЛПОНП) [3]. Установлено, |
[16]. HCV-специфические CD8-клетки с момента |
||||||||||||
что циклофилин обладает способностью активиро- |
их выявления отличает снижение эффекторных |
||||||||||||
вать механизм вирусной репликации. Связывание |
функций, что проявляется в недостаточной про- |
||||||||||||
циклофилина с помощью аналогов циклоспорина |
дукции ИФН-γ и ИЛ-2. |
|
|
|
|
|
|
||||||
ведет к подавлению репликации HCV в клеточ |
|
Спонтанный |
клиренс |
вирусной |
инфекции |
||||||||
|
|
-VESTI |
|
полноценным |
созреванием |
||||||||
ной культуре, а также у человека, что указы- |
характеризуется |
||||||||||||
вает на необходимость рассмотрения не |
только |
CD8-клеток памяти и проявляется в виде фено- |
|||||||||||
|
|
.M |
типа CD127+/CCR7+, а также восстановлением |
||||||||||
вирусных, но и преимущественно клеточных |
|||||||||||||
структур в качестве мишеней для терапевтичес- |
функций CD8 [15]. Этот процесс протекает |
||||||||||||
кого воздействия. Приведенные выше примеры |
при участии CD4-клеток, и, как показано в |
||||||||||||
демонстрируют различные клеточные механизмы |
ряде исследований, интенсивность опосредуе- |
||||||||||||
HCV, позволяющие осуществлять эффективную |
мых CD4-клетками реакций более выражена у |
||||||||||||
репликацию РНК, сборку вирусаWWWи приобретение |
пациентов с самоограничивающейся инфекцией |
||||||||||||
инфекционности (рис. 3) [3]. |
|
по сравнению с теми, у кого не наблюдалось |
|||||||||||
Несмотря |
на быструю активацию иннатно- |
спонтанного клиренса вируса. |
|
|
|
|
|||||||
го иммунитета в ответ на проникновение HCV |
|
В отличие от самоограничивающихся инфек- |
|||||||||||
в организм |
человека, распространение |
вируса |
ций при хронизации HCV-инфекции HCV-специ- |
||||||||||
и повышение его сывороточной концентрации |
фические CD8-клетки остаются функционально |
||||||||||||
происходит в течение нескольких суток после |
неполноценными с фенотипом PD-1/CD127–. |
||||||||||||
инфицирования [16]. Об этом свидетельствует |
Эта субпопуляция HCV-специфических CD127– |
||||||||||||
высокая вирусная нагрузка, обнаруживаемая уже |
и CD8+ Т-клеток доминирует в печени при дли- |
||||||||||||
в первые дни инфицирования. В основе этого |
тельных хронических инфекциях, тогда как боль- |
||||||||||||
феномена лежит способность HCV к включе- |
шая фракция HCV-специфических CD8-клеток |
||||||||||||
нию различных активных и комплементарных |
периферической крови имеет типичный CD127+ |
||||||||||||
механизмов, снижающих эффективность иннат- |
фенотип Т-клеток памяти. Этот феномен может |
||||||||||||
ного иммунитета [14]. В частности, блокиру- |
отражать более глубокое «истощение» функцио- |
||||||||||||
ется ряд этапов внутриклеточных сигнальных |
нальных возможностей внутрипеченочных Т-кле- |
||||||||||||
каскадов, необходимых для продукции интер- |
ток, что подтверждается более быстрым функци- |
||||||||||||
ферона I типа и экспрессии стимулируемого |
ональным восстановлением HCV-специфических |
||||||||||||
интерфероном гена (ISG). Продукт неструктур- |
CD8-клеток при обработке печеночных Т-клеток |
||||||||||||
ного гена NS3/4A может блокировать сигнальные |
антиPD-L1-антителами по сравнению с реакцией |
||||||||||||
пути, индуцируемые толл-подобным рецептором 3 |
Т-клеток периферической крови [11]. В дополне- |
||||||||||||
и R1G-1, которые обеспечивают активацию про- |
ние к феномену функционального «истощения» на |
||||||||||||
6, 2009 |
|
|
|
Редакционная |
||
|
ЛПОНП |
|
|
ЦИКЛОФИЛИН |
|
|
|
|
HCV |
|
|
|
|
ХРОНИЧЕСКИЙ ГЕПАТИТ |
|
|
НЕДОСТАТОЧНОСТЬ |
|
||
Репликация HСV |
|
|
ИННАТНОГО ИММУНИТЕТА |
|
||
|
Интерферон I типа |
|
|
|||
Мутации вирусного «ускользания» |
|
|
|
|||
|
Экспрессия ISG |
|
|
|||
|
|
|
|
|
||
НЕДОСТАТОЧНОСТЬ АДАПТИВНОГО |
|
Блокада сигналов от TLR |
|
|
||
|
Блокада JAK STAT сигнального каскада |
|
||||
|
ИММУНИТЕТА |
|
|
|||
Низкая эффекторная функция |
|
Ингибирование протеинкиназы R |
|
|||
|
Ингибирование 2' 5' олигоаденилатсинтетазы |
|||||
HCV специфических Т клеток |
|
|||||
(фенотип PD 1/CD127–; ИФН γ; IL 2) |
|
|
|
|
||
|
|
ПРЕДОПУХОЛЕВЫЙ СТАТУС |
|
|
|
|
|
Регенерация (пролиферация) гепатоцитов |
|
|
|||
|
Мутагенез |
|
|
|
|
|
|
Недостаточность апоптоза |
|
|
|
||
|
Дисплазия гепатоцитов |
|
|
|
||
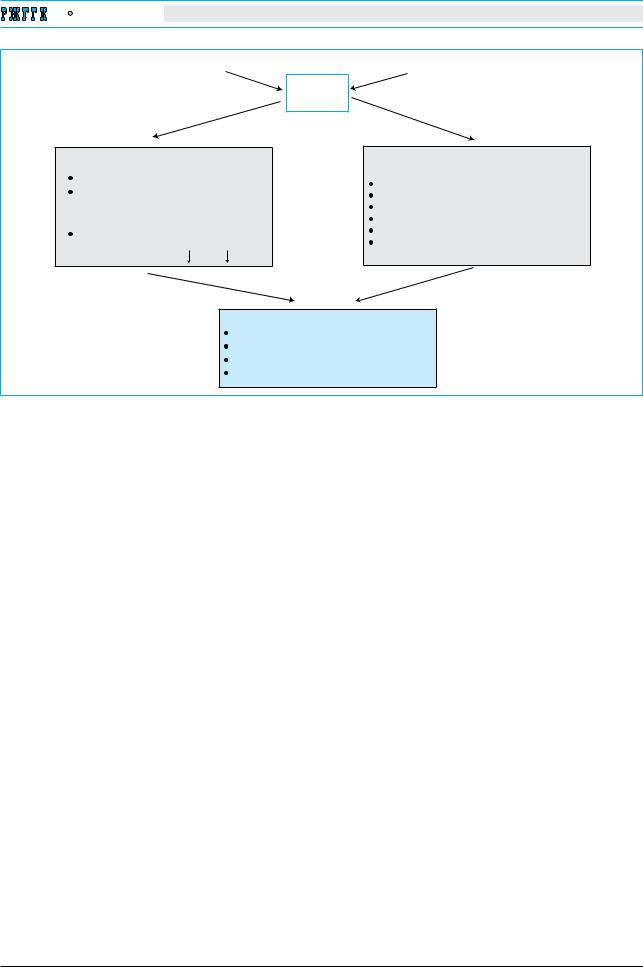
Рис. 3. Патогенез хронического вирусного гепатита С. В репликации вируса гепатита С принимают участие |
||||||
липопротеины очень низкой плотности (ЛПОНП) и цитоплазматический протеин циклофилин. Ключевым |
||||||
|
|
|
. |
|
|
|
механизмом устойчивой репликации HCV служит его способность коRUвсе новым мутациям и, следовательно, |
||||||
продукции «незнакомых» для гуморального и клеточного иммунитета антигенных эпитопов. Другим ключе- |
||||||
вым механизмом персистенции вирусной инфекции служит способность HCV к многочисленным угнетающим |
||||||
влияниям на иннатный иммунитет, что делает функционально несостоятельными клетки иннатной иммунной |
||||||
системы (NK-клетки, дендритные клетки, клетки Купффера). Функциональная недостаточность иннатного |
||||||
иммунитета сопряжена с подавлением эффекторной активности печеночных клеток адаптивного иммунитета |
||||||
|
|
-VESTI |
|
|
|
|
в частности HCV-специфических CD8+ Т-лимфоцитов. Длительная компенсаторная пролиферация гепатоци- |
||||||
тов в сочетании с недостаточностью апоптоза и недостаточностью иннатного и адаптивного иммунитета на |
||||||
|
|
.M |
|
|
|
|
уровне печени создает предпосылки для формирования предопухолевого статуса. |
|
|
||||
фоне персистирующей экспозиции высоких кон- |
вируса при хронической инфекции может быть |
|||||
центраций антигенов дополнительные механизмы, |
следствием механизмов мутантного «ускольза- |
|||||
включающие гиперактивность регуляторныхWWWТ-кле |
ния», позволяющих HCV избегать иммунной ней- |
|||||
ток, появление мутаций вирусного «ускользания» |
трализации. Это означает, что данные антитела |
|||||
и прямое ингибирующее воздействие белков HCV |
могут нейтрализовать лишь ранее существовав- |
|||||
на Т-клетки могут вызывать ослабление или пре- |
шие вирусные штаммы в отличие от нейтрализа- |
|||||
кращение ответа HCV-специфических Т-клеток |
ции мутантного вируса. |
|
|
|||
при хронической HCV-инфекции. |
|
Таким образом, размножение HCV обычно |
||||
Роль нейтрализующих антител в патогенезе |
опережает вируснейтрализующие иммунные реак- |
|||||
HCV-инфекции недавно обрела веское подтверж- |
ции вследствие динамичной кинетики репликации |
|||||
дение благодаря разработке метода получения |
нарушения |
антивирусной |
функции |
иннатного |
||
инфекционных ретровирус-HCV-псевдочастиц, |
иммунитета. Последующее распространение виру- |
|||||
продуцируемых комплексом оболочечных гли- |
са сопровождается включением дополнительных |
|||||
копротеинов HCV на основе core белка ретро- |
механизмов повреждения функций Т- и В-клеток, |
|||||
вируса (retroviral core). Данный метод позво- |
что дает HCV преимущество перед иммунной |
|||||
лил обнаружить нейтрализующие антитела при |
системой, увеличивая тем самым возможность |
|||||
острой форме заболевания, однако корреляция |
хронической персистенции. |
|
|
|||
между наличием антител и клиренсом вируса не |
|
|
|
|
||
вполне очевидна. |
Нейтрализующие |
антитела с |
Заключение |
|
|
|
широким спектром |
активности были |
выявлены |
|
|
||
|
|
|
|
|||
в высоких титрах также у пациентов с длитель- |
Повреждение печени при хронической HBV- |
|||||
но протекающей хронической HCV-инфекци- |
инфекции имеет иммуноопосредованный харак- |
|||||
ей. Сосуществование нейтрализующих антител и |
тер, так как вирус гепатита В не обладает пря- |
|||||

Редакционная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6, |
2009 |
|
|
|
||||||||||||||||
мым цитопатическим действием. Клиренс HBV |
титом В может приводить к активации репли- |
||||||||||||||||
и иммунное повреждение клеток печени осущест- |
кации HBV, сопровождающейся клинически- |
||||||||||||||||
вляется вирусспецифическими цитотоксическими |
ми и лабораторными проявлениями обострения. |
||||||||||||||||
лимфоцитами (CTL) адаптивной иммунной систе- |
Иммунопатологический ответ в виде обострения |
||||||||||||||||
мы. Персистенция HBV отражает неспособность |
гепатита чаще всего развивается через 8–12 нед |
||||||||||||||||
CTL удалять вирусы из организма, что иниции- |
после прекращения противовирусного лечения. |
||||||||||||||||
рует хроническую некровоспалительную реакцию |
Указанный временной интервал может рассмат- |
||||||||||||||||
в печени, приводящую в конечном итоге к разви- |
риваться |
в |
|
качестве «терапевтического окна», |
|||||||||||||
тию цирроза или ГЦК. Хроническое повреждение |
в пределах которого в случае обнаружения у |
||||||||||||||||
печени при HBV-инфекции представляет собой |
пациента |
количественного |
и |
|
функционального |
||||||||||||
потенциально предопухолевый процесс, протека- |
дефицита HBV-специфических CTL необходимо |
||||||||||||||||
ющий с нарушением баланса между регенерацией |
возобновить противовирусную терапию. |
|
|||||||||||||||
гепатоцитов и воспалением. |
|
|
|
|
При HCV-инфекции специфические CD8- |
||||||||||||
Роль активированных тромбоцитов в патогене- |
клетки обнаруживаются в печени спустя длитель- |
||||||||||||||||
зе хронического вирусного гепатита заключается |
ное время после попадания вируса в организм |
||||||||||||||||
в их способности привлекать в микроциркуля- |
человека. В этот период их функциональная |
||||||||||||||||
торное русло печени CTL. В качестве причин |
активность ограничена. При хронической инфек- |
||||||||||||||||
персистенции HBV и HCV рассматриваются сле- |
ции HCV-специфические CD8-клетки остают- |
||||||||||||||||
дующие механизмы: 1) дисфункция CD4+ и CD8+ |
ся функционально неполноценными. Другими |
||||||||||||||||
клеток вследствие длительной вирусной реплика- |
причинами «истощения» CTL при хронической |
||||||||||||||||
ции – концепция «истощения»; 2) дисфункция |
HCV-инфекции служат повышенная активность |
||||||||||||||||
регуляторных Т-клеток (Treg) – концепция «регу- |
регуляторных Т-клеток, мутации «ускользания» |
||||||||||||||||
ляции»; 3) «ускользание» HCV от цитотоксичес- |
HCV (virus escape) и прямое ингибирующее воз- |
||||||||||||||||
кого воздействия за счет исключительно высокой |
действие белков HCV на Т-клетки, что в целом |
||||||||||||||||
скорости мутагенеза |
– концепция |
иммунного |
приводит к ослаблению или неэффективности |
||||||||||||||
«ускользания». |
|
|
|
|
|
иммунного.RUответа HCV-специфических Т-кле- |
|||||||||||
Отмена ИФН-α или аналогов нуклеозидов/ |
ток. |
|
|
|
|
|
|
|
|
|
|
||||||
нуклеотидов у пациентов с хроническим гепа- |
|
|
|
|
|
|
|
|
|
|
|
||||||
Список литературы |
|
|
|
|
-VESTI9. Lang K.S., |
Georgiev P., |
|
Recher |
M. et al. Immuno |
||||||||
1. Ивашкин В.Т. Механизмы иммунной толерантности и |
privileged |
status of the |
liver |
is |
controlled by |
Toll- |
|||||||||||
like receptor 3 signalling |
// |
J. Clin. Invest. – |
2006. |
||||||||||||||
|
|
|
|
|
M |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
патологии печени // Рос. журн. гастроэнтерол.гепа- |
– Vol. 116. – P. 2456–2463. |
|
|
|
|
||||||||||||
тол. колопроктол. – 2009. – Т. 19, № 2. – С. 8–13. |
|
|
|
|
|||||||||||||
10. Lopes A.R., Kellam P., Das A. et al. Bim-mediated dele- |
|||||||||||||||||
2. Ивашкин В.Т. Основные понятия и положения фунда- |
|||||||||||||||||
tion of |
antigen-specific CD8 T cells in patients unable |
||||||||||||||||
ментальной иммунологии // Рос. журн. гастроэнтерол. |
|||||||||||||||||
to control |
HBV infection |
// |
J. Clin. Invest. – |
2008. |
|||||||||||||
гепатол. колопроктол. – 2008. – Т. 18, № 4. – С. |
|||||||||||||||||
– Vol. 118. – P. 1835–1845. |
|
|
|
|
|||||||||||||
3. Bartenschlager R. New insights |
the hepatitis |
C virus |
|
|
|
|
|||||||||||
11. Nakamoto N. et al. Functional restoration of HCV-specific |
|||||||||||||||||
replication cycle. Monothematic |
conference: |
Immune |
|||||||||||||||
CD8 T cells by PD-1 blockade is defined by PD-1 expres- |
|||||||||||||||||
|
|
WWW |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Mediated Liver Injury. – Hamburg, Germany, December |
sion and |
compartmentalization |
// Gastroenterology. |
||||||||||||||
4–6, 2008. |
|
|
|
|
|
||||||||||||
|
|
|
|
|
– 2008. – Vol. 134. – P. 1927–1937. |
|
|||||||||||
4. Bertoletti A. Immune pathogenesis of HBV. Monothematic |
|
||||||||||||||||
12. Protzer U. Virology of hepatitis B viruses. Monothematic |
|||||||||||||||||
conference: Immune Mediated Liver Injury. – Hamburg, |
|||||||||||||||||
conference: Immune Mediated Liver Injury. – Hamburg, |
|||||||||||||||||
Germany, December 4–6, 2008. |
|
|
|
|
|||||||||||||
|
|
|
|
Germany, December 4–6, 2008. |
|
|
|
||||||||||
5. Boni С., Fiscaro P., Valdatta C. et al. Characterization |
|
|
|
||||||||||||||
13. Rehermann B., Nascimbeni M. Immunology of hepatitis |
|||||||||||||||||
of hepatitis B virus (HBV) – specific T-cell dysfunction |
|||||||||||||||||
B and hepatitis C virus infection // Nat. Rev. Immunol. |
|||||||||||||||||
of chronic HBV infection // J. Virol. – 2007. – Vol. 81. |
|||||||||||||||||
– 2005. – Vol. 5. – P. 215–229. |
|
|
|||||||||||||||
– P. 4215–4225. |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
14. Saito T. et |
al. Regulation |
of |
innate immunity against |
|||||||||
6. Dunn C., Brunetto M., Reynolds G. et |
al. Cytokines |
||||||||||||||||
hepatitis C |
virus infection |
// |
Hepatol. Res. – |
2008. |
|||||||||||||
induced during chronic |
hepatitis |
B virus |
infection pro- |
||||||||||||||
– Vol. 38. – P. 115–122. |
|
|
|
|
|
|
|||||||||||
mote a pathway for NK all-mediated liver damage // J. |
|
|
|
|
|
|
|||||||||||
15. Urbani S. et al. Outcome of acute hepatitis C is related |
|||||||||||||||||
Exp. Med. – 2007. – Vol. 204. – P. 667–680. |
|
|
|||||||||||||||
|
|
to virus-specific CD4 function and maturation of antiviral |
|||||||||||||||
7. Iannacone M., Sitia G., Guidotti L. Platelets promote |
|||||||||||||||||
memory CD8 responses // Hepatology. – 2006. – Vol. |
|||||||||||||||||
liver injury induced by virus-specific CTL. Monothematic |
|||||||||||||||||
44. – P. 126–139. |
|
|
|
|
|
|
|||||||||||
conference: Immune Mediated Liver Injury. Hamburg, |
|
|
|
|
|
|
|||||||||||
16. Wieland S.F. et al. Intrahepatic induction of alpha/beta |
|||||||||||||||||
Germany, December 4–6, 2008. |
|
|
|
|
|||||||||||||
|
|
|
|
interferon |
eliminates viral |
RNA-containing capsids in |
|||||||||||
8. Klenerman Р.T. Cell responses in persistent virus infec- |
|||||||||||||||||
hepatitis B |
|
virus transgenic mice // J. Virol. – |
2005. |
||||||||||||||
tion. Monothematic conference: Immune Mediated Liver |
|
||||||||||||||||
– Vol. 79. – P. 9369–9380. |
|
|
|
|
|
||||||||||||
Injury. – Hamburg, Germany, December 4–6, 2008. |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
10
