

1
СМОЛЕНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Т.Г. Макаренко
КРАТКИЙ КУРС ЛЕКЦИЙ ПО БИОЛОГИЧЕСКОЙ ХИМИИ для студентов, обучающихся по специальности Педиатрия
Издание одобрено и рекомендовано к печати Центральным методическим советом Смоленской государственной медицинской академии

2
Смоленск
2014
УДК: 577.1 (071) ББК: 28.072 М 151
Рецензенты: доктор медицинских наук, профессор А.В. Евсеев кандидат медицинских наук, доцент В.В. Решедько
Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия. / Т.Г. Макаренко. Под редакцией Н.М. Стунжаса Смоленск. СГМА. 2014.- 166 с.
Пособие содержит краткое изложение учебного материала по биохимии, как входящего в лекционный курс, так и, предназначенного для самостоятельного изучения. В пособие вошли профильные вопросы по особенностям обмена веществ в детском возрасте. Тесты, ситуационные задачи для оценки степени усвоения материала представлены в ранее изданных учебно-методических пособиях для самостоятельной подготовки к занятиям по биологической химии для студентов, обучающихся по специальности Педиатрия. Дополнительный иллюстративный материал содержится в презентациях лекционного курса. Пособие может быть полезным и для студентов других факультетов, изучающих биохимию.

3
Учебное пособие рекомендовано Центральным методическим советом 1. СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки - высокомолекулярные полимерные азотсодержащие органические вещества, состоящие из аминокислот, соединённых пептидными связями, и имеющие сложную структурную организацию.
Термин «белки» обусловлен способностью данных соединений образовывать осадок белого цвета. Название «протеины» произошло от protos (греч.) – первый, важный, что отражает центральную роль этого класса веществ в организме.
1.1. Содержание белков в организме человека Содержание белков в тканях организма человека выше, чем содержание
липидов, углеводов. Оно составляет 18 – 20%. от общей массы тканей (сырой массы). Преобладание в тканях белков по сравнению с другими веществами наиболее наглядно выявляется при расчёте содержания белков на сухую массу тканей – 40 – 45%. Содержание белков в различных тканях колеблется в определённом интервале. Наиболее высоко содержание белков в скелетных мышцах (18 – 23% от сырой массы или 80% от сухой массы ткани). Низким содержанием белков отличается жировая ткань (6% сырой массы или 4% сухой массы ткани).
В детском возрасте общее количество белков в организме, их состав иные, чем у взрослых людей. В организме плода общее содержание белков не превышает 10% . У новорожденных детей оно составляет 10 – 12% массы тела. В период новорожденности наблюдается усиление процессов распада белков для энергетических целей. В силу этого содержание белков временно снижается. В раннем детском возрасте преобладают незрелые растворимые структурные белки. С возрастом усиливается их дифференцировка в зрелые функциональные белки.
1.2. Биологические функции белков Биологическая роль белков многообразна. Функции белков связаны с их
высокой специфичностью, способностью взаимодействовать с различными лигандами, рецепторами, структурами клеток.
∙Пластическая (структурная) функция – белки входят в состав всех клеточных структур вместе с нуклеиновыми кислотами, липидами,

4
углеводами.
∙Энергетическая функция - 1г белков обеспечивает образование более 4 ккал энергии.
∙Регуляторные функции:
а) ферментативная функция – более 2 тысяч белков являются биологическими катализаторами, регулируя скорость химических реакций в организме;
б) гормональная функция – некоторые гормоны, регулирующие биохимические и физиологические процессы в организме, относятся к белкам;
в) белки гистоны в составе хроматина регулируют активность генов ДНК; г) внутриклеточный белок кальмодулин регулирует активность различных
ферментов.
∙Защитная (иммунная) функция – такие белки как иммуноглобулины, интерферон, лизоцим обладают способностью связывать вещества, чужеродные для организма.
∙Специфические функции:
а) сократительная функция (белки мышц актин и миозин); б) фоторецепторная функция (белок сетчатки родопсин); в) свёртывание крови (фибриноген);
г) рецепторная функция – белки входят в состав клеточных рецепторов к биологически активным веществам.
1.3. Химический состав белков
1.3. 1. Элементарный состав белков Химический состав белков достаточно разнообразен. Основными
химическими элементами являются углерод (51 – 55%), кислород (21 – 23%), азот (16% - наиболее постоянная величина), водород (6- 7%) и непостоянный элемент сера (0,5 – 2%).
1.3.2. Аминокислотный состав белков Аминокислоты по химической природе являются производными
карбоновых кислот, в которых атом водорода в α – положении замещён на аминогруппу.. В состав природных белков входят α – аминокислоты, которые отличаются структурой радикала у α-углеродного атома.
Номенклатура аминокислот. Аминокислоты имеют обычно тривиальные названия. В составе белков и пептидов они обозначаются тремя первыми буквами их названия. Например, валин – вал, треонин – тре и т.д.

5
Классификация аминокислот.Аминокислоты классифицируют по структуре их углеводородного радикала и по полярности радикала аминокислот. Структура радикала и полярность аминокислот определяют характер образуемых ими связей в молекуле белка.
По структуре радикала выделяют 7 групп аминокислот:
∙аминокислоты, не имеющие радикала: глицин;
∙аминокислоты с углеводородным радикалом: аланин, валин, лейцин, изолейцин, фенилаланин, пролин;
∙аминокислоты, содержащие в радикале карбоксильную группу: глютаминовая, аспарагиновая кислоты, глютамин, аспарагин;
∙аминокислоты, содержащие в радикале аминогруппу: лизин, аргинин;
∙аминокислоты, содержащие в радикале гидроксильную группу: серин, треонин, тирозин, гидроксипролин, гидрокcилизин;
∙аминокислоты, содержащие в радикале тиогруппу: цистеин, цистин, метионин;
∙аминокислоты, содержащие гетероциклический радикал: гитидин, триптофан;
По полярности радикала аминокислоты делятся на две группы:
∙неполярные (гидрофобные) аминокислоты: аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, пролин, гидроксипролин, метионин;
∙полярные (гидрофильные) аминокислоты:
а) электронейтральные (незаряженные) аминокислоты: серин, треонин, цистеин, аспарагин, глютамин; б) кислые (отрицательно заряженные): глютаминовая, апарагиновая;
в) основные (положительно заряженные) аминокислоты: лизин, аргинин, гистидин.
1.4. Виды связей аминокислот в белках В молекуле белка различают прочные, ковалентные связи: пептидные,
дисульфидные и непрочные, нековалентные связи: водородные, ионные, вандерваальсовые, гидрофобные.
Пептидные связи
Пептидные связи (-СО-NН-) являются основным видом связей в белках. Впервые они были изучены А.Я. Данилевским (1888 г.). Пептидные связи образуются при взаимодействии α- карбоксильной группы одной аминокислоты и α - аминогруппой другой аминокислоты. Пептидная связь является сопряжённой связью, электронная плотность в ней смещена от азота к кислороду, в силу чего она занимает промежуточное положение между одинарной и двойной связью. Длина пептидной связи составляет 0,132 нм. Вращение атомов вокруг пептидной связи затруднено, атомы О и Н в ней находятся в транс-положении. Все атомы пептидной связи располагаются в одной плоскости. Атомы О и Н пептидной связи могут дополнительно образовывать водородные связи с другой пептидной связью. Пептидные связи определяют порядок чередования аминокислот в полипептидной цепи белка, т.е. формируют первичную структуру белка. Пептидные связи – прочные связи

6
(энергия разрыва составляет около 95 ккал/моль). Расщепление пептидных связей осуществляется при кипячении белка в присутствии кислот, щелочей или под действием ферментов пептидаз.
Дисульфидные связи
Дисульфидные связи (-S- S-) образованы двумя молекулами цистеина в составе белковой молекулы. Возможны внутрицепочечные дисульфидные «мостики» в пределах одной полипептидной цепи и межцепочечные связи между отдельными полипептидными цепями. Например, в молекуле гормона инсулина присутствуют оба варианта дисульфидных связей. Дисульфидные связи влияют на пространственную укладку белковой молекулы, т.е. на третичную структуру белков. Дисульфидные связи разрываются при действии некоторых восстановителей и при денатурации белка.
Водородные связи
Водородные связи возникают между атомом водорода и электроотрицательным атомом (чаще кислородом). Водородные связи примерно в 10 раз слабее пептидных связей. Наиболее часто они возникают между атомом Н и атомом О различных пептидных связей: либо близко расположенных в молекуле белка, либо находящихся в разных полипептидных цепях. Большое количество водородных связей фиксирует в белках в основном вторичную структуру (α - спираль и β - складчатую структуру) а также участвует в образовании третичной и четвертичной структур белка. Непрочные водородные связи легко разрываются при денатурации белка.
Ионные связи
Ионные связи образуются между противоположно заряженными аминокислотами в составе белковой молекулы (положительно заряженными лизином, аргинином, гистидином и отрицательно заряженными глютаматом и аспартатом). Ионные связи влияют на пространственную укладку белков, т.е. формируют третичную и четвертичную структуры белков. Ионные связи нарушаются при изменении рН среды, при денатурации.
Вандерваальсовые взаимодействия
Вандерваальсовые взаимодействия – разновидность связей, возникающих при кратковременной поляризации атомов.
Гидрофобные связи
Гидрофобные связи возникают между неполярными (гидрофобными) радикалами аминокислот в полярном растворителе (вода). Гидрофобные радикалы погружаются внутрь белковой молекулы, меняя пространственное расположение полипептидной цепи. Гидрофобные взаимодействия имеют энтропийную природу, придают устойчивость молекуле белка, участвуя в формировании его третичной, а также четвертичной структуры.
1. 5. Структурная организация белков Принято выделять четыре уровня структурной организации белков,
которые обозначаются как первичная, вторичная, третичная и четвертичная структуры белков.
1. 5. 1. Первичная структура белков

7
Первичная структура – порядок чередования аминокислот в полипептидной цепи.
Впервые первичная структура изучена в 1954 году Ф. Сенджером для гормона инсулина. Изучение первичной структуры представляет сложный процесс и включает два основных этапа: изучение аминокислотного состава и изучение последовательности соединения аминокислот в полипептидной цепи. 1. Изучение аминокислотного состава белка осуществляется путём его гидролиза до аминокислот. Для разрыва прочных пептидных связей между аминокислотами используют кислотный, щелочной и ферментативный гидролиз белка. Кислотный гидролиз осуществляется путём кипячения раствора белка с 6-нормальным раствором соляной кислоты в течение 16 - 92 часов. Щелочной гидролиз производится кипячением раствора белка с 2-4 нормальным раствором NaOH в течение 4 – 8 часов. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и щелочного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) по отсутствию положительной биуретовой реакции на пептидные связи и б) по окончанию прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп оценивают методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют хроматографическими методами, основанными на различных физико-химических свойствах аминокислот.
2. Исследование последовательности аминокислот в составе белка, в свою очередь, проводится различными методами. Белки с высокой молекулярной массой предварительно подвергаются частичному ферментативному гидролизу до коротких пептидов. Затем в полученных коротких пептидах определяются последовательно более доступные для исследования концевые аминокислоты, находящиеся или на N-конце, или на С-конце пептида.
С целью распознавания С - и N -концевых аминокислот применяются ферментативные методы. Ферменты аминопептидазы отщепляют от пептида N - концевую аминокислоту, которая определяется хроматографически. Ферменты карбоксипептидазы, отщепляют от белка С - концевую аминокислоту.
Аминопептидазы Карбоксипепетидазы
Наряду с |
ферментативными |
используются |
химические методы |
|
распознавания концевых аминокислот: |
|
|||
А) методы |
исследования |
N- |
концевых аминокислот заключаются в |
|
присоединении к N -концевой аминокислоте какой - то «химической метки» при помощи связи, более прочной, чем пептидная связь. При последующем гидролизе N- концевая аминокислота оказывается связанной с каким-либо химическим веществом. - меткой. С этой целью используют реактив Сенджера -
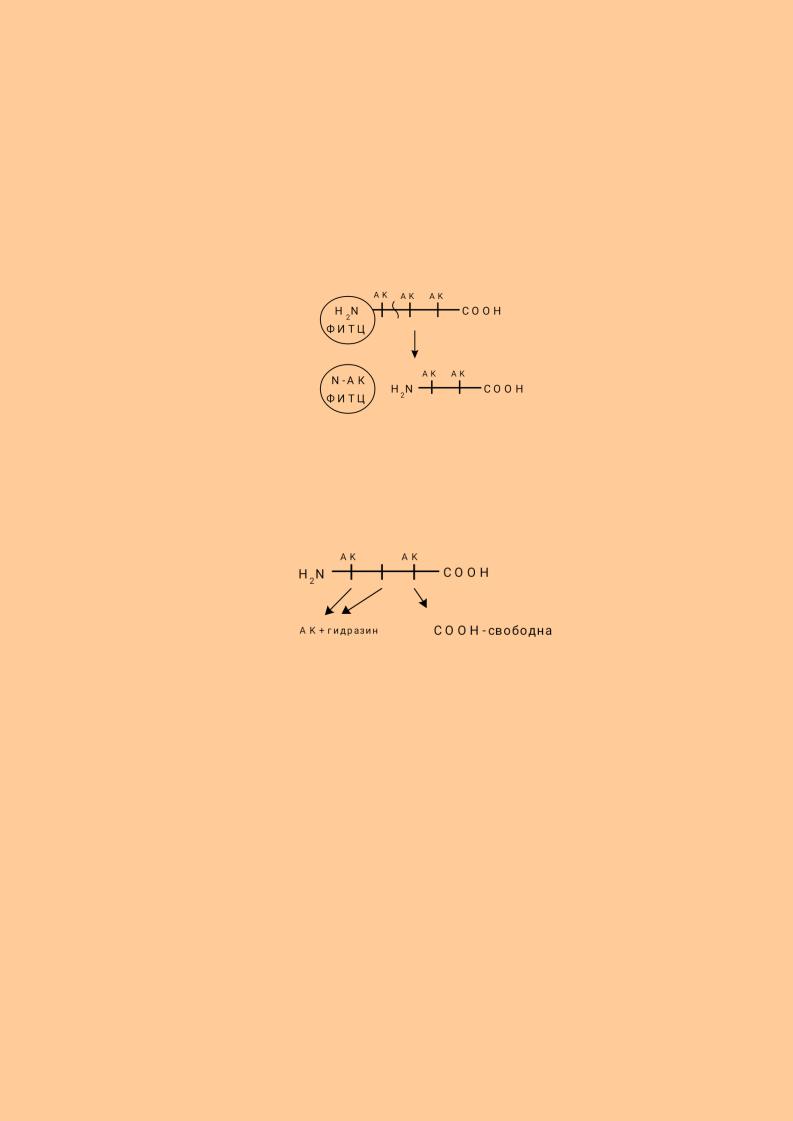
8
динитрофторбензол С6Н5(NO2)2F. Этот метод неудобен, тем, что он предполагает одноразовое исследование. В связи с этим чаще используют реактив Эдмана - фенилизотиоцианатнат С6Н5-N(S)=C. Одновременно с присоединением фенилизотиоцианата к N –концевой аминокислоте происходит образование циклического продукта и ослабление связи N-концевой аминокислоты с полипептидной цепью. С помощью последующего мягкого гидролиза осуществляется отщепление меченой N-концевой аминокислоты с сохранением остальной части белковой молекулы. Вторая аминокислота с N-конца в результате становится концевой и распознается повторным применением реактива (смотри схему).
Б) Методы распознавания С -концевой аминокислоты.
Метод Акобори заключается в использовании фенилгидразина.
Фенилгидразин разрывает пептидные связи в белке и присоединяется ко всем аминокислотам, кроме C-концевой. Последующий хроматографический анализ позволяет распознать С - концевую аминокислоту в составе белка (смотри схему).
Исследование первичной структуры имеет важное общебиологическое и медицинское значение:
1.Первичная структура является определяющей для последующих структур белка.
2.Знание первичной структуры белка необходимо для искусственного синтеза белков с заданными биологическими свойствами
3.Первичная структура определяет видовую специфичность белков, например, в белке инсулине, обычно в середине молекулы у различных видов животных и человека происходит замена, как правило, 3-х равноценных по свойствам радикалов аминокислот.
4.Изменения в первичной структуре могут причиной молекулярных патологий. Например, при серповидноклеточной анемии в гемоглобине в β - цепи в 6 положении глютаминовая кислота заменяется на валин. Эта замена на неравноценную по свойствам радикала аминокислоту приводит к нарушению функции гемоглобина и появлению серповидной формы эритроцитов.
Вбелковой молекуле при чередовании жестких (пептидная связь) и гибких (α -углеродный атом) участков формируется компактная укладка цепи в пространстве.

9
1. 5. 2. Вторичная структура белков Вторичная структура - регулярно повторяющаяся форма укладки
полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: α - спираль и β – складчатая структура.
α – спираль в 1951 году изучена Л. Полингом с помощью рентгеноструктурного метода. Она представляет собой правозакрученную спиральную структуру, в одном витке которой укладывается 3,6 аминокислоты. Шаг спирали (расстояние между соседними витками) составляет 0,54 н.м. α - спираль фиксируется водородными связями, которые замыкаются между пептидными связями, образованными каждой 4-ой аминокислотой. Вторичная α - структура укладывается самопроизвольно и определяется первичной структурой белка. Доля участков, уложенных в спиральную структуру, в различных белках различна. Например, в гемоглобине, миоглобине преобладает α - структурная укладка, которая в 4 раза уменьшает размеры белковой молекулы.
β – структура имеет вид «гармошки» и стабилизируется водородными связями между удалёнными участками одной полипептидной цепи или между несколькими полипептидными цепями. Выделяют параллельные β – структуры, в которых N и С-концы соответствуют друг другу, и антипараллельные структуры. Примером белков, содержащих преимущественно β – структуры, являются фиброин шёлка, иммуноглобулины.
Вторичная структура белков (А - α – спираль, Б - β – структура)
Вторичную структуру изучают методами рентгеноструктурного анализа, исследованием поглощения белком ультрафиолетовых лучей (чем больше доля

10
α – структур, тем больше поглощение).
Вторичная структура белков разрушается при денатурации.
1. 5. 3. Третичная структура белков Третичная структура - специфическая для каждого белка форма укладки
полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки раз увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные (дисульфидные) связи, изображённые на рисунке.
Третичная структура определяет биологическую активность и некоторые физико-химические свойства белков. Изменения в третичной структуре белка отражается на его биологической активности.
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической доступности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят α - спиральные, β - складчатые структуры, β- петли (в них полипептидная цепь изгибается на 1800) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% α - спиральных участков, 6% β- складчатых структур, 10% молекулы уложены в виде β - петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной структур составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно, и её образование носит название фолдинг. Конформация белков очень не устойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по их молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
