

31
2.6.2. Высокая специфичность ферментов Все ферменты обладают специфичностью, однако степень специфичности
в разных ферментах различна. Выделяют несколько видов специфичности ферментов.
Абсолютная субстратная специфичность, при которой фермент действует только на одно определённое вещество. Например, фермент уреаза расщепляет только мочевину.
Абсолютная групповая специфичность, при которой фермент оказывает один и тот же каталитический эффект на группу соединений, близких по структуре. Например, фермент алкогольдегидрогеназа окисляет не только С2Н5ОН, но и его гомологи с большим числом углеродных атомов,
Относительная групповая специфичность, при которой фермент осуществляет катализ разных классов органических веществ. Например, фермент трипсин проявляет пептидазную и эстеразную активность.
Стереохимическая специфичность (оптическая специфичность), при которой расщепляется только определённая форма изомеров (D, L формы, α, β, цис - трансизомеры). Например, ЛДГ действует только на L-лактат, L-аминокислотоксидазы действуют на L-изомеры аминокислот.
Высокая специфичность объясняется уникальной для каждого фермента структурой активного центра. Она имеет важное биологическое значение, поскольку обеспечивает упорядоченность химических процессов в организме. Специфичность ферментов лежит в основе их обнаружения в тканях и биологических жидкостях.
2.6.3. Термолябильность ферментов Термолябильность - зависимость активности ферментов от температуры.
При повышении температуры от 00 до 400С активность ферментов возрастает согласно правилу Вант-Гоффа (при возрастании температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза). При дальнейшем повышении температуры активность ферментов начинает снижаться, что объясняется тепловой
денатурацией белковой молекулы фермента. Графически термозависимость ферментов
изображена на рисунке:
Инактивация фермента при 00С обратима, а при высокой температуре инактивация приобретает необратимый характер. Это свойство ферментов определяет максимальную скорость реакции в условиях температуры тела человека. Термолябильность ферментов должна учитываться
в практической медицинской деятельности. Например, при проведении ферментативной реакции in vitro, необходимо создавать оптимальную температуру. Это свойство ферментов может быть применено в криохирургии, когда сложная длительная операция проводится при снижении температуры тела, что замедляет скорость протекающих в организме реакций, снижает

32
потребление кислорода тканями. Хранить ферментативные препараты необходимо при пониженной температуре. Для разрушения ферментов микроорганизмов используют высокие температуры (автоклавирование операционного материала, кипячение инструментария).
2.6.4. Фотолябильность ферментов Фотолябильность – чувствительность ферментов к действию
ультрафиолетовых лучей. УФЛ вызывают фотоденатурацию белковых молекул и уменьшают активность ферментов. Это свойство ферментов используют в бактерицидном эффекте ультрафиолетовых ламп.
2.6.5.Зависимость активности ферментов от рН.
Увсех ферментов есть определённый интервал рН, в котором активность фермента максимальна - оптимум рН. Для многих ферментов оптимум около 7. В то же время, для пепсина оптимальная среда 1-2, для щелочной фосфатазы около 9. При отклонении рН от оптимума активность фермента снижается, что видно из графика. Это свойство ферментов объясняется изменением ионизации ионогенных групп в молекулах фермента, что ведёт к
изменению ионных связей в молекуле белковой молекулы фермента. Это сопровождается изменением конформации молекулы фермента, а это, в свою очередь, приводит
к изменению его активности. В условиях организма рНзависимость определяет максимальную активность ферментов. Данное свойство находит и практическое применение. Ферментативные реакции вне организма проводятся при оптимуме рН. При сниженной кислотности желудочного сока с лечебной целью назначают раствор НСl.
2.6. 6. Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
Зависимость скорости реакции от концентрации фермента и концентрации субстрата (кинетика ферментативных реакций) представлена соответственно на графиках.
График 1 График 2
Вферментативной реакции выделяют скорости трёх составляющих этапов:
1.образование фермент-субстратного комплекса FS;

33
2.обратный распад фермент – субстратного комплекса;
3.распад фермент-субстратного комплекса с образованием продуктов реакции.
Скорость каждой из этих реакций подчиняется закону действующих масс: V1 = К1 [F] ·[S]
V2 = K2 [FS]
V3 = K3 [FS]
В момент равновесия скорость реакции образования FS равна сумме скоростей его распада: V1=V2+V3. Из трёх этапов ферментативной реакции наиболее важным и медленным является третий, так как он связан с образованием продуктов реакции. По приведенной выше формуле найти скорость V3 невозможно, так как ферментсубстратный комплекс очень неустойчив и измерение его концентрации затруднено. В связи с этим, Л. Михаэлис, М.Ментен ввели константу Михаэлиса - Кm и преобразовали уравнение для измерения V3 в новое уравнение, в котором присутствуют реально измеримые величины. Ниже представлены два варианта данного уравнения
[F0] – исходная концентрация фермента; Кm – константа Михаэлиса.
Физический смысл Кm: Кm = (К2+К3) /К1, т.е. она показывает соотношение констант скоростей распада фермент-субстратного комплекса и константы скорости его образования.
Уравнение Михаэлиса-Ментен является универсальным. Оно иллюстрирует зависимость скорости реакции от [F0] от [S].
1.Зависимость скорости реакции от концентрации субстрата. Эта зависимость выявляется при малых концентрациях субстрата [S]<Km. В этом случае
концентрацией субстрата в уравнении можно пренебречь и уравнение
приобретает вид:  .В данном уравнении K3,[F0],Km – константы и могут быть заменены новой константой К*. Таким образом, при малой концентрации субстрата скорость реакции прямо пропорциональна этой концентрации V3 = K* · [S]. Эта зависимость соответствует первому участку графика 2.
.В данном уравнении K3,[F0],Km – константы и могут быть заменены новой константой К*. Таким образом, при малой концентрации субстрата скорость реакции прямо пропорциональна этой концентрации V3 = K* · [S]. Эта зависимость соответствует первому участку графика 2.
2.Зависимость скорости от концентрации фермента проявляется при высокой
концентрации субстрата. S > Km. В этом случае можно пренебречь Km и
уравнение преобразуется в следующее: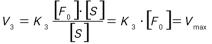 . Таким образом, при высокой концентрации субстрата скорость реакции определяется концентрацией фермента и достигает максимального значения
. Таким образом, при высокой концентрации субстрата скорость реакции определяется концентрацией фермента и достигает максимального значения

34
V3 = K3[F0]=Vmax.(третий участок графика 2).
3.Уравнение позволяет определить численное значение Km при условии  . В этом случае оно приобретает вид:
. В этом случае оно приобретает вид:  , откуда следует,
, откуда следует,
что Km=[S]
Таким образом, Кm численно равна концентрации субстрата при скорости реакции, равной половине максимальной. Кm является очень важной характеристикой фермента, она измеряется в молях (10-2 – 10-6 моль) и характеризуют специфичность фермента: чем ниже Km, тем выше специфичность фермента.
Графическое определение константы Михаэлиса возможно на графике зависимости скорости ферментативной реакции от концентрации фермента (слева).
Удобнее использовать график, представляющий прямую линию. Такой график предложен Лайнуивером – Берком (график двойных обратных величин), который соответствует обратному уравнению Михаэлиса – Ментен (справа)
 .
.
2.6.7. Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
2.6.7.1. Влияние активаторов ферментов Активаторы – вещества, повышающие скорость ферментативных реакций.
Различают специфические активаторы, повышающие активность одного фермента (НСl - активатор пепсиногена) и неспецифические активаторы, увеличивающие активность целого ряда ферментов (ионы Mg – активаторы гексокиназы, К, Na –АТФ-азы и ряда других ферментов). В качестве активаторов могут служить ионы металлов, метаболиты, нуклеотиды.
Механизм действия активаторов может быть различным.
1.Достраивание активатором активного центра фермента, в результате чего облегчается взаимодействие фермента с субстратом. Таким механизмом обладают в основном ионы металлов.
2.Аллостерический активатор взаимодействует с аллостерическим участком (субъединицей) фермента, через его изменения опосредованно изменяет структуру активного центра и увеличивает активность фермента.

35
Аллостерическим эффектом обладают метаболиты ферментативных реакций, АТФ.
3.Аллостерический механизм может сочетаться с изменением олигомерности фермента. Под действием активатора происходит объединение нескольких субъединиц в олигомерную форму, что резко увеличивает активность фермента. Например, изоцитрат является активатором олигомерного фермента ацетил-КоА карбоксилазы.
4.Фосфолирирование - дефосфолирирование ферментов относится к обратимой модификации ферментов. Присоединение Н3РО4 чаще всего резко увеличивает активность фермента. Например, два неактивных димера фермента фосфорилазы соединяются с четырьмя молекулами АТФ и образуют активную тетрамерную фосфорилированную форму фермента. Фосфолирирование ферментов может сочетаться с изменением их олигомерности. В некоторых случаях фосфорилирование фермента, наоборот, снижает его активность (например, фосфорилирование фермента гликогенсинтетазы)
5.Частичный протеолиз (необратимая модификация). При данном механизме от неактивной формы фермента (профермента) отщепляется фрагмент молекулы, блокирующий активный центр фермента. Например, неактивный пепсиноген под действием HCL переходит в активный пепсин.
2.6.7.2. Влияние ингибиторов ферментов Ингибиторы – вещества, понижающие активность фермента. Выделяют
различные виды ингибиторов.
∙По специфичности выделяют специфичные и неспецифичные ингибиторы
∙По обратимости эффекта различают обратимые и необратимые ингибиторы.
∙По месту действия встречаются ингибиторы, действующие на активный центр и вне активного центра.
∙По механизму действия различают конкурентные и неконкурентные
ингибиторы.
Конкурентные ингибиторы имеют структуру, близкую к структуре субстрата. В силу этого ингибитор и субстрат конкурируют за связывание активного центра фермента. Конкурентное ингибирование - это обратимое ингибирование Эффект конкурентного ингибитора может быть уменьшен путём повышения концентрации субстрата реакции
Примером конкурентного ингибирования может служить угнетение активности сукцинатдегидрогеназы, катализирующей окисление дикарбоновой янтарной кислоты, дикарбоновой малоновой кислотой, сходной по структуре с янтарной кислотой.

36
Принцип конкурентного ингибирования широко используется при создании лекарственных средств. Например, сульфаниламидные препараты имеют структуру, близкую к структуре парааминобензойной кислоты, необходимой для роста микроорганизмов. Сульфаниламиды блокируют ферменты микроорганизмов, необходимые для усвоения парааминобензойной кислоты. Некоторые противоопухолевые препараты являются аналогами азотистых оснований и, тем самым, ингибируют синтез нуклеиновых кислот (фторурацил).
Графически конкурентное ингибирование имеет вид, представленный на рисунке.
Неконкурентные ингибиторы структурно не схожи с субстратами реакций и поэтому не могут вытесняться при высокой концентрации субстрата. Существует несколько вариантов действия неконкурентных ингибиторов:
1.Блокирование ингибитором функциональной группы активного центра фермента и, вследствие этого, уменьшение активности. Например, активность SН - групп могут уменьшать тиоловые яды обратимо (соли металлов, ртути, свинца) и необратимо (монойодацетат). Эффект ингибирования тиоловых ингибиторов может быть уменьшен введением добавочных веществ, богатых SH группами (например, унитиол). Существуют сериновые ингибиторы, блокирующие ОН - группы активного центра ферментов. Таким эффектом обладают органические фосфофторсодержащие вещества. Эти вещества могут, в частности, ингибировать ОН - группы в ферменте ацетилхолинэстеразе, разрушающей нейромедиатор ацетилхолин.
2.Блокирование ингибитором ионов металлов, входящих в состав активного центра ферментов. Например, цианиды блокируют атомы железа, ЭДТА

37
(этилендиаминтетраацетат) блокирует ионы Са 2+, Mg 2+.
3.Аллостерический ингибитор взаимодействует с аллостерическим участком, опосредованно через него по принципу кооперативности, меняя структуру и активность каталитического участка. Графически неконкурентное ингибирование имеет вид:
Как видно из рисунка, максимальная скорость реакции при неконкурентном ингибировании не может быть достигнута путём повышения концентрации субстрата.
2.8. Регуляция активности ферментов в процессе метаболизма Адаптация организма к меняющимся условиям (режим питания,
экологические воздействия и пр.) возможна благодаря изменению активности ферментов. Существует несколько возможностей регуляции скорости ферментных реакций в организме:
1.Изменение скорости синтеза ферментов (этот механизм требует длительного отрезка времени).
2.Увеличение доступности субстрата и фермента путём изменения проницаемости клеточных мембран.
3.Изменение активности ферментов, уже имеющихся в клетках и тканях. Данный механизм осуществляется с большой скоростью и носит обратимый характер.
Вмногоступенчатых ферментативных процессах выделяют регуляторные, ключевые ферменты, которые ограничивают суммарную скорость
процесса. Чаще всего ими являются ферменты начальной и конечной стадий процесса (F1 и F3 на схеме). Изменение активности ключевых ферментов происходит по различным механизмам.
1.Аллостерический механизм:
2.Изменение олигомерности фермента: Мономеры не активные ↔ олигомеры активные
3.Фосфолирирование - дефосфорилирование:
Фермент (неактивный) + Н3РО4 ↔ фосфорилированный активный фермент. В клетках широко распространено ретроингибирование, при котором

38
продукты ферментативного процесса угнетают ферменты начальных стадий (на схеме конечный продукт D угнетает активность F1). Например, высокие концентрации пуриновых и пиримидиновых нуклеотидов угнетают начальные в стадии их синтеза.
Иногда исходные субстраты активируют конечные ферменты, на схеме: субстрат А активирует F3. Например, активная форма глюкозы (глюкозо-6-фосфат) активирует конечный фермент синтеза гликогена из глюкозы (гликогенсинтетазу).
2.9. Структурная организация ферментов в клетке Слаженность обменных процессов в организме возможна благодаря
структурной разобщенности ферментов в клетках. Отдельные ферменты располагаются в тех или иных внутриклеточных структурах – принцип компартментализации. Например, в плазматической мембране активен фермент калий - натриевая АТФ-аза. В митохондриях активны ферменты окислительных реакций (сукцинатдегидрогеназа, цитохромоксидаза). В ядре высока активность ферментов синтеза нуклеиновых кислот (ДНК-полимераза). В лизосомах активны ферменты расщепления различных веществ (РНК - аза, фосфатаза и другие).
Ферменты, наиболее активные в данной клеточной структуре, называются индикаторными или маркерными ферментами. Изменение их активности отражает глубину структурных повреждений ткани. Некоторые ферменты объединяются в полиферментные комплексы, например, пируватдегидрогеназный комплекс (ПДК), осуществляющий окисление пировиноградной кислоты.
2.10. Принципы обнаружения и количественного определения ферментов: Обнаружение ферментов основано на их высокой специфичности.
Ферменты обнаруживают по производимому ими действию, т.е. по факту протекания той реакции, которую катализирует данный фермент. Например, амилазу обнаруживают по реакции расщепления крахмала до глюкозы.
Критериями протекания ферментативной реакции могут быть:
∙исчезновение субстрата реакции;
∙появление продуктов реакции;
∙изменение оптических свойств кофермента.
2.10.1. Количественное определение ферментов Так как концентрация ферментов в клетках очень низка, то определяют не
их истинную концентрацию, а о количестве фермента судят косвенно, по активности фермента.
Активность ферментов оценивают по скорости ферментативной реакции, протекающей в оптимальных условиях (оптимум температуры, РН, избыточно высокая концентрация субстрата). В таких условиях скорость реакции прямо пропорциональна концентрации фермента (V= K3[F0]).
В клинической практике используют несколько единиц активности фермента.

39
1.Международная единица – то минимальное количество фермента, которое катализирует превращение 1 микромоля субстрата за минуту при температуре 250
2.Катал (в системе СИ) – то количество фермента, которое катализирует превращение 1 моля субстрата за секунду.
3.Удельная активность – отношение активности фермента к массе белка фермента.
4.Молекулярная активность фермента показывает, сколько молекул субстрата превращается под действием одной молекулы фермента за единицу времени.
3.ВВЕДЕНИЕ В ОБМЕН ВЕЩЕСТВ. БИОХИМИЯ ПИТАНИЯ. ВИТАМИНЫ
3.1. Общие сведения об обмене веществ Обмен веществ – совокупность химических процессов в живых
организмах. Выделяют три этапа в обмене веществ:
-питание;
-промежуточный обмен (метаболизм);
-образование и выведение конечных продуктов обмена.
Питание – процесс поступления в организм питательных веществ, их переваривание и усвоение.
Промежуточный или тканевой обмен представляет процесс превращения всосавшихся в кишечнике продуктов переваривания в соединения, характерные для данного организма, и их использование на различные цели. Метаболизм включает два взаимодополняющих друг друга процесса: катаболизм и анаболизм.
Катаболизм – процесс расщепления сложных молекул до более простых, идущий с выделением энергии.
Анаболизм – синтез сложных молекул из более простых, идущий с затратой энергии.
Благодаря сбалансированности этих процессов в организме поддерживается постоянство концентрации многих химических веществ. При заболеваниях наблюдаются отклонения в содержании различных веществ, что используется с диагностическими целями.
К основным конечным продуктам относятся вода, СО2, соли аммония, мочевина, мочевая кислота. По их выделению через почки и кишечник оценивают состояние обмена веществ.
3.2. Биохимия питания Наука о питании – нутрициология. Биохимия питания изучает качественный
и количественный состав пищевых веществ, их биологическую роль и биохимические последствия недостатка или избытка питательных веществ.
Все питательные вещества делят на несколько групп.
1.По химической природе: органические (белки, жиры, витамины) и минеральные.
2.По количественной потребности организма в них: основные (макронутриенты) - белки, жиры, углеводы, и минорные (микронутриенты) –

40
витамины, микроэлементы.
3. По способности к синтезу в организме: заменимые и незаменимые.
Питание выполняет следующие функции:
∙пластическая;
∙энергетическая;
∙источник биологически активных веществ;
∙обеспечивает иммунные реакции организма.
Требования к здоровому (рациональному) питанию:
∙Питание должно быть достаточным в энергетическом отношении. Для взрослых людей калорийность рациона составляет. 2200-4300 ккал/сутки. Для детей энергетическая потребность выше: для ребёнка 0-6 месяцев –
125-120 ккал/кг, 6-12 месяцев – 110 ккал/кг, 5-6 лет – 50-60 ккал/ кг.
∙Питание должно быть полноценным т.е. содержать незаменимые компоненты.
∙Питание должно быть биологически активным т.е. содержать витамины и микроэлементы.
∙Питание должно быть сбалансированным (содержать определенное соотношение между Б : Ж : У 1: 1: 4, для детей первого года 1: 2 :4).
∙Питание не должно содержать токсичных, вредных для здоровья компонентов.
3.2.1. Краткая характеристика питательных веществ Белки.Суточная потребность в белках для взрослого человека составляет
100 -120г. Они обеспечивают 15% энергетических затрат организма. В составе белков содержатся незаменимые аминокислоты: валин, лейцин, изолейцин, фенилаланин, триптофан, треонин, метионин, гистидин, лизин, аргинин. Этими аминокислотами более богаты белки животного происхождения, поэтому в рационе взрослого человека должно присутствовать не менее половины белков животного происхождения. У детей первого года жизни потребление белков выше, чем у взрослых людей, составляя 2-4 г/ кг. Для детей первых месяцев жизни все пищевые белки должны быть полноценными. Недостаток белка в детском возрасте приводит к белковому голоданию – квашиоркор. Оно может привести к задержке роста, замедлению умственного развития, нарушению гемопоэза. Избыточное поступление белка в организм ребёнка нежелательно, так как создаётся повышенная нагрузка на почки, печень.
Липиды. Потребность в липидах для взрослого человека равна 70 -100 г в сутки. Липиды содержат незаменимые полиненасыщенные жирные кислоты (ПНЖК): линолевую (С18:2), линоленовую (С18:3). ПНЖК служат источником биологически активных эйкозанойдов. ПНЖК содержатся в растительных маслах, поэтому в рационе четверть всех липидов должна быть растительного происхождения. У детей потребность в липидах выше чем у взрослых людей: 0-6 месяцев – 6-7 г/кг, 6-12 месяцев 6-5 г/ кг массы тела. При недостатке ПНЖК нарушается деятельностьцентрпльной нервной системы, снижается иммунитет, нарушаются различные виды обмена. Грудное молоко богато мононенасыщенными кислотами и ПНЖК.
