

121
активно подвергается окислительному дезаминированию под действием глютаматдегидрогеназы – высоко активного митохондриального фермента.
Около трети аминокислот включается в непрямое дезаминирование.
8.6.2.3. Внутримолекулярное дезаминирование В процесс внутримолекулярного дезаминирования вступают аминокислоты
гистидин, серин, треонин, цистеин. Например, из гистидина происходит выделение NН3 за счёт внутримолекулярной перестройки с образованием уроканиновой кислоты:
Серин в результате внутримолекулярного дезаминирования переходит в пировиноградную кислоту
У детей процессы трансаминирования и дезаминирования идут более активно, чем у взрослых.
8.7. Декарбоксилирование аминокислот. Биогенные амины Декарбоксилирование аминокислот – ферментативный процесс
высвобождения СО2 из СООН - групп аминокислот с образованием аминов.
Наиболее активно в процесс деркарбоксилирования включаются аминокислоты гистидин, тирозин, глютамат, триптофан. Образующиеся амины называются биогенными аминами, поскольку они, как правило, обладают

122
широким спектром физиологических эффектов, влияют на тонус сосудов, являются нейромедиаторами, участвуют в воспалительных реакциях. К основным биогенным аминам относятся гистамин, серотонин, катехоламины, гамма-аминомасляная кислота, полиамины.
Гистамин образуется при декарбоксилировании аминокислоты гистидина. Он синтезируется в тучных клетках, накапливается в секреторных гранулах, выделяется при раздражении клеток.
Гистамин оказывает разнообразные биологические эффекты: вызывает расширение сосудов, снижает артериальное давление, увеличивает тканевую проницаемость, вызывает местный отёк, стимулирует желудочную секрецию, обладает бронхоспатическим эффектом. В высокой концентрации он является медиатором воспалительных и аллергических реакций.
Серотонин образуется при декарбоксилировании гидрокситриптофана. Он синтезируется в хромаффиннных клетках, в некоторых ядрах подкорковых структур, в тромбоцитах.
Эффекты серотонина: вызывает спазм сосудов, повышение артериального давления, стимулирует перистальтику кишечника, участвует в терморегуляции, в механизмах сна, памяти, является источником для синтеза гормона мелатонина, влияет на эмоциональные реакции человека.
Катехоламины (дофамин, адреналин, норадреналин) синтезируются из аминокислоты тирозина.
Дофамин – возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона (адинамия, ригидность, тремор). Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном.
Норадреналин в основном выполняет нейромедиаторные функции.
Гамма-аминомасляная кислота (ГАМК) образуется при декарбоксилировании глютаминовой кислоты, является тормозным медиатором, улучшает кровоснабжение головного мозга, активирует окислительные процессы в нём.

123
Полиамины (спермин,спермидин) синтезируются из орнитина и метионина, участвуют в регуляции процессов трансляции, транскрипции, репликации.
Так как биогенные амины очень активны, они быстро инактивируются в тканях. Распад биогенных аминов осуществляется несколькими способами: окисление, метилирование, дезаминирование. Основным способом инактивации биогенных аминов является окислительное дезаминирование под действием ферментов аминооксидаз (моноаминооксидаз, полиаминооксидаз).
Ингибиторы МАО применяются в качестве терапевтических средств.
8.8. Образование и обезвреживание аммиака в организме Аммиак образуется в результате дезаминирования таких веществ как
аминокислоты, амины, пуриновые и пиримидиновые нуклеотиды.
Аммиак чрезвычайно токсичное вещество. Токсичность аммиака объясняется многими его эффектами, главным среди которых является связывание альфа-кетокислот и блокирование включения их в цикл Кребса, что нарушает энергетический обмен в тканях. Аммиак может нарушать обмен глютамата и глютамина в ткани мозга, вызывать повышение концентрация глютамата до токсичных концентраций. Кроме того, аммиак вызывает защелачивание в тканях и нарушает транспорт ионов Na+ и Са2+. В связи с этим концентрация аммиака в тканях и в крови поддерживается на очень низком уровне. В плазме крови она составляет 20-80 мкмоль/л. Такая низкая концентрация обеспечивается наличием в организме различных путей связывания (обезвреживания) аммиака. Эти способы можно разделить следующим образом:
Øвременные пути (протекают в тканях):
∙восстановительное аминирование альфа-кетокислот;
∙амидирование белков;
∙синтез глютамина;
Øобразование конечных продуктов азотистого обмена:
∙соли аммония;
∙мочевина.
8.8.1.Пути временного (экстренного) связывания аммиака в тканях
8.8.1.1. Восстановительное аминирование альфа-кетокислот Восстановительное аминирование альфа-кетокислот заключается в
присоединении аммиака к альфа - кетокислоте с одновременным её восстановлением с образованием аминокислоты. В качестве альфа-кетокислот

124
чаще используются пировиноградная кислота, которая восстанавливается в аланин, щавелевоуксусная, переходящая в аспарагиновую кислоту и альфа - кетоглютаровая кислота, восстанавливающаяся в глютаминовую кислоту.
Биологическое значение восстановительного аминирования кетокислот:
∙способ быстрого связывания аммиака;
∙способ синтеза новых заменимых аминокислот.
8.8.1.2. Амидирование тканевых белков Амидирование тканевых белков заключается в присоединении аммиака к
карбоксильным группам радикалов аспарагиновой, глютаминовой аминокислот и к альфа - концевым карбоксильным группам.
Амидирование белков сопровождается определёнными изменениями их структуры и физико-химических свойств и биологической активности.
8.8.1.3. Биосинтез глютамина В процессе биосинтеза глютамина происходит амидирование
карбоксильной группы свободной глютаминовой кислоты. Данная реакция ведёт к переходу аммиака в его нетоксичную транспортную форму - глютамин, в виде которой аммиак из тканей переносится в печень и почки. Глютамин может поступать в ткани, где он служит источником азота для синтеза аминосахаров, пуриновых пиримидиновых нуклеотидов.
У детей синтез глютамина и его использование протекает более активно, чем у взрослых людей. Глютамин транспортирует аммиак в печень и почки, где образуются конечные продукты азотистого обмена: аммонийные соли и мочевина.

125
8.8.2. Конечные продукты азотистого обмена
8.8.2.1. Синтез аммонийных солей в почках В почках под действием активного фермента глютаминазы происходит
гидролитическое расщепление глютамина на глютаминовую кислоту и аммиак. В почках при выведении протонов происходит одновременная реабсорбции ионов Nа+ и К+. Таким образом, глютаминаза почек участвует в регуляции кислотно-основного баланса.
Активность глютаминазы зависит от рН. При ацидозе активность фермента возрастает, что увеличивает выведение протонов и снижает степень ацидоза.
У взрослых людей за сутки выделяется 0,5-1,2 г аммонийных солей. На них приходится 3,5% выводимого азота. У детей относительная доля аммонийных солей выше, чем у взрослых. У новорожденных азот аммонийных солей составляет до 8,5%.
8.8.2.2. Биосинтез мочевины и его нарушения Глютамин поступает в печень, где под действием фермента глютаминазы
высвобождается аммиак, который превращается в мочевину. В синтезе мочевины участвует аминокислота орнитин, поэтому синтез мочевины называют орнитиновым циклом.
Основным местом синтеза мочевины является печень.
Ключевыми ферментами биосинтеза мочевины являются карбамоилфосфат-синтетаза, ортиникарбамоилтрансфераза и аргиназа. Источниками азота в мочевине являются аммиак и аспарагиновая кислота. Орнитиновый цикл тесно связан с циклом Кребса. Фумаровая кислота из орнитинового цикла «уходит» в цикл Кребса. Цикл трикарбоновых кислот, в свою очередь, обеспечивает орнитиновый цикл молекулами АТФ.

126
Особенности выведения конечных азотистых продуктов у детей
|
Взрослые |
Дети |
Мочевина |
90% |
75% |
NH4 - соли |
3,5 |
8,5% |
Мочевая кислота |
1,5% |
8,5% |
|
|
Больше азота аминокислот и |
|
|
креатинина |
В детском возрасте могут выявляться нарушения синтеза мочевины, что ведёт к увеличению концентрации аммиака в крови и тканях. Они проявляются рвотой, судорогами после приёма белковой пищи. Симптомы интоксикации уменьшаются при дробном белковом питании. Нарушения мочевинообразования связаны с отсутствием или низкой активности

127
ферментов, участвующих в этом процессе.
Аферментозы биосинтеза мочевины
Отсутствующий фермент |
Заболевание |
|
|
Карбамаилфосфатсинтетаза |
Гипераммониемия I типа. |
Орнитинкарбамоилтрансфераза |
Гипераммониемия II типа |
Аргининсукцинатсинтетаза |
Цитруллинемия |
Аргининсукцинатлиаза |
Аргининсукцинатурия |
Аргиназа |
Аргининемия. |
В мышцах происходит своеобразное связывание аммиака – аланиновый цикл, представленный на схеме:
8.9. Обмен безазотистых радикалов аминокислот Безазотистые радикалы аминокислот могут использоваться следующим
образом:
∙участвуют в синтезе новых аминокислот;
∙используются для синтеза углеводов;
∙используются для синтеза кетоновых тел;
∙в виде альфа-кетокислот включаются в цикл Кребса и служат источниками энергии.
Взависимости от того, какие вещества могут синтезироваться из аминокислот, они делятся на 3 группы.
∙Гликогенные аминокислоты, радикал которых может использоваться на глюконеогенез. К этой группе относится большинство аминокислот.
∙Кетогенные аминокислоты, радикал которых участвует в синтезе кетоновых (ацетоновых) тел. К этому виду аминокислот относятся лейцин, изолейцин, лизин.
∙Смешанные аминокислоты, участвующие в синтезе и углеводов, и ацетоновых тел. В эту группу входят фенилаланин, тирозин, триптофан.
Все 20 аминокислот в процессе катаболизма превращаются в 7 безазотистых продуктов: пируват, щавелевоуксусная кислота (оксалацетат), альфа - кетоглютаровая кислота, фумаровая кислота, сукцинил-КоА, ацетил-КоА (эти вещества в последующем могут идти на синтез углеводов), ацетоацетил - КоА (используется на синтез ацетоновых тел, также как и ацетил КоА).
8.10. Особенности обмена отдельных аминокислот

128
8.10.1. Обмен глицина и серина Глицин и серин являются источниками одноуглеродных радикалов.
Глицин – заменимая аминокислота. Он широко используется в тканях в следующих процессах:
∙синтез гема;
∙синтез креатина;
∙синтез пуриновых нуклеотидов;
∙входит в состав глютатиона;
∙участвует в процессах детоксикации;
∙переходит в углеводы через образование пирувата;
∙служит источником метиленового радикала (СН2 =).
Метиленовый радикал используется для биосинтетических процессов в комплексе с активной формой фолиевой кислоты - тетрагидрофолевой кислотой (ТГФК). Основная реакция распада глицина, ведёт к образованию метилен - ТГФК
Серин – заменимая аминокислота. Используется в многочисленных биосинтетических процессах:
∙синтез фосфолипидов (фосфатидилсерин);
∙синтез сфингозина и сфинголипидов;
∙переходит в углеводы через стадию образования пирувата.
∙источник метиленового радикала;
8.10.1.1. Фолиевая кислота
Фолиевая кислота (Витамин Вс, В9,, антианемический витамин) включает в свой состав птеридин, парааминобензойную кислоту, глютаминовую кислоту. Она содержится в зелёных частях растений, в дрожжах. Суточная потребность в ней составляет до 2 мг. Биологическая роль: в виде ТГФК является переносчиком одноуглеродных радикалов от серина и глицина, использующихся для синтеза нуклеиновых кислот, аминокислот. Фолиевая кислота переходит в ТГФК при участии фермента фолатредуктазы с присоединением 4-х атомов водорода. В клинической практике в качестве противоопухолевых препаратов используют антивитамииы фолиевой кислоты, которые имеют структуру, близкую к птеридину и являются ингибиторами фолатредуктазы, вследствие чего блокируют синтез нуклеиновых кислот в опухолях. В качестве бактериостатических препаратов применяют сульфаниламидные соединения, имеющие структуру, сходную с парааминобензойной кислотой. В силу этого сульфаниламиды блокируют в микроорганизмах синтез фолиевой кислотой, которая является фактором роста микроорганизмов. Авитаминоз фолиевой
129
кислоты проявляется в виде анемии.
8.10. 2. Обмен серосодержащих аминокислот цистеина и метионина Цистеин и метионин являются источником: серы и метильных групп.
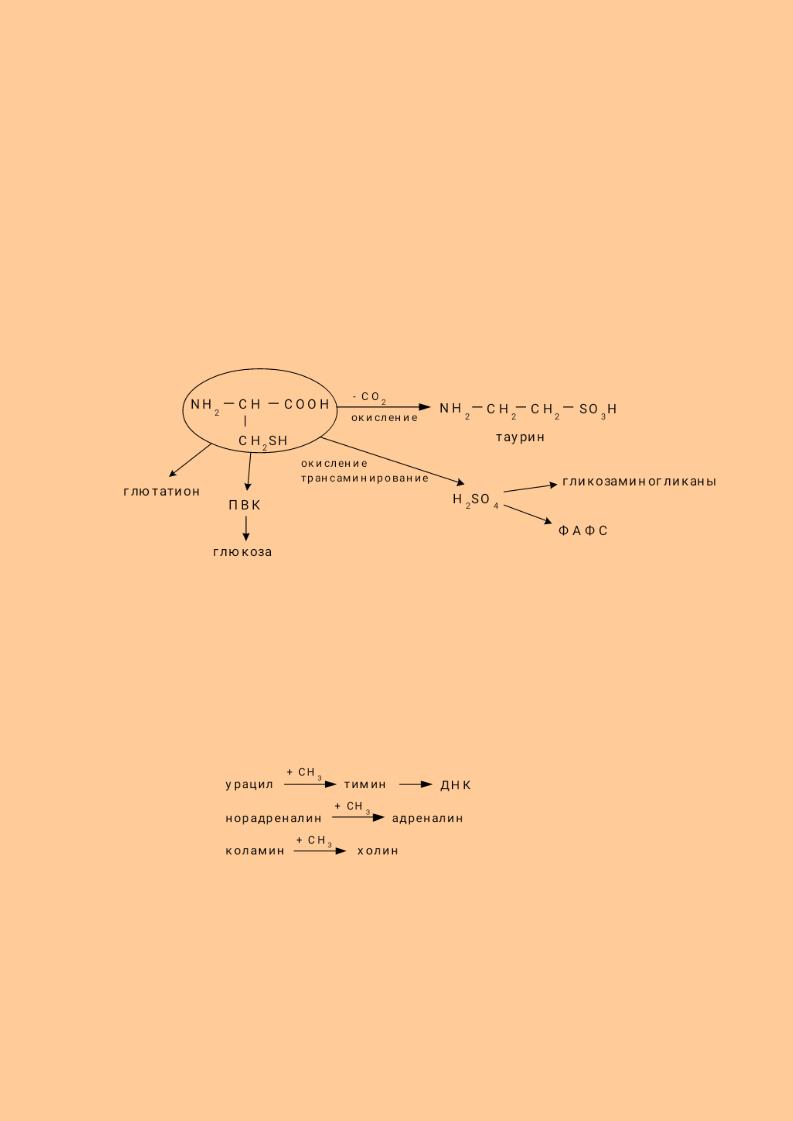
Цистеин при окислении, декарбоксилировании, трансаминировании переходит в таурин и серную кислоту, входит в состав глютатиона, через стадию пирувата может использоваться для синтеза углеводов.
Таурин используется на синтез парных жёлчных кислот и участвует в развитии нейросетчатки, головного мозга у плода и в раннем детском возрасте. Образующаяся серная кислота используется на синтез кислых гликозаминогликанов. В активной форме в виде ФАФС она участвует в обезвреживании токсичных продуктов в печени
Обмен цистеина
Метионин - незаменимая аминокислота, донатор метильных групп в реакциях метилирования.
В реакциях трансметилирования метионин участвует в активной форме – S+-(СН3) - аденозилметионин (SАМ), образующийся при взаимодействии метионина с АТФ.
Общая схема реакции метилирования различных веществ (R) с участием фермента метилтрансферазы имеет вид:
S+ (СН3) - аденозилметионин + R → R-СН3 + аденозилгомоцистеин. Примеры:
Метионин используется в многочисленных биосинтетических процессах:
∙синтез холина;
∙синтез тимина, с последующим включением его в ДНК;
∙синтез адреналина;
∙синтез карнитина – переносчика жирных кислот при их β - окислении;
∙синтез креатина – азотистого вещества мышц;
∙реакции обезвреживания;
∙донор серы.

130
В реакции метилирования аденозилметионин, отдавая СН3 –радикал, превращается в аденозилгомоцистеин, который затем распадается на аденозин и гомоцистеин. В последующем гомоцистеин может дальше превращаться двумя способами: при взаимодействии с серином переходит в цистеин или при участии ТГФК и вит. В12 реметилируется в метионин.
8.10. 2.1. Витамин В12
Витамин В12 (кобаламин, антианемический витамин) содержит корриновое кольцо с кобальтом в центре. Он содержится в печени, мясе. Суточная потребность в витамин В12 составляет 3 мкг. Биологическая роль:
∙участвует в синтезе метионина (реметилирование);
∙участвует в распаде жирных кислот с нечётным числом углеводных атомов;
∙участвует в восстановлении рибонуклеотидов до дезоксирибонуклеотидов.
Авитаминоз проявляется анемией и поражением некоторых структур спинного мозга.
8.10.2.2. Нарушения обмена серосодержащих аминокислот Цистинурия – заболевание, при котором серосодержащие аминокислоты
теряются с мочой в результате нарушения реабсорбции в почках.
Цистиноз – накопление серосодержащих аминокислот в тканях в результате снижения активности лизосомальных ферментов их распада.
Гомоцистинурия – патологическое состояние, при котором с мочой выделяется гомоцистеин в результате нарушения промежуточных стадий обмена серосодержащих аминокислот. Накапливающиеся в литературе данные свидетельствуют о том, что гомоцистеин играет существенную роль в патогенезе сердечно-сосудистых заболеваний, тромбозов.
8.10.3. Обмен фенилаланина и тирозина и его нарушения Фенилаланин – незаменимая аминокислота. Основной реакцией
превращения фенилаланина в организме является окисление его в тирозин при участи фермента фенилаланингидроксилазы и кофермента тетрагидробиоптерина. При врожденном дефекте данного фермента развивается заболевание фенилкетонурия, при котором фенилаланин переходит в токсичные для ткани мозга соединения фенилпируват, фенилацетат. А возникающий дефицит тирозина блокирует синтез нейромедиаторов. Фенилкетонурия сопровождается развитием слабоумия (фенилпировиноградная олигофрения).
Тирозин – заменимая аминокислота. Она используется на синтез многих важных веществ:
∙синтез тироксина (гормона щитовидной железы);
∙путём окисления переходит в диоксифенилаланин (ДОФА), который затем в коже используется для синтеза меланинов, а в эндокринных железах – для синтеза норадреналина, адреналина, дофамина (катехоламины);
∙путём трансаминирования превращается в фумаровую кислоту, которая используется для синтеза углеводов, и в ацетоуксусную кислоту,идущую
