
- •1 Литературный обзор
- •1.1 Создание полимерных носителей лекарственных препаратов:
- •1.2 Полиалкилцианоакрилаты, сывороточный альбумин,
- •2 Экспериментальная часть
- •2.1 Исходные вещества
- •2.2 Методика проведения эксперимента
- •2.3 Физико-химические методы исследования
- •2.4 Математическая обработка полученных результатов
- •3 Результаты и их обсуждение
- •3.1 Разработка наносомальных форм лекарственных препаратов на
- •3.2 Синтез и исследование наночастиц сывороточного альбумина,
- •3.3 Получение полимерных наночастиц полимолочной кислоты,
2.4 Математическая обработка полученных результатов
С целью достижения точности и достоверности полученных результатов,
найденные нами экспериментальные данные подвергали математической об-
работке. Ниже представлены основные формулы математического обсчета
[135]:
1. Среднее значение измеряемой величины определяли по формуле (1):
n
X i
Х i 1
n
,
(1)
где n - число измерений;
Хi - результат i-го измерения;
i - порядковый номер измерения.
2. Отклонение от среднего значения для каждого измерения рассчитывали
согласно формуле (2):
X=X-Xi ,
(2)
3. Среднеквадратичную ошибку измеряемой величины находили по
формуле (3):
S n
n
Х X i
i 1
n 1
2
,
(3)
4. Дисперсию определяли согласно (4):
2
n
n 1
,
52
(4)

















( Х X i ) 2
D S n i 1
5. По формуле (5) находили доверительный интервал:
E t ,n
S n
n
,
(5)
где t,n- критерий Стьюдента,
- доверительная вероятность.
Методом "наименьших квадратов"
обсчитывали экспериментальные
ошибки измерений. Как показали расчеты, максимальные относительные
ошибки для экспериментальных данных, определенных методами
кондуктометрии и спектрофотометрии составили 5 %.
Обычно при физико-химических и аналитических измерениях принимают
a = 0,95 или b = 0,99. В данной работе доверительная вероятность равняется
0,95.
53






3 Результаты и их обсуждение
3.1 Разработка наносомальных форм лекарственных препаратов на
основе полиалкилцианоакрилатов
Одной из главных проблем современной медицины является лечение
такого заболевания, как туберкулез. Туберкулез сегодня – это пандемия,
распространяющаяся по планете с катастрофической скоростью, треть
населения мира инфицировано микобактериями туберкулеза [20, c.8]. Поэтому
проблема создания терапевтической системы, позволяющей осуществить
направленный транспорт лекарства в место назначения в заданные сроки,
особенно важна в химиотерапии туберкулеза, лечение которого требует
многократного введения лекарства в организм в течение суток. Несмотря на
широкий спектр существующих противотуберкулезных препаратов
комбинации различных лекарственных средств (отличающихся по структуре и
механизмам действия), используемых при интенсивном лечении, оказывают
значительное токсическое действие на организм в целом и приводят к развитию
множественной лекарственной устойчивости.
Так как большинство
противотуберкулезных препаратов имеют белковую структуру, их период
полувыведения обычно очень короткий (п-аминосалициловая кислота – 45-60
мин, Амикацин – 2-3 ч., Стрептомицин – 5-6 ч. и Капреомицина сульфат – от 3-
х до 6-ти часов), т.е. они быстро выводятся из организма, следовательно, такие
лекарства необходимо вводить парентерально не менее 2-х раз в день. Также, в
связи с достаточно быстрым метаболизмом в организме большинства
современных противотуберкулезных препаратов, только небольшая их часть
оказывает полезное действие. Поэтому необходимы новые подходы для
решения этой проблемы.
Внимание ученых в настоящее время
сконцентрировано на повышении эффективности действия существующих
противотуберкулезных препаратов созданием полимерных систем лекарств
(полимерных наночастиц [15, c.3; 16, c.342; 17, c.15; 18, c.8; 136, c.3], липосом
и/или везикул, наполненных лекарством [137], аэрозольных частиц для прямого
введения в легкие человека [138], а также лекарственных форм в виде гранул
[139]). Заслуживает внимания, на наш взгляд, разработка новых форм для
транспорта противотуберкулезных препаратов в виде полимерных наночастиц
и нанокапсул, которая позволила бы обеспечить пролонгированное
высвобождение лекарства поддержанием эффективной концентрации
лекарственного вещества в крови в течение заданного промежутка времени,
снизила бы побочные действия лекарственного препарата, таким образом
повышая его терапевтический эффект [3, c.160; 34, c.686; 140, c.441]. В связи с
этим, нашей задачей было исследование возможности получения наночастиц
противотуберкулезных и противоопухолевых препаратов на основе природных
и синтетических полимеров.
Из литературных источников известно, что наночастицы получают как из
природных (альбумин, желатин, декстран и др.), так и из синтетических
(полиметилметакрилат, полистирол, полиметилцианоакрилат,
54
полибутилцианоакрилат, полиизобутилцианоакрилат и др.) полимеров [15, c.4].
В настоящей работе в качестве лекарственных средств для связывания с
полимером использованы препараты, наиболее часто используемые в терапии
туберкулеза: п-аминосалициловая кислота, Стрептомицин, Капреомицина
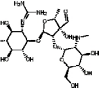
сульфат. Химические формулы противотуберкулезных препаратов,
использованных в данной работе, приведены на рисунке 4.
(а)
(б)
H2N
OH
(в)
COOH
(а) - Капреомицина сульфат; (б) - п-аминосалициловая кислота; (в) –
Стрептомицин
Рисунок 4 - Структурная формула лекарств
Первым антибиотиком из класса аминогликозидов и первым
лекарственным препаратом, применяемым в борьбе с туберкулезом, является
стрептомицин, который и на сегодняшний день имеет широкое применение в
лечении туберкулеза. Наряду с ним широко используется п-аминосалициловая
кислота с ее натриевой солью и является одним из первых антибиотиков,
используемых в терапии туберкулеза.
Противотуберкулезный препарат капреомицина сульфат используется в
случае, когда противотуберкулезные препараты 1-го ряда неэффективны или не
могут применяться из-за токсического действия или присутствия устойчивых
туберкулезных бацилл.
Эти лекарства, хотя и обладают высоким туберкулостатическим действием,
имеют ряд побочных эффектов, а также требуют частого приема. Кроме того,
все вышеперечисленные препараты за исключением п-аминосалициловой
кислоты, не всасываются желудочно-кишечным трактом, поэтому
предполагают только инъекционный способ (внутривенно или внутримышечно)
55

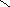
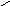
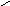






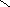





введения в организм. Разработка наносомальных форм противотуберкулезных
препаратов на полимерной основе позволило бы создать систему доставки
лекарств для инъекционного применения с пролонгированным действием.
С целью создания таких транспортных систем нами осуществлена
эмульсионная полимеризация ряда маслоподобных мономеров в присутствии
лекарственных препаратов.
При получении наночастиц, иммобилизованных лекарственным
препаратом, введение лекарственного вещества непосредственно в
реакционную среду способствует увеличению содержания лекарства в
наночастицах, однако необходимо учитывать ряд проблем, возникающих при
этом, например, влияние лекарства на стабильность эмульсии, его
совместимость с компонентами системы и др. В целях проверки данного
предположения проведена эмульсионная полимеризация стирола в качестве
модельного мономера, в присутствии индифферентного в биологической среде
инициатора - персульфата калия и стабилизатора, широко используемого при
получении полимерных наночастиц - додецилсульфата натрия.
Нами проведен эксперимент с использованием вышеназванных
компонентов в присутствии лекарственного препарата – п-аминосалициловой
кислоты. Установлено, что присутствие
п-аминосалициловой кислоты
деструктивно влияет на процесс радикальной полимеризации стирола в
эмульсии [141]. Эмульсионная полимеризация в присутствии
п-
аминосалициловой кислоты не протекает, что вызвано, по всей видимости,
разрушением эмульсии полярным лекарственным препаратом, содержащим
положительный и отрицательный заряды, создающие достаточную ионную
силу раствора или разрушением лекарственного препарата. Так, после
добавления в реакционную среду, содержащую стирол, эмульгатор, инициатор,
лекарства и нагревания смеси до 600С, визуально наблюдалось изменение цвета
раствора от молочно-белого до темно-коричневого. Одной из причин этого
явления может быть деструкция лекарственного препарата при нагревании до
температуры реакции. В связи с этим нами изучена стабильность данного
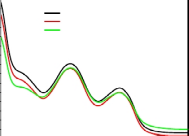
лекарственного препарата при температуре реакции 600С и к УФ-облучению.
Устойчивость лекарственного препарата к нагреванию контролировали по
изменению характерных полос поглощения лекарства в УФ-области (рисунок
5).
Представленные на рисунке 5 спектральные характеристики
лекарственного препарата до обработки, после нагревания и облучения,
идентичны, что свидетельствует об устойчивости лекарства к нагреванию и
влиянию УФ-света.
На основании полученных результатов следует однозначно утверждать,
что п-аминосалициловая кислота препятствует образованию эмульсии, будучи
полярным лекарственным веществом, разрушая стабильность системы; поэтому
эмульсионная полимеризация в присутствии данного лекарства не протекает.
56
0.7
0.6
at room temperature
after heating at 60C for 1 hour
After irradiation under UV light for 1 hour
0.5
0.4
0.3
0.2
0.1
0.0
225
250
275
300
325
350
Wavelength (nm)
Рисунок 5 - УФ-спектр п-аминосалициловой кислоты
В продолжение исследований модельных систем нами проведена
эмульсионная полимеризация стирола в присутствии тех же компонентов
системы, но в присутствии капреомицина сульфата. В результате получены
полимерные наночастицы с удовлетворительными характеристиками (таблица
5).
Таблица 5 – Характеристика пустых и иммобилизованных капреомицина
сульфатом наночастиц полистирола
Более низкое значение размера, полидисперсности иммобилизованных
наночастиц, по всей видимости, связано с компактизацией структур, вызванной
присутствием капреомицина сульфата.
Таким образом, на данном этапе работы показано влияние компонентов
системы на процесс образования эмульсии, а также возможность включения в
полимерные носители лекарственного препарата непосредственно на стадии
синтеза полимерных наночастиц методом цепной полимеризации.
57





















|
Полимер |
Средний размер частиц, d, нм |
Полидисперсность наночастиц |
Конверсия, % |
|
Наночастицы, иммобилизованные капреомицина сульфатом |
173 |
0,2 |
99 |
|
Пустые наночастицы |
400 |
0,4 |
96 |
Absorbance (AU)
3.1.1 Синтез полимерных наночастиц на основе полиэтилцианоакрилата
для транспорта противотуберкулезного препарата капреомицина сульфата
Из числа биодеградируемых синтетических полимеров, служащих основой
для получения наночастиц, особый интерес представляют
полиалкилцианоакрилаты. Использование полиалкилцианоакрилатов в области
медицины началось с хирургических нитей и адгезивов, которые обладают
хорошими рассасывающимися свойствами [66, c.331; 67, c.791; 68, c.648; 69,
c.23; 70,
c.530; 142]. Благодаря биосовместимости и способности к
биодеградации алкилцианоакрилаты и их полимеры продолжают привлекать
внимание ученых и являются объектом интенсивного исследования.
Токсичность и скорость деструкции полиалкилцианоакрилатов уменьшается
по мере увеличения длины цепи алкильного заместителя [15, c.5; 142, 154].
Полиалкилцианоакрилаты также являются уникальными материалами для
создания полимерных носителей лекарственных препаратов в виде наночастиц.
Полиалкилцианоакрилаты как системы доставки лекарств в виде коллоидных
наночастиц впервые были разработаны для лечения раковых заболеваний еще в
начале 80-х годов 20-го столетия [66, c.331; 67, c.791; 68, c.648; 69, c.23; 70,
c.530; 142, 156; 143]. Позднее полиалкилцианоакрилатные наночастицы стали
использоваться для транспорта быстро-распадающихся веществ, таких как
белки и нуклеиновые кислоты [66, c.331; 67, c.791; 68, c.648; 69, c.23; 70, c.535].
Известны примеры включения различных цитостатиков (доксорубицина
гидрохлорид, дактиномицин, даунорубицин и др.), а также антибиотиков
(амикацин, ампициллин, ципрофлоксацин и др.) в матрицу
полиалкилцианоакрилатов с целью повышения терапевтического эффекта
лекарств [74, c.56; 75, c.1444; 76, c.70; 77, c.30; 78, c.59; 79, c.2110; 80, c.109; 81,
c.44].
В лаборатории профессора Й.Кройтера (университет им. Й.Гете, Германия)
в течение ряда лет ведутся исследования по созданию наноносителей. Ими
показано эффективное преодоление гемато-энцефалического барьера
поли(бутилцианоакрилатными) наночастицами, иммобилизованными
лекарственным препаратом доксорубицин [74, c.57].
Таким образом, перспективность применения алкилцианоакрилатов и
полимеров на их основе в качестве носителей для доставки различных
лекарственных веществ подтверждается результатами многочисленных
исследований в этом направлении [66, c.331; 67, c.791; 68, c.648; 69, c.23; 70,
c.535; 74, c.56; 75, c.1444; 76, c.70; 77, c.30; 78, c.59; 79, c.2110; 80, c.109; 81,
c.44]. В настоящей работе в качестве полимерных матриц для разработки
наносомальных форм лекарственных препаратов выбраны
полиалкилцианоакрилаты.
Одним из наиболее широко распространенных способов получения
полимерных наночастиц является эмульсионная полимеризация, поскольку этот
метод дает возможность получить продукт с довольно высоким выходом и
удовлетворительными характеристиками. Метод эмульсионной полимеризации
для алкилцианоакрилатов впервые был внедрен научной группой под
58
руководством Couvreur P. в 1979 году с целью получения полимерных
наночастиц для направленного транспорта лекарственных препаратов [66,
c.331]. Ранние работы Couvreur P. и его сотрудников были посвящены
исследованию токсичности полиалкилцианоакрилатных
наночастиц и
разработке наносомальных форм противоопухолевых препаратов [51, c.29; 67,
c.791]. Основным преимуществом алкилцианоакрилатов по сравнению с
другими синтетическими носителями является биодеградируемость их
полимеров и простота проведения процесса полимеризации [15, c.6; 66, c.331;
67, c.791; 68, c.648; 69, c.23; 70, c.535].
Наиболее эффективным способом получения полиалкилцианоакрилатных
наночастиц является проведение полимеризации по анионному механизму, так
как этот метод позволяет синтезировать полимер с узким распределением
частиц по размерам с удовлетворительными физико-механическими
характеристиками и не требует специальной аппаратуры [68, c.648; 69, c.23; 70,
c.535; 71, c.3; 72, c.134; 73, c.4375]. Полимеризация алкилцианоакрилата
анионным способом протекает в присутствии слабых оснований (оснований
Льюса) при комнатной температуре. Механизм анионной полимеризации
цианоакрилатов может быть представлен следующей схемой (рисунок 6).
Рисунок 6 - Механизм анионной полимеризации алкилцианоакрилата
Результаты исследований последних лет показали,
что наиболее
эффективными среди алкилцианоакрилатов при создании полимерных
носителей для транспорта лекарственных препаратов являются этил-, бутил-,
изобутил-, гексил-, изогексил- и октилцианоакрилаты, так как полученные на
их основе полимеры обладают удовлетворительными физико-химическими
характеристиками и проявляют хорошее биораспределение [68, c.648; 69, c.23;
70, c.535; 71, c.3; 72, c.134; 73, c.4375]. Также известны примеры использования
сополимеров этил-
и бутилцианоакрилатов [92,
c.5145],
и бутил-
и
октилцианоакрилатов структуры ядро-оболочка для транспорта лекарственных
препаратов [92, c. 5146; 93, c.137]. Нами в качестве мономеров для синтеза
полимерных наночастиц, содержащих лекарственное вещество, выбраны этил-
и бутилцианоакрилаты.
59


Эмульсионную полимеризацию этил-
и бутилцианоакрилатов
осуществляли в присутствии катализатора – триэтиламина, а в качестве
стабилизатора использовали Твин-80 и Твин-85.
При этом скорость полимеризации алкилцианоакрилатов зависит от рН
среды: чем выше рН, тем быстрее реакция, так, в щелочной среде
полимеризация заканчивается в течение нескольких секунд, реакция
неконтролируема и приводит к коагуляции; а поддержание кислой среды дает
возможность получить частицы нанометрических размеров. С целью снижения
скорости реакции эмульсионную полимеризацию этилцианоакрилата
осуществляли в сильнокислой среде, созданную буферным раствором.
Полимеризацию проводили в течение 2-х часов, через определенный
промежуток времени, отбирая пробы для определения физико-химических
характеристик, которые приведены в таблице 6.
Таблица 6
–
Физико-химические характеристики пустых
полиэтилцианоакрилатных наночастиц: Т = 250С, [Э] = 5 % от массы мон., [kat]
= 0,01 %
Экспериментальные данные показывают, что активная фаза формирования
частиц полиалкилцианоакрилата длится 30 минут. По истечении этого времени
размер частиц и молекулярная масса полимера изменяются незначительно, при
этом стабилизируется дисперсность частиц.
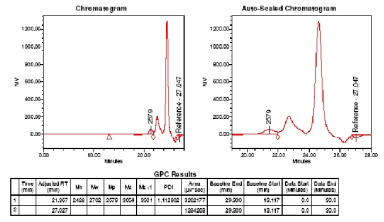
Средняя молекулярная масса полиэтилцианоакрилата,
определенная
методом гель-проникающей хроматографии, по окончании реакции составила
2428 (рисунок 7).
60
|
Время, мин |
Диаметр частиц (d, нм) |
Полидисперсность наночастиц |
Mn |
Mw/Mn |
|
1 |
317,5 |
0,576 |
2210 |
1,13 |
|
5 |
170,0 |
0,138 |
2436 |
1,14 |
|
10 |
150,8 |
0,136 |
2579 |
1,13 |
|
15 |
224,9 |
0,325 |
2517 |
1,13 |
|
20 |
160,2 |
0,175 |
2595 |
1,11 |
|
30 |
235,5 |
0,264 |
2711 |
1,13 |
|
45 |
161,6 |
0,190 |
2381 |
1,13 |
|
60 |
154,8 |
0,134 |
2591 |
1,13 |
|
90 |
159,0 |
0,166 |
2534 |
1,13 |
|
120 |
153,7 |
0,132 |
2428 |
1,13 |
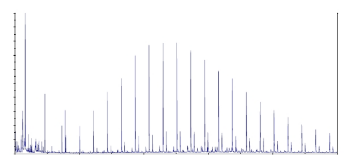
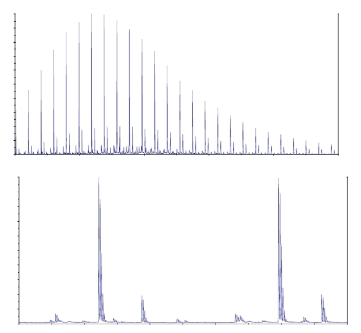
Молекулярную массу полимера также определяли методом масс-
спектрометрии, результаты которых приведены на рисунке 8. Молекулярные
массы, найденные двумя методами имеют удовлетворительную сходимость.
Рисунок 7 - Результаты гель-проникающей хроматографии
Voyager Spec #1[BP = 190.8, 3506]
100
90
80
70
190.7641
1182.3626
1307.4209
1557.5537
1682.6150
1807.6755
3506.0
60
50
1057.3077
1932.7450
2058.8028
368.3151
932.2391
2183.8641
40
2308.9306
30
166.8859
550.5467
807.1894
2433.9946
2559.0650
20
10
103.7699
154.7674
122.8246
163.9431
288.9370
303.8767
395.0086
522.5102
557.0641
682.1298
712.1620
962.2618
902.2522
1087.3111
1152.3458
1337.4196
1310.4185
1402.4838
1560.5522
1653.6175
1810.6782
1963.7129
2061.8056
2096.4646
2338.8899
2437.0084
2278.9384
2684.1186
2589.0207
2687.1213
2809.1849
2839.1519
0
99.0
679.4
1259.8
1840.2
2420.6
0
3001.0
Mass (m/z)
Рисунок 8 - Масс спектр полиэтилцианоакрилатных наночастиц, лист 1
61
% In tensity
1712.6001
1903.7750
1612.9873
Voyager Spec #1[BP = 1557.5, 40403]
100
90
1307.4319
1432.4929
1557.5496
1807.6677
1933.7282
4.0E+4
2058.7913
80
1182.3747
2183.8517
70
2308.9171
60
1057.3168
2433.9797
50
40
807.1986
932.2569
2559.0384
2684.0991
2809.1642
30
1685.6054
1810.6650
2934.2264
3059.2871
20
1337.4333
1560.5479
1462.4870
1837.6448
2088.7643
2338.8849
3184.3451
3310.3992
10
962.2673
935.2987
1087.3267
1212.3772
1277.4207
1109.6542 1340.4400
1527.5423
1590.5534
1778.6840
2061.7918
2053.4390
1992.7166
2311.9134
2278.9439
2466.9436
2588.9949
2687.0951
2717.0692
2937.2216
2967.1822
3187.3341
3560.5179
3465.4246
3810.6319
3715.5424
0
799.0
1439.4
2079.8
2720.2
3360.6
0
4001.0
Mass (m/z)
Voyager Spec #1[BP = 1557.5, 40403]
100
90
1557.5496
1682.6070
1683.6073
4.0E+4
1558.5476
80
70
60
1684.6053
50
1559.5465
40
30
1685.6054
20
1560.5479
1587.5394
1712.5910
1588.5414
10
1527.5423
1561.5510
1589.5437
1652.6075
1686.6008
1714.5968
0
1502.0
1529.5576
1547.6
1567.9574
1590.5534
1593.2
1611.9982
1638.8
1658.0387
1684.4
1700.0616
1715.6048
0
1730.0
Mass (m/z)
Рисунок 8, лист 2
Низкое значение молекулярной массы полиэтилцианоакрилата, по всей
видимости, связано с высокой скоростью полимеризации этилцианоакрилата,
что привело к образованию короткоцепных полимеров [144]. Анализ масс-
спектра полимера показал, что полученный продукт содержит олигомерные
цепи от димеров (n=307) до октамеров (n=1057), а самая длинная цепь состоит
из 32 мономерных звеньев (n=32).
Для детального изучения морфологии полученных
полиэтилцианоакрилатных наночастиц нами сделаны снимки полимеров на
трансмиссионном (а) и сканирующем (б) электронных микроскопах (рисунок
9).
62
% Inten sity
% Inten sity
(а)
(б)
Рисунок 9 – Электронно-микроскопические снимки пустых
полиэтилцианоакрилатных наночастиц
Из электронно-микроскопических снимков можно судить о том, что
полученные частицы имеют правильную сферическую форму, размер их
составляет менее 100 нм. Снимки, сделанные на сканирующем электронном
микроскопе показывают, что кроме частиц небольшого размера (≈ 130-160 нм),
имеются и агломераты, диаметром более 500 нм. Образование агломератов
неизбежно, при этом их размер не превышает 1000 нм, поэтому они также
могут служить в качестве носителей, поскольку способны проникать в клетку
посредством фагоцитоза.
Известно немало примеров получения пустых полимерных наночастиц в
эмульсии с их последующей иммобилизацией лекарственным препаратом
методом адсорбции. Недостатком этого метода является низкое содержание
лекарственного вещества в носителе. При проведении процесса анионным
механизмом наиболее эффективным способом включения лекарства в
полимерные наночастицы может быть добавление его в реакционную среду
непосредственно в процессе полимеризации, поскольку в этом случае можно
достичь более высокую степень связывания. При этом надо принимать во
63





внимание, что не все лекарства могут быть использованы в условиях
эмульсионной полимеризации, так как кислотность среды, присутствие других
компонентов могут оказать влияние на стабильность лекарства, тогда как
лекарственное вещество, в свою очередь, также может повлиять на ход
процесса.
Устойчивость лекарственных препаратов исследовалось УФ-
спектроскопически при значениях рН 2,0-2,5, заданных буферными растворами.
Для проведения более полного исследования нами было изучено поведение п-
аминосалициловой кислоты и капреомицина сульфата в кислой, щелочной и
нейтральной средах, результаты которых приведены на рисунке 10.
(1)
(2)
(1) – п-аминосалициловой кислоты, (2) – капреомицина сульфата
раствор лекарства; сильнокислая среда; щелочная среда;
нейтральная среда
Рисунок 10 - УФ-спектры лекарств
Из этих рисунков видно, что капреомицина сульфат не изменяется в
составе в кислой и щелочной средах, тогда как для п-аминосалициловой
кислоты наблюдается изменение в составе в кислой среде с образованием
гидрохлорида. В связи с этим, для получения новых форм лекарственного
препарата в качестве активного начала был выбран капреомицина сульфат для
иммобилизации в наночастицы полиэтилцианоакрилата.
В продолжение работ, используя найденные принципы формирования
пустых полиэтилцианоакрилатных наночастиц, исследована возможность
иммобилизации последних противотуберкулезным препаратом капреомицина
сульфатом.
Очевидно, что степень иммобилизации лекарства в матрицу
полиэтилцианоакрилата определяется как соотношением последних, так и
временем введения лекарства от начала процесса полимеризации в
реакционную среду. Используя литературные источники [77, c.25; 79, c.2111;
82, c.180; 87, c.45], в качестве соотношения этилцианоакрилат : капреомицина
сульфат взято 10 : 1, которое использовалось в работе при иммобилизации
64






лекарства в процессе эмульсионной полимеризации. На первом этапе
осуществлена попытка связывания капреомицина сульфата путем полного
введения последнего в реакционную среду, содержащую компоненты
эмульсионной системы. На рисунке 11 приведены данные по содержанию
фракций с нанометрическими размерами.
Распределение частиц по размерам
70
60
50
40
30
20
10
0
0
1000
2000
3000
4000
5000
6000
7000
8000
размер частиц, нм
Рисунок 11 - Распределение полиэтилцианоакрилатных наночастиц,
иммобилизованных капреомицина сульфатом
Из рисунка видно значительное образование агломератов с размерами
2800-6000 нм, при этом выход последних составляет 66 %. Данное
распределение, по всей видимости, связано с достаточно высокой ионной
силой раствора, вызвавшая процесс коагуляции.
С целью преодоления эффекта коагуляции капреомицина сульфат вводили
через определенные промежутки времени после начала реакции, результаты
которых приведены в таблице 7.
Полидисперсность полиэтилцианоакрилатных наночастиц, определенная
методом фотонной корреляционной спектроскопии, равнялась 0,569 при
добавлении капреомицина сульфата в реакционную среду непосредственно до
начала реакции, а при введении лекарства через 5 мин после начала реакции
значение полидисперсности изменилось незначительно, и составила 0,739
(таблица 7).
Полимерные частицы в этом случае имели средний размер несколько
ниже, в интервале 300-400 нм, однако не удалось избежать образования
крупных агломератов размерами от 3000 до 6500 нм и со степенью коагуляции
42 %.
65












интенсивность









Taблица 7 – Полиэтилцианоакрилатные наночастицы, иммобилизованные
капреомицина сульфатом
Добавление лекарства в полимеризационную среду через определенные
промежутки времени после начала реакции позволило снизить степень
коагуляции, так, в случае введения капреомицина сульфата через 20 минут с
начала реакции, степень коагуляции равнялась 11 % (рисунок 12).
Распределение частиц по размерам
12
10
8
6
4
2
0
0
1000
2000
3000
4000
5000
6000
7000
8000
разме р частиц, нм
Рисунок 12 - Распределение полиэтилцианоакрилатных наночастиц,
иммобилизованных капреомицина сульфатом
С целью оптимизации условий синтеза полиэтилцианоакрилатных
наночастиц, иммобилизованных капреомицина сульфатом и для получения
полимерного латекса с мономодальным распределением наночастиц, на
66











|
Характеристики полиэтилцианоакрилатных наночастиц |
Время ввода капреомицина сульфата | ||||
|
0 мин |
5 мин |
10 мин |
20 мин |
30 мин | |
|
Средний диаметр частиц, d, нм |
550 |
378,3 |
350,2 |
219,5 |
132,3 |
|
Полидисперсность наночастиц |
0,569 |
0,739 |
0,315 |
0,148 |
0,042 |
|
Mn |
2323 |
2032 |
2201 |
2000 |
2012 |
|
Mw/Mn |
1,14 |
1,27 |
1,23 |
1,23 |
1,12 |
|
Связывание, % |
76,3 |
63,0 |
51,2 |
40,5 |
33,23 |
|
Степень коагуляции, % |
66 |
42 |
28 |
11 |
0 |




















интенсивность
следующем этапе лекарство добавляли в систему через 30 мин после начала
реакции. Таким способом синтезированы полимерные наночастицы со средним
диаметром 132,3 нм (таблица 7).
Из таблицы 7 видно, что получение полиэтилцианоакрилатных наночастиц
введением капреомицина сульфата через 30 мин после начала реакции
способствует стабилизации системы и оптимизации основных физико-
химических характеристик конечных наночастиц: система приближена к
монодисперсной, образование агрегированных частиц не наблюдается и
степень коагуляции сводится к нулю, о чем свидетельствуют данные,
полученные методом фотонной корреляционной спектроскопии
(полидисперсность = 0,042).
Добавление капреомицина сульфата в реакционную среду через 30 мин
после начала полимеризации приводит к образованию частиц с меньшими
размерами (132,3 нм) (таблица 7) по сравнению с пустыми наночастицами
полиэтилцианоакрилата (153,7 нм) (таблица 6). Значения молекулярных масс
полиэтилцианоакрилата, пустых и иммобилизованных лекарством, отличаются
на 2-3 мономерных звена, что не влияет на свойства полимера.
Для анализа морфологии наночастиц нами сделаны снимки на
сканирующем электронном микроскопе, результаты которых показаны на
рисунке 13. На приведенных снимках видны сферические структуры
нанометрических размеров. В случае добавления лекарства до начала реакции,
заметно образование агломератов (рисунок 13, b).
Из рисунка 13,с заметно, что поверхность частиц несколько
деформирована, возможно, из-за частичного инициирования реакции
лекарством. Из электронно-микроскопического снимка (рисунок 13, d) видно,
что при добавлении лекарства в систему через 30 мин после начала реакции
сформировалась практически монодисперсная система с незначительным
количеством частиц более крупного размера.
Результаты по степени связывания, определенные методом УФ-
спектроскопии, показали, что добавление лекарственного вещества в
реакционную среду через определенный период времени после начала
полимеризации несколько снижает степень включения биологически активного
вещества в полимерную матрицу. Степень связывания капреомицина сульфата
с полиэтилцианоакрилатными наночастицами при введении лекарства через 30
мин после начала реакции составляет более 30 %, что является достаточно
высоким показателем и вполне удовлетворяет требованиям полимерных
носителей лекарственных препаратов.
Полученные данные свидетельствуют о возможности получения
полимерных форм на основе полиэтилцианоакрилатов, содержащих
капреомицина сульфат [145,146].
67
Пустые полиэтилцианоакрилатные наночастицы (a) и наночастицы,
иммобилизованные капреомицина сульфатом, введенного в систему через 0
мин (b), 5 мин (c) и 30 мин (d) после начала реакции. ( 2000 нм)
Рисунок 13 – Электронно-микроскопические снимки пустых
полиэтилцианоакрилатных наночастиц
Полиэтилцианоакрилатные наночастицы, иммобилизованные
противотуберкулезным препаратом капреомицина сульфатом также
исследовали методами масс-спектрометрии, ИК-спектроскопии и
термогравиметрии. Результаты масс-спектрометрического анализа пустых
полиэтилцианоакрилатных наночастиц и полимера, иммобилизованного
капреомицина сульфатом приведены на рисунке 14.
68




Voyager Spec #1[BP = 1557.5, 40403]
(1)
100
90
1307.4319
1432.4929
1557.5496
1807.6677
1933.7282
4.0E+4
2058.7913
80
1182.3747
2183.8517
70
2308.9171
60
1057.3168
2433.9797
50
40
807.1986
932.2569
2559.0384
2684.0991
2809.1642
30
1685.6054
1810.6650
2934.2264
3059.2871
20
1337.4333
1560.5479
1462.4870
1837.6448
2088.7643
2338.8849
3184.3451
3310.3992
10
962.2673
935.2987
1087.3267
1212.3772
1277.4207
1109.6542 1340.4400
1527.5423
1590.5534
1778.6840
2061.7918
2053.4390
1992.7166
2311.9134
2278.9439
2466.9436
2588.9949
2687.0951
2717.0692
2937.2216
2967.1822
3187.3341
3560.5179
3465.4246
3810.6319
3715.5424
0
799.0
1439.4
2079.8
2720.2
3360.6
0
4001.0
Mass (m/z)
Voyager Spec #1[BP = 1307.4, 706]
(2)
100
90
807.1763
1057.2762
1182.3401
1307.3789
1432.4387
706.0
1557.4918
80
1682.5418
70
1807.5818
60
1933.6305
2183.7295
50
2308.7753
40
1027.2703
2433.8078
2558.8671
30
902.2160
1152.3290
1402.4334
2683.8922
20
1527.4878
1778.5802
2808.9647
2933.9982
10
810.1518
962.2397
1185.3583
1155.3185
1337.3970
1405.4098
1685.5329
1588.5000
1655.5399
1715.5357
1903.6395
1838.5785
1936.6282
1965.6476
2153.7075
2213.7228
2156.7312
2403.8100
2463.8176
2406.8565
2653.8808
2838.9702
3060.0347
3185.0619
3089.0194
3312.1178
3435.1664
3560.2151
3810.2641
3714.2994
0
799.0
1439.4
2079.8
2720.2
3360.6
0
4001.0
Mass (m/z)
Рисунок 14 – Масс-спектр пустых (1) и иммобилизованных капреомицина
сульфатом (2) полиэтилцианоакрилатных наночастиц
Из масс-спектров полиэтилцианоакрилата можно увидеть, что полимеры
имеют широкое молекулярно-массовое распределение. В обоих спектрах видно,
что кроме основных пиков есть дополнительные пики с разницей в
молекулярной массе ± 30, что, по всей видимости, связано с образованием
формальдегида,
высвобождающегося с одного конца цепи
полиэтилцианоакрилата.
Далее наночастицы, иммобилизованные капреомицина сульфатом
исследовали методом ИК-спектроскопии, результаты которого приведены на
рисунке 15.
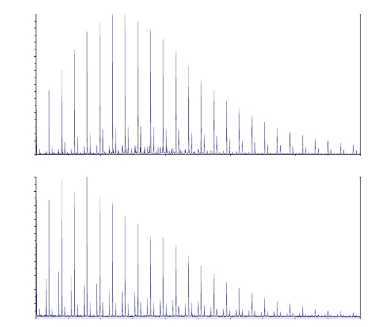
69
% Inten sity
% Inten sity
2
3
1
Рисунок 15 - ИК-спектры с KBr полиэтилцианоакрилата (1), полимера с
лекарством (2) и капреомицина сульфата (3)
Спектр полиэтилцианоакрилата соответствует ИК-спектрам, приведенным
в литературных источниках [73, c.4380; 92, c.5145; 147]. Из спектра полимера с
капромицина сульфатом, можно увидеть, что основные характеристические
пики полиэтилцианоакрилата 2988 cм-1 (m, CH2, CH3), 1750 cм-1 (vs, C=O), 2250-
2249 cм-1 (m, CN), 1255-1254 cм-1 (vs, C - O) не изменились после введения
лекарства в полимерную матрицу, что является свидетельством того, что
лекарство не связалось с полимером химически (ковалентными связями).
Вследствие сложной структуры капреомицина сульфата, в его спектре не
видны пики отдельных химических групп (рисунок 15).
В обоих спектрах (пустых полиэтилцианоакрилатных наночастиц и
полимера, иммобилизованного капреомицина сульфатом) пик на 3129-3126 cm-1
(w, C=C), соответствующий двойной связи в структуре мономера, не найден,
что является подтверждением того, что этилцианоакрилат прореагировал
полностью. Результаты термогравиметрического анализа пустых и
иммобилизованных капреомицина сульфатом наночастиц
полиэтилцианоакрилата, приведены на рисунке 16.
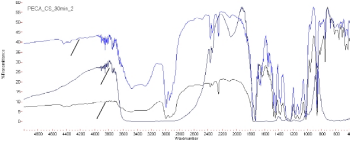
70

3
1
2
Рисунок 16 - Термогравиметрические кривые полиэтилцианоакрилата (1),
полимера с лекарством (2) и капреомицина сульфата (3) при скорости
нагревания 10 град/мин
Из полученных кривых можно сделать вывод о том, что термическая
деградация полиэтилцианоакрилата с лекарством, протекает медленнее
деградации пустых полиэтилцианоакрилатных наночастиц (рисунок 16).
Кривую термической деградации полиэтилцианоакрилата можно описать,
разделив ее на 3 части: полиэтилцианоакрилат начинает деградировать при 1200
C (99,77 %), процесс идет стремительно до 184,780C, где более 71 %
полиэтилцианоакрилата подверглось деградации, после достижения этой точки,
деградация полимера идет гораздо медленнее до 4000C, при этом в системе
остается только 15 % полимера. И по достижении этой точки деградация
полимера протекает стабильно.
Термическая деградация полиэтилцианоакрилата, иммобилизованного
капреомицина сульфатом, начинается гораздо раньше - при 77,50C (99,74 %), но
протекает медленнее. При 184,780C деградировало более 85 % полимера, после
этого скорость деградации полиэтилцианоакрилата, иммобилизованного
капреомицина сульфатом, снижается и до 3100C идет стабильно. Далее
деградация полимера идет быстрее и при 5000C в системе остается менее 3 %
полиэтилцианоакрилата с лекарством.
Таким образом, изменение в скорости термической деградации
полиэтилцианоакрилата произошло из-за влияния иммобилизованного
лекарства, содержащегося в полимерной матрице.
Данные, полученные физико-химическими методами анализа (масс-
71


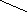



спектрометрии, ИК-спектроскопии и термогравиметрии) позволяют сделать
вывод о том, что некоторое количество лекарства иммобилизовано в матрицу
полиэтилцианоакрилатных наночастиц.
Немаловажным фактором применимости полимер-иммобилизованных
форм лекарственных препаратов является возможность биодеградации
последнего, оказывающая непосредственное влияние на терапевтический
эффект.
Известно, что высвобождение лекарства из полимерных микро- и
наночастиц может происходить посредством десорбции лекарства,
находящегося на поверхности полимера и/или диффузии лекарственного
вещества в результате эрозии полимерной матрицы [15, c.29; 68, c.650; 70,
c.535].
При создании полимер-иммобилизованных комплексов капреомицина
сульфата, важным является изучение кинетики высвобождения лекарственного
вещества из наночастиц. Характер выделения лекарства из полимерной
матрицы главным образом, зависит от скорости и механизма эрозии и
деградации полимера. В настоящем исследовании лекарственный препарат
распределен как по поверхности, так и объему полимера, то капреомицина
сульфат переходит в окружающую среду в результате вышеуказанных
эффектов.
Кинетику высвобождения лекарства из полиэтилцианоакрилатных
наночастиц изучали в фосфатном буфере при рН 7,4 в течение суток методом
УФ-спектрофотометрии, результаты которых приведены на рисунке 17.
100
2
80
60
40
20
0
1
0
5
10
15
20
25
Время, ч.
Рисунок 17 - Зависимость скорости деградации полиэтилцианоакрилата (1) и
высвобождения (2) капреомицина сульфата от времени
Из рисунка 17 видно, что скорость высвобождения лекарства довольно
72

































Скорость разложения наночастиц
ПЭЦА/скорость высвобождения КС, %
высокая в начале процесса: 10 % капреомицина сульфат высвобождается в
течение первого часа, 20 % иммобилизованного лекарства - за 3 часа, и около
50 % лекарства высвобождается из полимерных наночастиц в течение 8 часов, а
остальное количество высвобождается в течение суток.
Важно отметить, что период полувыведения самого капреомицина
сульфата находится в пределах 3-6-ти часов. Таким образом, иммобилизация
капреомицина сульфата в полиэтилцианоакрилатные наночастицы дает
возможность трехкратного увеличения периода полувыведения капреомицина
сульфата, что позволяет уменьшить или избежать частого дозирования
лекарственного препарата. По литературным данным время выделения
лекарства может быть продлено увеличением молекулярной массы полимера
и/или с использованием мономера с более длинной боковой цепью (бутил-,
гексилцианоакрилата) [15, c.29; 68, c.650; 70, c.535], связанной с более
медленной эрозией полимерной матрицы и деградацией, что является объектом
последующих исследований.
Довольно быстрое высвобождение капреомицина сульфата из полимерных
наночастиц на первоначальном этапе можно объяснить возможностью
десорбции некоторого количества лекарства с поверхности
полиэтилцианоакрилатных наночастиц.
Далее представилось интересным исследование процессов эрозии
полимерных матриц и деградации, как пустых, так и иммобилизованных
лекарственным препаратом. На рисунке 18 приведены данные по кинетике
эрозии
и деградации пустых полиэтилцианоакрилатных наночастиц,
исследованных УФ-спектрофотометрически.
100
80
60
40
20
1
2
0
0
2
4
6
8
10
12
Время, ч.
Рисунок 18 - Зависимость разложения пустых (1) и иммобилизованных
капреомицина сульфатом (2) наночастиц во времени
Из кривой зависимости видно, что около 50 % пустых наночастиц
73
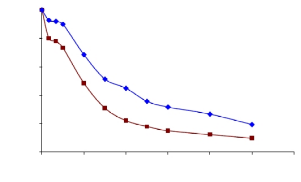
Разложение наночастиц, %
подверглось разложению за 3 часа, а остаток через 10 часов составил 19,4 %
полимера. Далее исследовали разложение наночастиц с биологически активным
веществом во времени (рисунок 18). Из рисунка видно, что разложение
наночастиц полэтилцианоакрилата, иммобилизованного капреомицина
сульфата происходит несколько быстрее. На первом этапе около 70 %
полэтилцианоакрилат разлагается в течение 3-х часов, связанное, по всей
видимости, с более высокой эрозией поверхности полимера и деградацией
полэтилцианоакрилата блоками.
Экспериментальные данные показывают, что полимер, иммобилизованный
капреомицина сульфат, деградирует быстрее, чем пустые
полиэтилцианоакрилатные наночастицы. Таким образом, полученные
результаты дают основания утверждать, что присутствие лекарства в
полимерной матрице нескльно ускоряет процесс разложения наночастиц.
В биологических условиях полимеры подвергаются деструкции с
изменением или без изменения в их химической структуре или они могут
деградировать химически, также могут иметь место оба процесса. Существуют
2 общепринятых механизма деградации полиалкилцианоакрилатов [15, c.29; 68,
c.650; 70, c.535]:
1) Деградация основной цепи полимера с образованием формальдегида.
2) Отщепление эфирной группы, приводящее к образованию растворимой
полиалкилцианоакриловой кислоты.
Первый способ деградации является обратным реакции конденсации
Кневенагеля, и полагают, что деструкция полиалкилцианоакрилатов этим
путем протекает гораздо медленнее. При деградации вторым способом,
основная цепь полимера остается незатронутой, но гидрофобная цепь
становится все более и более гидрофильной, пока не станет полностью
водорастворимой, а образующиеся в результате деградации
низкомолекулярные продукты выводятся из организма за короткий срок. На
сегодняшний день увеличивается количество работ, указывающих на
преобладание деградации полиалкилцианоакрилатов вторым путем над первым
[15, c.29; 68, c.650; 70, c.536].
Схема химической деградации полиалкилцианоакрилатов гидролизом
эфирной группы, приводящая к образованию спирта и
полиалкилцианоакриловой кислоты, показана ниже (рисунок 19).
CN
CN
CN
CN
CN
CN
OH-
- CH2 - C - CH2 - C - CH2 - C -
- nROH
- CH2 - C - CH2 - C - CH2 - C -
COOR
COOR
COOR
COO-
COO-
COO-
Рисунок 19 - Деградация полиалкилцианоакрилатов
74







Полиалкилцианоакрилаты относятся к быстро деградируемым полимерам,
таким образом, они могут покидать организм в течение нескольких дней [15,
c.30]. Скорость деградации полиалкилцианоакрилатов зависит от длины
боковой цепи: чем длиннее цепь, тем медленнее процесс деградации (т.е.
полиметил-
и полиэтилцианоакрилаты подвергаются очень быстрой
деградации) [15, c.29; 68, c.651. Возможно этим и объясняется относительно
быстрая биодеградация полиэтилцианоакрилата. Кроме того, низкая
молекулярная масса полимера (около 2000) также может быть причиной его
быстрой деградации. Выделение этанола в среду в результате деструкции, как
показано в схеме, свидетельствует о деградации полиэтилцианоакрилата
вторым путем. Так, методом газовой хроматографии обнаружено, что
содержание этанола в среде составило 6,8 %. На основании вышеизложенного
можно заключить, что только небольшая часть (около 7 %)
полиэтилцианоакрилата, иммобилизованного лекарством, деградировало
посредством гидролиза эфирной группы. Далее не удалось УФ-
спектрофотометрически определить количество высвободившегося лекарства
из-за образования этанола в среде, пик которого покрывал область поглощения
лекарства.
Таким образом в результате проведенных исследований показано, что
высвобождение эрозией поверхности наночастиц превалирует над процессами
деградации макромолекул полимерных матриц. Из вышесказанного можно
заключить, что полимеры на основе этилцианоакрилата могут быть
использованы в качестве носителей для транспорта противотуберкулезного
препарата капреомицина сульфата. Высвобождение лекарства из
полиэтилцианоакрилатных наночастиц происходит вследствие деградации
полимера. Установлено, что включение капреомицина сульфата в матрицу
полиэтилцианоакрилата позволяет увеличить время полувыведения лекарства в
3 раза, таким образом пролонгируя действие лекарственного препарата.
3.1.2 Синтез и характеристика полиэтилцианоакрилатных нанокапсул,
иммобилизованных противотуберкулезным препаратом капреомицина
сульфатом
Наиболее оптимальным путем при разработке наносомальных форм
лекарственных препаратов является создание нанокапсул
на основе
биосовместимых полимеров, так как будучи полой, капсулы имеют большую
емкость, что позволяет надеяться на максимальное наполнение их лекарством.
В настоящее время существуют различные методы приготовления пустых
структур для различных целей. Пустые микро- и нанокапсулы играют
немаловажную роль и в фармацевтическом производстве. Капсулирование
лекарств в пустые полимерные наноструктуры дает специальные возможности,
такие как защита лекарства от разложения в биологической среде, скрытие
неприятного
вкуса лекарства, более того, возможно осуществление
контролируемого высвобождения лекарственного вещества через
75
полупроницаемую и/или стимул-чувствительную (термо-
и/или рН-
чувствительную) мембрану или обеспечение высвобождения биологически
активного вещества созданием биодеградируемой оболочки. Для получения
нанокапсул используются различные методы, например, нанесение одного слоя
на другой в случае липосом и везикул [26, c.413; 27, c.5122; 28, c.7315; 29,
c.1861], метод «жертвенного» ядра, при котором ядро капсулы удаляют после
образования плотной, стабильной оболочки [26,
c.414],
межфазная
полимеризация или поликонденсация в миниэмульсиях [26, c.413; 27, c.5122;
28, c.7315; 29, c.1861] и другие [26, c.416]. Один из наиболее эффективных
способов синтеза пустых или наполненных полимерных капсул – проведение
полимеризации на поверхности соприкосновения фаз вода в масле (в/м) или
масло в воде (м/в). Этот метод позволяет получить нанокапсулы, содержащие
жидкое ядро, в одну стадию с удовлетворительными характеристиками.
Схема получения нанокапсул методом межфазной полимеризации в
инверсионных миниэмульсиях показана на рисунке 20.
фаза А – органическая фаза, фаза B – водная фаза
Рисунок 20 - Упрощенная схема принципа полимеризации в инверсионных
миниэмульсиях
В настоящей работе исследована возможность нанокапсулирования
капреомицина сульфата полиэтилцианоакрилатом.
Полиэтилцианоакрилатные нанокапсулы получали инверсионной
полимеризацией этилцианоакрилата в миниэмульсии по модифицированной
методике, приведенной в работе [32, c.122]. Органическую фазу, состоящую из
циклогексана и смеси ПАВ (Твин 80 : Спен 80 = 1:1, в целом 10 % от массы
органической фазы) добавляли воду, эту смесь интенсивно перемешивали в
течение 30 минут при комнатной температуре (298 К). Затем макроэмульсию
молочного цвета подвергали ультразвуковой обработке в течение 20 минут (по
2 минуты с перерывами и 10 мин без перерыва) при 50 % амплитуде (в режиме
5 сек. - УЗ, 10 сек. – пауза). В течение этого процесса систему охлаждали
льдом. рН водной среды поддерживали 2,0-2,5 буферным раствором. Затем,
отобрав из образовавшейся миниэмульсии 10 мл, по каплям добавляли
рассчитанное количество этилцианоакрилата (ЭЦА) и катализатора при
постоянном перемешивании (600 об/мин). После 4-х часов полимеризации
76
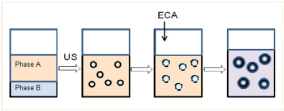
полиэтилцианоакрилатные нанокапсулы отделяли от органической фазы
центрифугированием при 14000 об/мин в течение 1ч., промывали и
диспергировали в воду.
На первоначальном этапе изучена возможность получения пустых
нанокапсул полиэтилцианоакрилата при варьировании концентрации мономера
(таблица 8).
Таблица 8 - Инверсионная полимеризация этилцианоакрилата: Т = 250С, [kat] =
0,01 %, [Твин 80] = [Спен 80] = 10 %
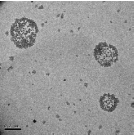
На электронно-микроскопических снимках (рисунок 21) показаны
наноструктуры, синтезированные в результате полимеризации в инверсионной
миниэмульсии и после обработки образцов ультразвуком (УЗ).
[ЭЦА] = 0,89 моль/л от водной фазы (
200 нм)
Рисунок 21 – Электронно микроскопические снимки наноструктур
полиэтилцианоакрилата
Из рисунков видно, что синтезированы твердые частицы
полиэтилцианоакрилата размерами 80-100 нм, но образование нанокапсул не
наблюдается, а также заметно формирование ассоциациатов частиц очень
малого размера, что, по всей видимости, связано с тем, что полученные в
процессе реакции пустые капсулы из-за рыхлости оболочек, коллапсировали
под воздействием УЗ на стадии их диспергирования в воду, что привело к
77

|
№ п/п |
[M], моль/л |
Размер нанокапсул, d, нм |
Mn |
Выход нанокапсул, % |
|
1 2 3 4 |
0,89 0,67 0,53 0,42 |
86 78 70 350 |
780 650 626 596 |
84 80 88 82 |
образованию твердых полиэтилцианоакрилатных наночастиц. При получении
нанокапсул, предпочтительнее формирование капсул с достаточно плотной
оболочкой, так как в противном случае могут образоваться твердые частицы в
результате коллапса капсул при обработке их ультразвуком. С целью синтеза
полимера с более высокой молекулярной массой и капсул с плотной оболочкой
в последующих экспериментах содержание этилцианоакрилата уменьшили до
0,67 моль/л (7,5 % от массы водной фазы). Результаты приведены на рисунке
22.
[ЭЦА] = 0,67 моль/л от водной фазы (
200 нм)
Рисунок 22 - Электронно-микроскопические снимки наноструктур
полиэтилцианоакрилата
Из трансмиссионно-электронно микроскопических снимков
полиэтилцианоакрилата можно заключить, что помимо образования пустых
наноструктур искаженной формы, в системе также имеются твердые частицы
полимера. Образовавшиеся структуры «ядро-оболочка» имеют размеры 50-100
нм (рисунок 22). Из рисунков также видно, что оболочки капсул недостаточно
плотны, и поэтому стены некоторых капсул частично разрушены, а результате
чего на снимках видны бесформенные структуры. Мягкие и тонкие стены
нанокапсул могут вызвать утечку вещества изнутри капсул, так как ядро капсул
является жидкостью (например, раствором лекарства).
С целью получения стабильных нанокапсул полиэтилцианоакрилата
78
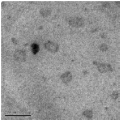
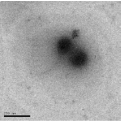


концентрацию мономера уменьшили до 0,53 моль/л (6 % от массы водной
фазы), однако это не дало желаемых результатов, - получены твердые частицы
нанометрического размера (рисунок 23).
[ЭЦА] = 0,53 моль/л от водной фазы (
200 нм)
Рисунок 23 - Электронно-микроскопические снимки наноструктур
полиэтилцианоакрилата
В последующих экспериментах, варьируя соотношения компонентов
системы (Твина 80 и Спена 80, водной и органической фаз, концентрацию
мономера) найдены оптимальные условия синтеза пустых нанокапсул
полиэтилцианоакрилата. Так, для получения полиэтилцианоакрилатных
нанокапсул наиболее оптимальным соотношением ПАВ можно считать: Твин
80 : Спен 80 = 1:1 (10 % от массы органической фазы), концентрацию мономера
- СЭЦA = 0,42 моль/л от массы водной фазы, соотношение органической и
водной фаз 3,8 : 1 соответственно. В результате использования таких
соотношений компонентов инверсионной полимеризацией в миниэмульсии
синтезированы пустые нанокапсулы полиэтилцианоакрилата с
удовлетворительными характеристиками [148]. На рисунке 24 приведены
электронно-микроскопические снимки полученных полиэтилцианоакрилатных
нанокапсул после диспергирования их в воду.
Из приведенных снимков видно, что полученные нанокапсулы имеют
правильную сферическую форму и оболочку средней толщины, что важно при
синтезе нанокапсул, так как толщина стенки нанокапсул и деградирующая
способность полимера определяют характер и скорость высвобождения
капсулированного соединения.
Молекулярная масса полученных нанокапсул полиэтилцианоакрилата,
определенная методом гель проникающей хроматографии, составила около 600
(596), что соответствует приблизительно 4 звеньям мономера. Образование
полимера низкой молекулярной массы может быть связано с достаточно
высокой скоростью процесса полимеризации, что, по всей видимости, привело
79


к образованию коротких олигомерных цепей. Выход нанокапсул, определенный
методом гравиметрии, составил 80 %.
[ЭЦА] = 0,42 моль/л от водной фазы (
200 нм)
Рисунок 24 - Электронно-микроскопические снимки пустых нанокапсул
полиэтилцианоакрилата
Полученные нанокапсулы, ядром которых является вода, дают
возможность в дальнейшем осуществить капсулирование водорастворимых
соединений, в том числе, гидрофильных лекарственных препаратов. Средний
размер нанокапсул составляет 300-400 нм, что отвечает требованиям
полимерных носителей лекарственных препаратов.
В продолжение исследований нами осуществлена попытка
нанокапсулирования противотуберкулезного препарата капреомицина
сульфата. Синтез полиэтилцианоакрилатных нанокапсул, иммобилизованных
лекарством, проводили растворением капреомицина сульфата в водной фазе,
используя соотношение [ЭЦА] : [КС] = 1:1. Полученные нанокапсулы,
содержащие капреомицина сульфат, промывали водой, затем этанолом и
сушили на воздухе. Снимки полученных нанокапсул, иммобилизованных
лекарством, приведены на рисунке 25.
[ЭЦА] : [КС] = 1 : 1, (
500 нм)
Рисунок 25 - Электронно-микроскопические снимки полиэтилцианоакрилатных
нанокапсул, иммобилизованных капреомицина сульфатом
80

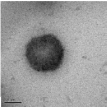

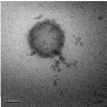


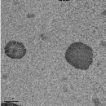
Данные, полученные фотонной корреляционной спектроскопией, показали,
что средний диаметр иммобилизованных лекарством нанокапсул составил 512
нм, что
коррелирует с результатами трансмиссионной электронной
микроскопии.
Эффективность включения капреомицина сульфата в
полиэтилцианоакрилатные нанокапсулы определяли по методике, приведенной
в работе [32, c.125]: высушенные до постоянной массы капсулы, содержащие
лекарство растворяли в хлороформе (1 мг/мл), затем лекарство экстрагировали
из органической фазы фосфатным буферным раствором (рН 7,4) в течение 5
часов. Содержание лекарства в водном растворе определяли методом УФ-
спектроскопии (λmax = 268 нм). Эффективность включения капреомицина
сульфата в полиэтилцианоакрилатные нанокапсулы в этом случае составила
22,1 %. Довольно низкое содержание лекарственного вещества в нанокапсулах,
возможно, объясняется утечкой значительного количества лекарства из
нанокапсул, тонкие стенки которых, по всей видимости, были частично
разрушены во время их промывания и сушки.
В связи с этим, для получения капсул с оболочками достаточной толщины
и повышения эффективности включения лекарства в последующих
экспериментах концентрацию мономера варьировали в пределах 0,42-0,89
моль/л. Полученные результаты приведены в таблице 9.
Таблица 9 - Полиэтилцианоакрилатные нанокапсулы, иммобилизованные
капреомицина сульфатом: Т = 250С, [kat] = 0,01 %, [Твин 80] = [Спен 80] = 10 %
Из таблицы видно, что наиболее эффективным оказалась концентрация
мономера 0,89 моль/л, при которой удалось добиться увеличения
эффективности включения почти в 2 раза (таблица 9). Диаметр полученных
капсул уменьшается с увеличением концентрации этилцианоакрилата в
системе, что, по всей видимости, вызвано компактизацией структур полимера.
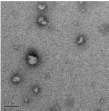
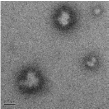
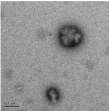
Электронно-микроскопические снимки полиэтилцианоакрилатных
нанокапсул, полученных при использовании концентрации мономера 0,89
моль/л, показаны на рисунке 26.
81
|
№ п/п |
[M], моль/л |
[ЭЦА] : [КС] |
Размер нанокапсул, d, нм |
Mn |
Степень включения, % |
Выход нанокапсул, % |
|
1 2 3 4 |
0,42 0,53 0,67 0,89 |
1,0:1 1,3:1 1,6:1 2,0:1 |
512 325 370 260 |
1156 1204 1248 1252 |
22,1 20,8 39,1 41,3 |
78 89 93 92 |
[ЭЦА] : [КС] = 2:1, (
500 нм)
Рисунок 26 - Полиэтилцианоакрилатные нанокапсулы, иммобилизованные
капреомицина сульфатом
В этом случае эффективность включения, рассчитанная с использованием
вышеназванной методики, составила 41,3 %, что является достаточно высоким
показателем.
Трансмиссионные электронно-микроскопические снимки указывают на
образование полиэтилцианоакрилатных нанокапсул со средним размером около
250-500 нм (рисунок 26), что согласуется с данными, полученными методом
фотонной корреляционной спектроскопии: средний диаметр капсул после
промывания и диспергирования их в воду с использованием УЗ, составил 260
нм (полидисперсность 0,438).
Молекулярная масса полученного продукта, определенная гель
проникающей хроматографией, составила Mn = 1252 (Mw = 2070, PDI = 1,65),
что приблизительно соответствует 10 мономерным звеньям (1250).
Таким образом, методом инверсионной эмульсионной полимеризации
получены полиэтилцианоакрилатные нанокапсулы, иммобилизованные
противотуберкулезным препаратом капреомицина сульфатом, с
удовлетворительными физико-химическими характеристиками и хорошей
морфологией, которые перспективны в качестве полимерных носителей.
82



3.1.3 Синтез полимерных наночастиц на основе полибутилцианоакрилата
для транспорта противоопухолевого препарата «Арглабин»
В настоящее время одной из важных задач современной медицины
является проблема лечения раковых заболеваний. По данным Международного
агентства по исследованию рака за 2000 г. злокачественная опухоль поразила
10 млн. человек в мире и привело к гибели 4/5 из них. Интенсивная терапия
раковых заболеваний с применением высоких доз сильнодействующих
препаратов приводит к выраженным побочным эффектам, в связи с этим,
разработка новых противоопухолевых препаратов и методов лечения
злокачественных опухолей до сих пор остается актуальной и не до конца
решенной проблемой.
На фармацевтическом рынке нашей страны в настоящее время существуют
различные препараты, обладающие высокой противоопухолевой активностью.
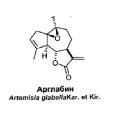
Одним из таких лекарственных препаратов является отечественный
противоопухолевый препарат «Арглабин», полученный АО МНПХ
«Фитохимия» из растения Центрального Казахстана полыни гладкой –
Artemisia glabella [149]. Исследование Арглабина и ряда его производных
показало, что наиболее выраженной противоопухолевой активностью обладают
эпоксиарглабин и гидрохлорид диметиламиноарглабина (рисунок 27).
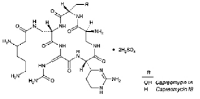
Эпоксиарглабин (далее нативный арглабин или субстанция) не нашел
применения в виду не растворимости в воде. В дальнейшем на основе
гидрохлорида диметиламиноарглабина, который обладает высокой
противоопухолевой активностью и является водорастворимым веществом, была
разработана лиофилизированная лекарственная форма для парентерального
введения – препарат «Арглабин».
Гидрохлорид
диметиламиноарглабина
Рисунок 27 - Структура Арглабина субстанции и гидрохлорида
диметиламиноарглабина
Отечественный препарат «Арглабин» обладает высокой
противоопухолевой активностью от трех видов рака (диссеминированной
формы рака молочной железы, рака легкого и первичного рака печени) и уже в
течение нескольких лет успешно используется в медицинской практике для
лечения раковых заболеваний в виде инъекций.
83



В целях повышения эффективности лекарственного препарата, встала
задача разработки новых форм Арглабина в виде наночастиц, способных
находить раковые клетки и действовать селективно, не повреждая здоровую
ткань, что позволит понизить токсичность лекарства и пролонгировать
действие препарата.
Одним из перспективных и наиболее часто используемых мономеров среди
алкилцианоакрилатов при получении полимерных носителей лекарственных
препаратов является бутилцианоакрилат, что подтверждается результатами
многочисленных исследований в этом направлении [15, c.5; 66, c.331; 70, c.540].
В связи с этим, в продолжение работ нами проведены исследования по
получению наночастиц, иммобилизованных противоопухолевым препаратом
«Арглабин» на основе полибутилцианоакрилата. Первоначально нами
проведены исследования по подбору оптимальных условий эмульсионной
полимеризации для получения ультрамелких частиц полибутилцианоакрилата.
Изменение рН среды в пределах 1,5-3,5 позволяет регулировать размер
наночастиц в интервале 250-500 нм. Существенное значение на размер
полимерных частиц в условиях эмульсионной полимеризации имеет
концентрация мономера. Нами выполнен ряд экспериментов по оптимизации
условий получения частиц нанометрического размера. Частицы
полибутилцианоакрилата выделяли с помощью мембранного фильтра с
диаметром пор 1000 нм.
С целью получения устойчивой эмульсии и возможности управления
процессом полимеризации варьировали соотношение реагирующих
компонентов (мономера, эмульгатора, стабилизатора и др.). В качестве
эмульгатора и стабилизатора в этом случае использовали Твин-85 и α,D-
глюкозу соответственно, при этом концентрацию Твина-85 изменяли от 0,5 до
5 % в расчете на массу бутилцианоакрилата. Полученные результаты
приведены в таблице 10.
Из приведенных данных видно, что оптимальная концентрация
эмульгатора (Твин-85), необходимая для получения гомогенной системы – 5
% от массы мономера. При содержании Твина-85 в составе раствора менее 5
% в расчете на массу бутилцианоакрилата образуется неустойчивая эмульсия
с выпадением в осадок агрегированных частиц. При содержании в растворе
эмульгатора 0,5% (от массы бутилцианоакрилата) частицы нанометрического
размера не образуются.
Для улучшения условий
проведения полимеризации сделан ряд
экспериментов в направлении регулирования температуры реакции.
Оптимальным
температурным режимом для проведения синтеза
полибутилцианоакрилатных частиц является 250С. С повышением температуры
реакция ускоряется и увеличивается выход полимера, но в то же время
снижается доля частиц с размерами менее 1000 нм (до 14,8 %).
84


Таблица 10 - Эмульсионная полимеризация бутилцианоакрилата при различных
концентрациях эмульгатора и стабилизатора: СБЦА = 0,133 моль/л
При увеличении концентрации мономера в растворе скорость
полимеризации возрастает, однако при этом уменьшается доля частиц,
размеры которых не превышают 1 мкм (таблица 11).
Таблица 11 - Эмульсионная полимеризация бутилцианоакрилата при различных
концентрациях мономера: [Э]=5%, [Глюкоза]= 0,056 моль/л, Т=250С
При концентрации мономера ниже 0,133 моль/л выход фракции до 1000
нм достаточно высок, выход полимера составляет 67%, что тоже вполне
приемлемо. При более высоких концентрациях мономера (>2%) значите льно
снижается доля частиц с необходимым размером (до 1000 нм), н апример, по
сравнению с раствором концентрацией 0,133 моль/л при концентрации
мономера в реакционной среде, равной 0,166 моль/л выход фракции полимера с
85






|
Твин-85 [Э], % |
Стабилизатор, α,D-глюкоза, моль/л |
Температура, 0 С |
Выход фракции с диаметром частиц до 1000 нм, % |
|
0,5 0,5 0,5 2,0 2,0 2,0 5,0 5,0 5,0 5,0 5,0 5,0 |
0,029 0,056 0,113 0,029 0,056 0,113 0,029 0,056 0,113 0,029 0,056 0,113 |
20 20 20 25 25 25 25 25 25 30 30 30 |
- - - 14,5 17,2 16,4 51,3 58,3 58,6 14,8 20,4 21,7 |
|
[М], моль/л |
Выход полимера за 2 ч., % |
Выход фракции с диаметром частиц до 1000 нм, от выхода полимера % |
|
0,0065 0,0328 0,0660 0,1330 0,1659 0,3440 0,7262 |
19 26 45 67 70 79 85 |
66 65 62 58 40 21 10 |
диаметром частиц менее 1 мкм снижается на 18%. По результатам
экспериментов концентрация бутилцианоакрилата 0,133 моль/л выбрана как
наиболее оптимальная для формирования полимерных частиц
нанометрического размера.
Далее проводили иммобилизацию полимера лекарственным препаратом
«Арглабин». При полимеризации алкилцианоакрилатов для достижения более
высокой степени включения лекарства в полимерные матрицы иммобилизацию
проводят гидрофильными формами лекарственных препаратов (например,
ампициллин, дактиномицин, доксорубицина гидрохлорид и т.д.) [74, c.57; 75,
c.1444; 80, c.108]. В связи с этим, в настоящей работе иммобилизация полимера
проведена водорастворимой формой лекарства
–
гидрохлоридом
диметиламиноарглабина.
Полибутилцианоакрилатные наночастицы, иммобилизованные
противоопухолевым препаратом «Арглабин» получали включением
лекарственного вещества в матрицу полимера непосредственно в среде
полимеризующегося мономера (использовалась гидрофильная форма лекарства
– гидрохлорид диметиламиноарглабина). При этом возникает трудность в
определении степени связывания полимера с лекарственным веществом. Для
определения количества сорбированного лекарства ранее был использован
спектрофотометрический метод. Однако недостаток данного метода состоит в
том, что на стадии ультрафильтрации некоторое количество связанного
Арглабина вымывается с фильтра в маточный раствор. Поэтому нами
разработан новый кондуктометрический метод, основанный на аддитивности
удельной электропроводности компонентов системы. Кондуктометрический
метод позволяет определить связывание Арглабина с
полибутилцианоакрилатом непосредственно в реакционной среде, без
предварительного выделения наночастиц. Для проведения измерений
использовался кондуктометр Type ОК-102 с платиновыми электродами и
термостатируемой электролитической ячейкой. Поскольку электропроводность
растворов является величиной аддитивной, определили электропроводности
компонентов системы и сделали соответствующие поправки.
Степень связывания лекарственного препарата рассчитывали по разности
масс исходного и несвязавшегося «Арглабина». Для концентраций
«Арглабина» 5-60 мкг/мл изменение значений удельной электропроводности
подчиняется линейному уравнению у=86,353х+1,4692. Результаты
кондуктометрического измерения растворов лекарства и ПАВ приведены на
рис.33.
С увеличением концентрации в воде диметиламиноарглабина
гидрохлорида удельная электропроводность (ϰ) раствора растет (рисунок 28).
Раствор ПАВ имеет значительно меньшую электропроводность даже при его
достаточно высокой концентрации. В присутствии ПАВ электропроводность
Арглабина несколько выше, что обусловлено аддитивностью величины
удельной электропроводности.
86



-4
35
2
30
25
20
15
10
5
0
1
0
0.05
0.1
0.15
0.2
0.25
0.3
0.35
САРГЛ.,мкг/мл
1 - зависимость ϰ от концентрации Арглабина в воде;
2 - зависимость ϰ от концентрации Арглабина в присутствии ПАВ
Рисунок 28 - Зависимость электропроводности от концентрации гидрохлорида
диметиламиноарглабина
Степень связывания полибутилцианоакрилата с Арглабином, определенная
кондуктометрическим методом составила около 75 %. Высокое значение
степени связывания полимера с лекарством позволяет надеяться на то, что
использование полибутилцианоакрилатных наночастиц, содержащих
«Арглабин» даст возможность повысить эффективность лекарства по
сравнению с применением стандартной формы препарата.
Таким образом, нами разработан оригинальный способ определения
степени связывания Арглабина в реакционной среде, синтезированы
полибутилцианоакрилатные наночастицы с высоким содержанием лекарства и
найдены оптимальные условия получения наночастиц [150].
Кондуктометрический метод количественного определения Арглабина в
реакционной среде пригоден для анализа не только степени связывания
лекарственного вещества, но и высвобождения биологически активного
вещества из полимерной матрицы. В продолжение исследований нами изучена
кинетика высвобождения лекарственного вещества из матрицы
полибутилцианоакрилата.
Кинетику высвобождения гидрохлорида диметиламиноарглабина изучали
в тех же условиях (рН 7,4, Т = 310 К) в течение нескольких дней, результаты
исследования приведены на рисунке 29.
87































100
2
80
60
40
20
1
0
0
20
40
60
80
Время,ч.
Рисунок 29 - Зависимость скорости деградации полибутилцианоакрилата
(1) и высвобождения (2) арглабина от времени
Из кривой зависимости видно, что, несмотря на довольно быстрое
высвобождение лекарства в начале (около 14 % за первые 20 мин), в целом,
арглабин высвобождается в среду достаточно медленно. Около 70 % лекарства
высвобождается из полибутилцианоакрилатных наночастиц в течение 10 часов,
тогда как через 24 часа степень высвобождения составила около 90 %, что дает
возможность продлить время пребывания лекарства в организме. Кривая
деградации полибутилцианоакрилата показывает, что характер деградации
является схожим с процессом деградации полиэтилцианоакрилата, но в случае
полибутилцианоакрилата деградация наночастиц идет медленнее, чем
деградация полиэтилцианоакрилатных наночастиц. Полибутилцианоакрилат
деградировал почти на 90% в течение суток, а через 3 суток в системе
оставалось только 6 % недеградировавшего полимера.
Таким образом, полибутилцианоакрилатные наночастицы могут послужить
перспективными полимерными носителями противоопухолевого препарата
«Арглабин».
