
- •Снимщикова и.А. Руководство по иммунологии
- •Содержание
- •Предмет и задачи иммунологии. Структура и функции иммунной системы.
- •Основные вехи становления и развития иммунологии
- •Иммунология медицине Иммунофармакология – лекарства нового («своеродного») типа: интерфероны, интерлейкины, миелопептиды, тимозины
- •Иммунологические феномены:
- •Строение органов иммунной системы
- •Строение и функции органов иммунной системы
- •Ф ункции тимуса
- •Клетки иммунной системы
- •Нобелевские лауреаты в области иммунологии
- •Завещание Альфреда Нобеля
- •Антигены и антитела
- •Классификация антигенов
- •Чужеродность
- •Химическая природа антигенов
- •Биологические свойства тимусзависимых и тимуснезависимых антигенов
- •Происхождение и химическая природа антигенов
- •Молекулярная масса
- •Специфичность антигенов
- •Строение антигена
- •Локализация и изменения антигенов в тканях.
- •В удалении антигенов из организма выделяют 3 фазы:
- •Антитела
- •Общий план строения иммуноглобулинов:
- •Гетерогенность иммуноглобулинов
- •Характеристика классов иммуноглобулинов
- •Антигенные свойства Ig.
- •Динамика выработки антител
- •И вторичном иммунном ответе
- •Функции т-лимфоцитов
- •Субпопуляции т-лимфоцитов
- •Гамма-, дельта (интраэпителиальные) – т-лимфоциты
- •Субпопуляции т-лимфоцитов
- •Маркеры т-лимфоцитов
- •Антигенраспознающий комплекс т-лимфоцита
- •Этапы селекции т – лимфоцитов
- •Нормативные показатели иммунофенотипирования клеток периферической крови здоровых людей
- •Методы идентификации т-клеток
- •Патология в системе т-клеточного иммунитета
- •Строение антигенраспознающего комплекса
- •Субпопуляции b-лимфоцитов
- •Онтогенез b-лимфоцитов
- •Плазматические клетки
- •Патология в системе b-лимфоцитов
- •Методы идентификации b-лимфоцитов
- •Антигенпредставляющие и фагоцитирующие клетки
- •Моноциты и макрофаги.
- •Онтогенез моноцитов/макрофагов
- •Функции макрофагов
- •Секреторная активность макрофагов
- •Стадии фагоцитоза
- •Стадии фагоцитоза
- •Дендритные клетки и их функции.
- •Полиморфно-ядерные фагоциты.
- •Гормоны и медиаторы иммунной системы
- •Основные тимические гормоны.
- •Классификация цитокинов:
- •Свойства цитокинов
- •Характеристика отдельных цитокинов.
- •(Ковальчук л.В., Ганковская л.В., 2001г.)
- •Биологические эффекты.
- •Биологические эффекты.
- •Интерфероны
- •Методы выявления цитокинов в биологических жидкостях
- •Иммунный ответ
- •Стадии иммунного ответа
- •Нарушения межклеточных взаимодействий и патология иммунной системы.
- •Перспективы изучения кооперации клеток в иммунном ответе.
- •Цитотоксические реакции иммунитета
- •Возрастная иммунология
- •Особенности иммунной системы новорожденного
- •Первый критический период (28 дней)
- •Клинико-иммунологические синдромы при патологии новорожденных
- •Общие закономерности развития иммунной системы у детей
- •Возрастные особенности изменения массы лимфоидных органов
- •Второй критический период (3-6 мес.)
- •Третий критический период - 2-й год жизни.
- •Четвертый критический период жизни (4 – 6 лет)
- •Пятый критический период (подростковый возраст: девушки – 12-13лет; юноши – 14 -15 лет)
- •Иммунный ответ при старении
- •Иммунологическая теория.
- •Иммунология репродукции.
- •Антитела к сперматозоидам.
- •Местный иммунитет репродуктивного тракта.
- •Иммунобиология оплодотворения.
- •Системный иммунитет при беременности.
- •Период лактации.
- •Патология беременности. Беременность, осложненная невынашиванием.
- •Трансплантационный иммунитет.
- •Иммунологические механизмы отторжения трансплантата.
- •Категории органов:
- •Предотвращение отторжения трансплантата
- •Противоопухолевый иммунитет Реализуется ничтожно малая доля тех опухолей, которые появились бы в отсутствие иммунного надзора. Ф. Бернет
- •Общая схема канцерогенеза
- •Группы опухолевых антигенов:
- •Вирусоспецифические антигены
- •Инфекционные агенты
- •Гетерогенные антигены
- •Типы изменения антигенных свойств тканей при малигнизации - “антигенная альтерация”.
- •Изменения поверхности опухолевых клеток:
- •Факторы, участвующие в развитии опухоли:
- •Перспективное направление иммунотерапии рака IV стадии
- •Механизмы противоопухолевой защиты:
- •Несостоятельность иммунитета и причины роста опухоли.
- •Антигены лейкоцитов
- •Антигены тромбоцитов
- •Основные показания к применению гемокомпонентов крови
- •Клиническая картина при несовместимости по аво антигенам:
- •Геномные локусы, структура и функции эритроцитарных антигенов
- •Инструкция по применению Цоликлонов Анти-а, Анти-в и Анти-ав диагностических жидких для определения групп крови человека системы аво (антитела моноклональные Анти-а, Анти-в, Анти-ав)
- •1. Назначение
- •2. Характеристика и основные свойства Цоликлонов Анти-а, Анти-в и Анти-ав
- •3. Техника определения групп крови человека системы аво с помощью Цоликлонов
- •4. Контроль специфичности реакции агглютинации
- •5. Форма выпуска
- •6. Хранение
- •Оценка иммунного статуса
- •Варианты иммунного статуса.
- •Варианты иммунного статуса для практически здорового населения
- •Этапы оценки иммунного статуса
- •Клиническое обследование:
- •Тесты оценки иммунного статуса
- •I уровень (ориентировочные):
- •II уровень (аналитические):
- •Правила интерпритации иммунограммы
- •Диагностика иммунодефицитных и иммунопатологических состояний при первичном иммунологическом обследовании.
- •Оценка иммунного статуса
- •Иммунодефицитные состояния. Первичные иммунодефициты.
- •Идс: настораживающие аспекты
- •Гуморальные иммунодефициты.
- •Транзиторная младенческая гипогаммаглобулинемия (тмг).
- •Комбинированные иммунодефициты.
- •Болезнь Луи – Бар (синдром атаксии и телеангиэктазии (ат))
- •Вторичные иммунодефициты
- •Классификация вторичных иммунодефицитов
- •Системные иммунодефициты. Причины возникновения
- •Клинические проявления вторичных ммунодефицитов (болезни-маски)
- •Общая классификация первичных и вторичных форм идс
- •Экологическая иммунология
- •Химические агенты внешней среды (ксенобиотики).
- •Основные заболевания (состояния), сопровождающиеся вторичным иммунодефицитом
- •Противоинфекционный иммунитет
- •Классификация бактериальных и вирусных антигенов.
- •Возбудитель
- •Анатомофизиологические барьеры
- •Пути активации системы комплемента
- •Биологическое действие антимикробных пептидов
- •Пути передачи вич-инфекции (g. Chin ,1992).
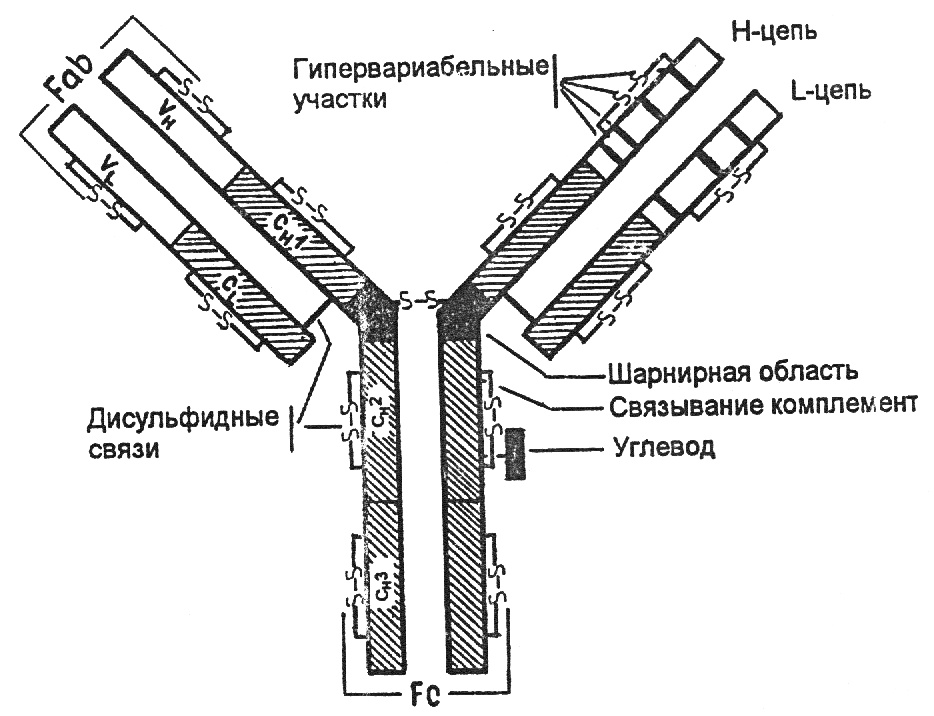
Общий план строения иммуноглобулинов:
На примере иммуноглобулина G можно видеть, что молекула Ig содержит 2 тяжелые и 2 легкие цепи, которые соединены дисульфидными связями. Каждая цепь содержит вариабельную и константную область, составляющие Fab (антигенсвязывающий фрагмент) и Fc- константный фрагмент. Гомологичные структурные участки легких и тяжелых цепей иммуноглобулинов, образуемые дисульфидными связями, называются доменами. Домены имеют одинаковые последовательности аминокислот. Каждый домен включает приблизительно 100-110 аминокислотных остатков.
Различают домены константных участков:
Сl, СН1, СН2, СН3.
Сl, СН1 домены – обеспечивают нековалентное связывание легких и тяжелых цепей и аллоантигенные различия антител.
СН2 – место присоединения углеводов и связывания комплемента.
СН3 – участок взаимодействует с Fc –рецептором на поверхности клеток, принимающих участие в иммунных реакциях.
При взаимодействии вариабельных Vl и Vh-доменов формируется антигенсвязывающий участок ат (активный центр). Изменения последовательности аминокислотных остатков этих доменов от белка к белку определяют меняющуюся специфичность антител.
Между СН1 и СН2 доменами находится шарнирная область, обеспечивающая подвижность Fab-фрагмента.
Рис. 9. Строение иммуноглобулина G
В основе реакции антиген – антитело лежит взаимодействие между эпитопами антигена и паратопами антитела, основанное на их пространственном соответствии (комплементарности).
Эти связи обусловлены следующими типами межмолекулярных сил:
Электростатическими (ионными, полярными)
Водородными
Гидрофобными
Силами Ван – дер – Вальса
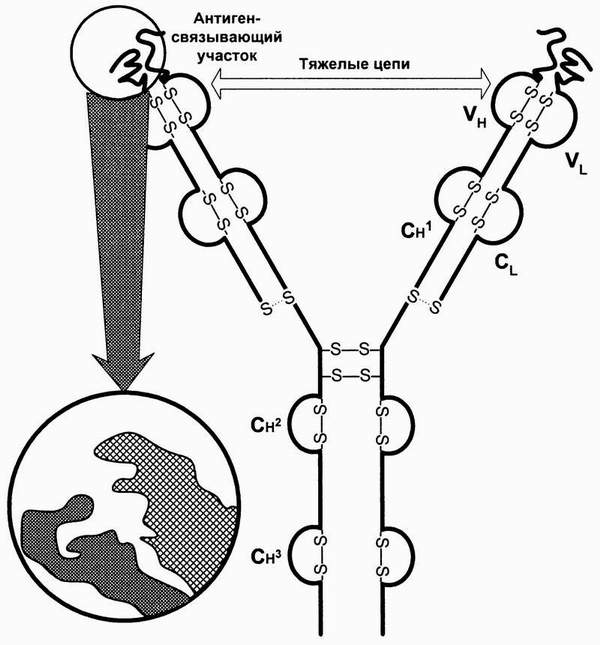
Рис. 10. Гетерогенность иммуноглобулинов.
Принадлежность иммуноглобулина к тому или иному классу или подклассу зависит от характерных особенностей строения тяжелых цепей (количества и последовательности аминокислотных остатков, молекулярной массы, количества доменов и др.). Тяжелые цепи бывают 5 типов (α, γ, δ, ε, µ). Легкие – только двух разновидностей – каппа и лямбда. Тяжелые цепи независимо от принадлежности к тому или иному классу или подклассу образуют комплекс либо с каппа, либо с лямбда типом. В зависимости от строения константных областей тяжелых цепей (Fc) иммуноглобулины разделены на 5 классов (IgA, IgM, IgG, IgD, IgE).
Гетерогенность иммуноглобулинов
Классы и подклассы |
Типы цепей |
|
Н |
L |
|
IgG1 |
γ |
κ, λ |
IgG2 |
γ |
κ, λ |
IgG3 |
γ |
κ, λ |
IgG4 |
γ |
κ, λ |
IgA1 |
α |
κ, λ |
IgA2 |
α |
κ, λ |
IgD |
δ |
κ, λ |
IgE |
ε |
κ, λ |
IgM |
μ |
κ, λ |
Характеристика классов иммуноглобулинов
Иммуноглобулины, в зависимости от особенностей строения константных областей тяжелых цепей, подразделяются на 5 основных классов: IgA, IgD, IgE, IgG, IgM. Каждый класс иммуноглобулинов характеризуется определенными свойствами и функциями. Иммуноглобулин G (молекулярный вес 160 000) составляет около 80% всех иммуноглобулинов человека и животных. Он содержится не только во внутрисосудистом русле, но легко проникает с экстраваскулярные пространства, где осуществляет важнейшую защитную функцию, благодаря токсиннейтрализующей, вируснейтрализую-щей, опсонизирующей и бактерицидной активности связанных с ним антител.
Особенно важное значение IgG у детей первых недель жизни, когда AT этого класса являются основными защитными факторами. В это время способность IgG проходить через клеточные мембраны обеспечивает проникновение IgG-антител матери через плацентарный барьер, а при грудном вскармливании — проникновение IgG-антител молока через слизистую оболочку кишечника новорожденного.
Иммуноглобулин А (молекулярный вес 170 000) — составляет около 16% сывороточных иммуноглобулинов и встречается в виде мономера (80%), димера (9S), три-мера (1 IS) и более крупных полимеров.
Сывороточный IgA у человека составляет менее 50% всего пула IgA. Кроме сыворотки крови он содержится в секретах кишечного и респираторного тракта, слезной жидкости, молока. Антитела этого класса осуществляют защиту слизистых оболочек от различных патогенных микроорганизмов, аллергенов и аутоантигенов.
Установлено, что IgA в основном функционирует на поверхности слизистых оболочек, непрерывно контактирующих с разнообразными антигенами. Это свойство IgA-антител тормозит развитие хронических местных воспалительных процессов. Связы-ваясь с антигенами, IgA-антитела задерживают их прилипание к поверхности клеток эпителия и препятствуют их проникновению во внутреннюю среду организма. В отличие от IgG- и IgM-антител, IgA-антитела не способны активировать комплемент по классическому пути и не вызывают выделения медиаторов воспаления при реакции с АГ.
Иммуноглобулин М (молекулярный вес 950 000) составляет 5-10% от общего количества иммуноглобулинов, а его концентрация в сыворотке приближается к 1 г/л.
На сегодняшний день идентифицировано 2 субкласса IgM, три четверти которого присутствует в сосудистом русле. Будучи пятивалентным, IgM прежде всего реагирует с нерастворимыми антигенами (агглютинация). При этом активация комплемента способствует проявлению цитотоксических эффектов.
К IgM-антителам относятся, например, изогемагглютинины, классический ревматоидный фактор, антитела, выявляемые в реакции Вассермана, большинство естественных антител, особенно против грамотрицательных бактерий.
IgM называют и макроглобулином, так как он является полимером и состоит из пяти четырехцепочных субъединиц (рис. 2).
IgM-антитела появляются на первом этапе иммунного ответа и находятся в основном в сосудистом русле. Поэтому им отведена важная защитная роль при бактериемии, на ранних стадиях различных инфекционных процессов.
Иммуноглобулин D (молекулярный вес 160 000) составляет всего 0,2% сывороточных иммуноглобулинов. IgD был обнаружен как парапротеин у больного миело-мой. Основная функция, очевидно, заключается в том, что на определенной стадии IgD выполняет роль антигенного рецептора В-лимфоцита. Во время беременности и при приеме пероральных противозачаточных средств концентрация IgD в сыворотке крови может возрастать почти вдвое. Также установлено, что с IgD могут быть связаны антитела против пенициллина, противоинсулиновые антитела у больных сахарным диабетом, некоторые другие аутоантитела.
Иммуноглобулин Е (молекулярный вес 190 000) присутствует в сыворотке в самой низкой концентрации (0,00002-0,0002 г/л). Однако IgE обладает высокой биологической активностью, цитофильностью, то есть способностью присоединяться к клеткам (тучным клеткам и базофилам), что приводит к их дегрануляции, выделению иазоактивных аминов, которые ответственны за проявление бронхиальной астмы, сенной лихорадки и других аллергических заболеваний. Уровень IgE существенно возрастает при некоторых инфекциях, особенно при глистных инвазиях. В настоящее нремя выделяют два вида IgE (общий и специфический).
К IgE относятся антитела типа реагинов. IgE не проходят через плаценту, не фиксируют комплемент, не переносят пассивную анафилаксию.
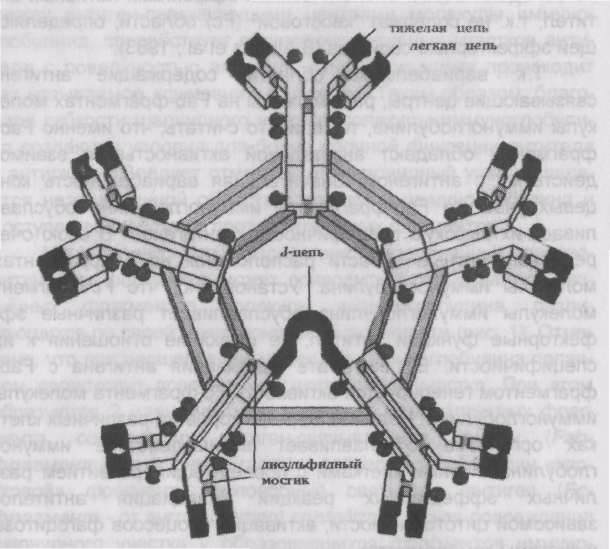
Рис. 11. Структура молекулы IgM
