
Вопрос 13.
Сера — элемент главной подгруппы VI третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Химические свойства:
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S+O2=SO2
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
S+3F2=SF6
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов:
2S+Cl2=S2Cl2
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
S+H2=H2S (сероводород)
C+2S=CS2 (сероуглерод)
При нагревании сера взаимодействует со многими металлами. При этом взаимодействии образуются сульфиды:
2Na+S=Na2S
Ca+S=CaS
2Al+3S=Al2S3
Fe+S=FeS
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
S+6HNO3(конц)=H2SO4+6NO2↑+2H2O
S+H2SO4(конц)=3SO2↑+2H2O
Аллотропия:
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток.
Молекула S8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°.
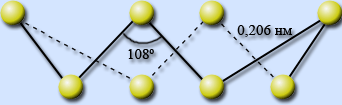
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.

 Пластическая
модификация серы образована спиральными
цепями из атомов серы с левой и правой
осями вращения. Эти цепочки скручены и
вытянуты в одном направлении.
Пластическая
модификация серы образована спиральными
цепями из атомов серы с левой и правой
осями вращения. Эти цепочки скручены и
вытянуты в одном направлении.

Распространенность серы в земной коре:
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы: FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды.
Вопрос 14.
Водный раствор SO2-сернистая кислота.Диоксид серы SO2 имеет наибольшое значение из соединений серы.Строение это ймолекулы аналогично строению молекулы озона O3(OO2), но отличаестя высокой термической устойчивостью.SO2(в обыч. Усл-х) -бесцветный газ, с резким запахом. В технике получают сжигаением серы и при обжиге пирита
4FeS + 11O2 = 8SO2 + 2Fe2O3
SO2 хорошо растворим в воде.
Действие кислот на сульфиты сопровождается выделением SO2, на этом и основано получение SO2 в лаборатории.
Для серы(VI) наиболее характерное координационное число 4, молекулы SO3 существуют лишь в газовой фазе.При охлаждении они полимеризуются в кольцеобразные или открытые зигзагообразные цепи(мономер,тример,полимер).Поэтому триоксид серы существует в виде нескольких модификаций.При конденсации паров SO3, образуется летучая жидкость, состоящая приимущественно из циклических тримерных молекул(SO3)3.
При охлаждении SO3 затвердеваяет в прозрачную массу , напоминающую лед- льдовидная модификация -SO3. При хранении она постепенно превращается в модификацию по внешнему виду напоминающую асбест. Асбестовая модификация α-SO3 состоит из зиг-загообразных цепей (SO3)∞ различной длины.
Структурные особенности модификаций SO3 Обуславливают различие их всех физических свойств и химической активности.
В технике оксид серы(IV) SO2 в присутствии катализатора(платина или оксид ванадия):
SO2+1/2O2=SO3
Тетраэдрические -связи серы(VI) возникают также при взаимодействии SO3 c некоторыми соединениями водорода, например с водой, газообразными HF,HCl
H2O + SO3=H2[SO4]
HF + SO3=H[SO3F].
2)Тетраоксосульфат водорода H2SO4 – маслянистая жидкость, замерзающая при 10,4о .Его получаю при охлаждении концентрированной серной кислоты. В твердом и жидком состоянии молекулы H2SO4 связанны водородными связями. Жидкий H2SO4 – ионизирующий растворитель. В водный растворах H2SO4- сильная двухосновная кислота.
Серную кислоту получают растворением SO3 в концентрированной H2SO4 в виду оулема(маслянистая, безцветная жидкость), содержащего 20-65% SO3.
