Вопрос 3.
Периодичность изменения характера хим.связи, что такое хим.связь и ее виды
2.2. Химическая связь
Если взять стакан с водой и бросить в него кристаллы поваренной соли (NaCl), то через некоторое время мы получим раствор хлорида натрия. Причем в этом растворе будет находиться в виде ионов Na+ и Cl-, а вода – в виде молекул (Н2О). Почему же некоторые вещества состоят из ионов, а другие из молекул? Ответ на этот вопрос дают сведения об электронном строении атомов, входящих в состав вещества, и о природе сил химической связи между ними в различных соединениях.
Экспериментальными данными установлено, что свойства веществ и их реакционная способность зависят от химического строения их молекул. При химических реакциях происходит разрыв одних связей между атомами и образование других, в результате чего одни вещества превращаются в другие. Учение о строении атома раскрывает механизм образования одних веществ из других.
Для объяснения связи в молекулах, состоящих из одинаковых атомов, в 1916–1918 гг. американские ученые Дж.Льюис и Ир. Ленгмюр высказали предположение, что химическая связь образуется за счет общей электронной пары, которая принадлежит обоим атомам.
Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС).
2.2.1. Основные принципы образования химической связи в молекулах по методу валентных связей
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны (с антипараллельными спинами), принадлежащие двум различным атомам, становятся общими для обоих атомов. Например, молекула водорода образуется при сближении двух атомов водорода. При этом возможны два случая:
а) сближаются атомы с параллельными спинами валентных электронов:

б) сближаются атомы с антипараллельными спинами валентных электронов:
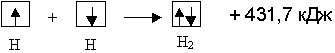
образуется молекула водорода.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается (рис. 8).
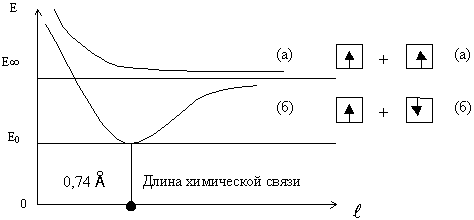
Рис. 8. Изменение энергии системы при сближении атомов водорода
Только при расстоянии между ядрами атомов водорода 0,74 A образуется молекула Н2.
4. Основные силы, действующие в молекуле, имеют электрическое кулоновское происхождение.
Если все эти условия выполняются, то образуется молекула с ковалентной связью.
2.2.2. Характеристика ковалентной связи
1. Насыщаемость – определяет стехиометрию (количественный состав) молекулярных химических соединений.
Это свойство заключается в том, что каждый атом может присоединить только определенное число других атомов. Так, как правило, простые газообразные вещества состоят из 2 атомов: О2, Сl2, N2 и т.д.
2. Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков.
Различают следующие формы молекул:
линейную – НСl, H2, Cl2, BeCl2, ZnCl2 и т.д.;
угловую – Н2О, Н2S;
пирамидальную – NH3, PH3;
треугольную – BCI3, AICI3 (плоскость);
тетраэдрическую – SiCI4, CCI4, CH4.
3. Полярность связи
В двухатомных молекулах простых веществ (Н2, О2, Cl2 и т.д.) электронные пары, образующие ковалентные связи, в равной степени принадлежат обоим атомам и, следовательно, находятся посередине между их центрами, т.е. общее электронное облако симметрично. Связь в этом случае называется неполярной (гомеополярной).
Например: · Н + · Н = Н Н.
Если атомы разнородны (различны величины их электроотрицательности), общее электронное облако несимметрично и смещено в сторону более электроотрицательного атома, ковалентная связь называется полярной (гетерополярной).
Например: Н · + · Cl ® H+ Cl - (диполь)
Мерой полярности молекулы является дипольный момент m :
m = q l (D – дебай),
где q – заряд диполя; l – длина диполя (расстояние между центрами атомов, образующих химическую связь, A).
Для связей различной полярности m изменяется от 0 до 10 D. Дипольный момент – векторная величина (имеет направление), его обозначают стрелкой, направленной от (+) к (-):
![]() .
.
Дипольный момент молекулы представляет собой геометрическую сумму дипольных моментов отдельных связей. Поэтому некоторые асимметричные молекулы неполярны, несмотря на присутствие полярных связей, например, в молекуле оксида углерода (IV) и тетрахлорметана:
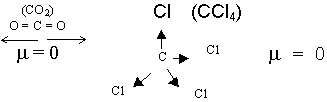
Полярность ковалентной связи имеет непосредственное отношение к реакционной способности соединения. Иллюстрацией может служить взаимодействие металлического натрия с метаном, метанолом и фтороводородом (табл. 14).
Таблица 14
Сопоставление полярности ковалентных связей и реакционной способности веществ в реакции с натрием
Связь |
Соединение |
Разность ЭО |
m , D |
Реакционная способность |
С – Н |
СН4 |
0,4 |
0,30 |
не взаимодействует |
О – Н |
СН3ОН |
1,4 |
1,66 |
активно взаимодействует |
F – H |
HF |
1,9 |
2,1 |
реагирует со взрывом |
Реакционная способность в ряду этих соединений растет благодаря увеличению электроотрицательности атомов С, О и F и полярности связи каждого из них с атомом водорода.
Для оценки реакционной способности молекул различных веществ не менее важное значение, чем полярность, имеет такая характеристика ковалентной связи, как поляризуемость.
Поляризуемость, или динамическая поляризация, – это способность электронной оболочки атома или молекулы деформироваться под воздействием внешнего поля, в качестве которого могут выступать ионы или полярные молекулы.
Поляризуемость – (временная поляризация) может исчезать при снятии действия поля. Поляризуемость связи возрастает с уменьшением электроотрицательности атома. От атома с небольшой ЭО легче оторвать электрон, следовательно, и легче деформировать его электронную оболочку. Поляризуемость увеличивается также с ростом радиуса атома, так как при этом возрастает число электронных уровней в атоме и усиливается экранирование внутренними электронами электростатического притяжения ядра. Внешняя электронная оболочка становится более подверженной воздействию внешнего поля. Таким образом, существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше электроны в статической (нереагирующей) молекуле сдвинуты под действием электроотрицательного атома (статическая поляризация), тем меньше остается возможности для их дальнейшего смещения под внешним воздействием (динамическая поляризация). Подобная взаимосвязь четко прослеживается на примере молекул галогеноводородов (табл. 15).
Хорошо известно, что в ряду галогеноводородов именно иодид водорода в водном растворе является самой сильной кислотой, несмотря на низковыраженную полярность связи. Причина состоит в высокой поляризуемости этой связи (больший радиус атома), вследствие которой протон легко отщепляется под воздействием полярных молекул воды.
Таблица 15
Взаимосвязь между полярностью и неполярностью
Связь |
ЭО галогена |
m , D |
Ковалентный радиус атомов галогенов, нм |
Поляризуемость связи Н–Наl, см3/моль |
Н – F |
4,0 |
1,9 |
0,064 |
0,05 |
H – Cl |
3,0 |
1,03 |
0,099 |
0,93 |
H – Br |
2,8 |
0,74 |
0,114 |
0,80 |
H – I |
2,5 |
0,38 |
0,133 |
0,76 |
Как уже было сказано, степень полярности молекул значительно влияет на их реакционную способность, которая, в свою очередь, зависит от полноты использования электронов на внешнем уровне. Так, в молекуле аммиака атом азота, имея неподеленную пару электронов, легко вступает в реакции с кислотами, предоставляя эту пару электронов катиону водорода Н+, имеющему свободную орбиталь.
После этого атом азота становится неспособным к образованию дополнительных связей:
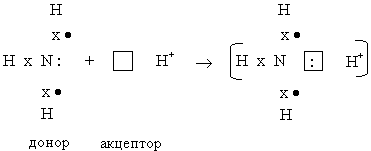
Рассмотренный механизм образования химической связи называется донорно-акцепторным.
В зависимости от строения внешнего энергетического уровня атом элемента может образовывать несколько связей с другими атомами. Это определяется не только наличием неспаренных электронов, неподеленных электронных пар, но и присутствием свободных орбиталей. Образование атомов (или ионов) из молекул может происходить двумя способами. По одному из них электронная пара, осуществляющая связь между двумя атомами, разъединяется. Например:
![]()
Реакционная способность атомов хлора, обладающих избытком энергии по сравнению с молекулами хлора, резко повышается. Такой тип разрыва связи между атомами называется гомолитическим.
Разрыв связи между атомами может происходить вследствие перехода электронной пары, связывающей атомы, к одному из них, в результате чего образуются разноименно заряженные ионы. Такой разрыв связи называется гетеролитическим и наблюдается, например, при растворении хлороводорода в воде:
![]()
Химическая связь характеризуется энергией (кДж/моль), затрачиваемой на разрыв связи между атомами в молекуле, например:
Cl2 ® 2Cl + 240 кДж/моль.
Другой важной характеристикой является кратность связи. Она определяется числом электронных пар, связывающих два атома. Так, в молекулах Н2, НСl кратность связи равна единице, а в молекуле азота N2 – трем. С увеличением кратности связи энергия связи возрастает.
Химическая связь характеризуется длиной, т.е. расстоянием между ядрами связанных атомов. Длина связи зависит от природы взаимодействующих атомов и от кратности связи. Например, расстояние между атомами азота составляет 0,145 (N-N), 0,125 (N=N) и 0,109 (N-N) нм. Следовательно, с увеличением кратности длина связи уменьшается, а прочность возрастает.
2.2.3. Ионная связь
Ионная связь является разновидностью ковалентной сильно полярной связи. Ионные соединения образуют элементы, резко отличающиеся по ЭО, например, металлы I и II группы главной подгруппы и типичные неметаллы – галогены (YII группы главной подгруппы). При этом металлы теряют валентные электроны, превращаясь в катионы, а неметаллы присоединяют эти электроны, превращаясь в анионы. Например:
![]()
Между ионами осуществляется электростатической притяжение:
K+ + Cl- ® KCl
и образуется молекула с ионной связью.
Ионных соединений сравнительно немного. Они обладают следующими свойствами: 1) имеют высокую температуру плавления и кипения; 2) в расплавленном состоянии обладают электропроводностью; 3) в воде легко диссоциируют на ионы. Ионная связь характеризуется следующими показателями:
1. Ненаправленность
Ионы можно представить как заряженные шары. Их силовые поля равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Отсюда вытекает другое свойство.
2. Насыщаемость
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям.
Так, рентгеновскими исследованиями установлено, что в хлориде натрия каждый ион Na+ окружен шестью ионами хлора Cl-, а каждый ион Cl- – шестью ионами Na+. Таким образом, кристалл NaCl в целом представляет собой гигантскую молекулу, состоящую из таких ионов.
Из отдельных молекул ионные соединения состоят только в парообразном состоянии.
2.2.4. Водородная связь
Вода является наиболее широко распространенным веществом в живой природе, и ее весовое содержание в большинстве живых организмов составляет 70 % и более. Кроме того, первые живые организмы возникли, вероятно, в первичном океане, так что вода – это по существу прародительница всего живого.
По сравнению с большинством других жидкостей вода имеет необычно высокую температуру плавления, кипения и теплоту испарения (табл. 16). Теплота испарения – это количество тепловой энергии в джоулях, необходимое для превращения 1,0 г жидкости при температуре ее кипения и атмосферном давлении в газообразное состояние при той же температуре и том же давлении.
Таблица 16
Физические свойства веществ
Вещество |
Температура плавления, ° С |
Температура кипения, ° С |
Теплота испарения, Дж/г |
Вода |
2257,2 |
100 |
540 |
Хлороформ |
246,6 |
61 |
59 |
Ацетон |
522,5 |
56 |
125 |
Метиловый спирт |
1099,3 |
65 |
263 |
Этиловый спирт |
852,7 |
78 |
204 |
Гексан |
422,2 |
69 |
101 |
Эти особенности воды свидетельствуют о сильном притяжении между соседними молекулами, вследствие чего жидкая вода характеризуется бoльшим внутренним сцеплением. Теплота испарения и температура кипения жидкости непосредственно определяются количеством энергии, необходимой для преодоления сил притяжения между соседними молекулами, в результате чего они отрываются друг от друга, и жидкость переходит в газообразное состояние.
Почему же для жидкой воды характерно столь сильное взаимное притяжение молекул? Ответ на этот вопрос вытекает из структуры молекул воды. Каждый из двух атомов водорода (в молекуле воды) объединяет свой электрон с одним из электронов атома кислорода. Взаимное расположение возникающих пар обусловливает угловую форму молекулы воды. Так как у кислорода имеются еще две неподеленные электронные пары, он несет частичный отрицательный заряд. Более отрицательный атом кислорода стремится притянуть электроны атомов водорода, поэтому на ядрах обоих атомов водорода локализуются частичные положительные заряды. Хотя молекула воды в целом электрически нейтральна, ее частичные отрицательный и положительный заряды пространственно разделены, что приводит к возникновению у нее электрического дипольного момента. Благодаря такому разделению зарядов две соседние молекулы воды притягиваются за счет сил электростатического взаимодействия между отрицательным зарядом, локализованном на атоме кислорода одной молекулы воды, и положительным зарядом, локализованном на атоме водорода другой молекулы:
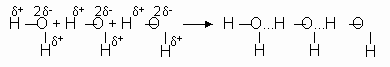
Такой тип электростатического притяжения называется водородной связью.
Молекулы в жидкой воде находятся в непрерывном движении, поэтому образующиеся водородные связи постоянно и быстро разрываются и вновь восстанавливаются.
Вода может служить примером полярной жидкости. В отличие от нее молекулы неполярных жидкостей, таких, как гексан, ацетон не проявляют заметной тенденции к электростатическому притяжению. Поэтому для разрушения межмолекулярных взаимодействий в таких жидкостях требуется гораздо меньше энергии, и значения теплоты испарения у этих веществ намного меньше, чем у воды (табл. 16).
Водородные связи слабее ковалентных, согласно имеющимся данным, энергия водородных связей в жидкой воде (т.е. энергия, необходимая для разрушения одной связи) составляет всего лишь около 20кДж/м, тогда как энергия ковалентных связей Н-О в молекулах воды равна 460 кДж/м. Тем не менее, благодаря своей многочисленности, водородные связи обеспечивают высокую устойчивость жидкой воды. Хотя в любой данный момент большинство молекул в жидкой воде соединено между собой водородными связями, время полужизни каждой из водородных связей составляет менее 1 x 10-9 с. Вследствие этого жидкая вода представляет собой не вязкую, а очень подвижную жидкость.
Водородные связи характерны не только для воды. Они легко образуются между любыми электроотрицательными атомами (обычно кислородом, азотом, фтором) одной молекулы и атомом водорода другой молекулы:
Н–F... Н–F... Н–F.
Таким образом, в зависимости от строения молекулы, как и атомы, способны взаимодействовать друг с другом. Например, при одинаковых условиях (комнатная температура и нормальное давление) молекулы воды сильно притягиваются друг к другу, а молекулы сероводорода – очень слабо. Это обусловливает в первом случае жидкое, а во втором – газообразное состояние вещества. Более сильное, или более слабое притяжение молекул друг к другу обусловлено полярностью этих молекул, точнее полярностью связи Н-S и Н-О. Относительная ЭО водорода равна 2,1, серы – 2,6, кислорода – 3,5. Следовательно, между сильнополярными молекулами воды возникают водородные связи, что обусловливает сильное межмолекулярное притяжение, а между молекулами Н2S водородная связь не образуется, так как связь Н-S недостаточно полярна.
Однако при сильном охлаждении и высоком давлении сероводород может быть переведен и в жидкое, и даже твердое состояние.
Такое взаимодействие между молекулами, в результате которого вещество переходит в жидкое или твердое состояние, называют межмолекулярным взаимодействием.
2.2.5. Металлическая связь
Помимо рассмотренных типов химической связи существует еще особый вид связи, характерный для металлов.
Атомы большинства металлов имеют на внешнем уровне 1-2 электрона, слабо связанных с ядром. Они легко отрываются, обобществляются, образуя так называемый электронный газ (рис 9).
|
Рис.
9. Схема металлической связи в
кристалле: Возникает взаимное притяжение между ионами и обобществленными электронами. Связь между положительными ионами металла, расположенными в узлах пространственной решетки, и подвижными электронами, находящимися в промежутках между узлами, называют металлической. При металлической связи электроны в металлах делокализованы, и в их обобществлении принимают участие все атомы, тогда как при ковалентной связи обобщены электроны только двух соседних атомов. |
2.2.6. Определение характера химической связи в соединении
В молекулах, образованных более чем двумя атомами различных элементов, могут существовать различные типы связей. Характер химической связи можно определить по способу ее образования:
ковалентная полярная или неполярная связь образуется путем перекрывания атомных орбиталей двух взаимодействующих атомов;
ионная связь возникает вследствие притяжения разноименно заряженных ионов;
металлическая связь обусловлена взаимным притяжением ионов металлов и делокализованных электронов.
Пример 1. В молекуле фосфорной кислоты Н3РО4 связь между атомами фосфора и кислорода – полярная ковалентная, а между ионом водорода и кислородом – ионная:
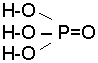
Пример 2. В молекуле NаОН связь между атомом натрия и кислородом – ионная, а между атомами кислорода и водорода – полярная: Nа–О–Н.
2.3. Агрегатные состояния веществ. Типы кристаллов
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. Свойства вещества зависят от его агрегатного состояния (табл. 17).
Таблица 17
Свойства вещества в различных агрегатных состояниях
Состояние |
Свойства |
Газообразное |
1. Способность принимать объем и форму сосуда 2. Сжимаемость 3. Быстрая диффузия (хаотичное движение частиц) 4. ЕК*(частиц) > ЕП (частиц) |
Жидкое |
1. Способность принимать форму той части сосуда, которую занимает вещество 2. Неспособность расширяться до заполнения сосуда 3. Незначительная сжимаемость 4. Медленная диффузия 5. Текучесть 6. ЕК (частиц) » ЕП (частиц) |
Твёрдое |
1. Способность сохранять свойственную форму и объём 2. Незначительная сжимаемость (под давлением) 3. Очень медленная диффузия (колебательное движение частиц) 4. Отсутствие текучести 5. ЕК (частиц) << ЕП (частиц) |
* Примечание. ЕК и ЕП соответственно кинетическая и потенциальная энергия частиц.
Агрегатное состояние вещества определяется силами, действующими между молекулами (межмолекулярными силами), расстоянием между частицами и характером их движения.
Несмотря на электронейтральность молекул, между ними проявляется взаимодействие, обусловленное полярностью и поляризуемостью молекул. Молекулярные силы притяжения быстро уменьшаются с увеличением расстояния между молекулами.
Согласно молекулярно-кинетической теории, газ рассматривается как совокупность удаленных друг от друга частиц (атомов молекул), совершающих бесконечное хаотическое движение. Предполагается, что кинетическая энергия движения частиц велика по сравнению с энергией, а следовательно, и с силами, притяжения между ними.
В газах велика доля свободного объема, т.е. пространства, не занятого самими частицами. Этим и объясняется способность газов легко сжиматься под действием внешнего давления.
В отличие от газов, в жидкостях частицы (молекулы, ионы) находятся довольно близко друг от друга и удерживаются одна возле другой силами взаимного притяжения. Жидкое состояние часто называют конденсированным. Частицы жидкости перемещаются относительно друг друга так же, как это происходит в газе. Важнейшее различие между жидким и газообразным состоянием вещества заключается в том, что если в газе доля свободного объема, доступного для поступательного движения частиц, велика, то в жидкости она мала. Как правило, доля свободного объема в жидкости составляет всего около 3 % полного ее объема, а в газе даже при давлении 10 атм доля свободного объема составляет 99 % полного объема.
Так как доля свободного объема в жидкости мала, а частицы жидкости уже находятся в довольно тесном контакте, для сжатия жидкости требуются значительные усилия. Сжимаемость жидкостей намного меньше, чем у газов. В отличие от газов, жидкости имеют определенный объем, который не зависит от формы и размеров сосуда (табл. 17). Однако частицы жидкости могут свободно перемещаться друг относительно друга, поэтому жидкости не имеют определенной формы, их можно переливать из одного сосуда в другой, и при этом они каждый раз принимают форму того сосуда, в который их наливают.
Под действием сил притяжения частицы газа конденсируются в жидкость, и те же самые силы приводят к образованию твердого вещества в процессе замерзания жидкости. Различие между жидкостями и твердыми веществами определяется, главным образом, степенью их внутренней упорядоченности. В жидкостях частицы, хотя и находятся близко друг к другу, перемещаются более или менее хаотическим образом. Движение каждой частицы в какой-то мере определяется влиянием ее ближайших (соседних) частиц, но дальний порядок отсутствует. В то же время в твердом веществе каждая частица (атом, ион, молекула) занимает определенное положение относительно своих соседей, и такое упорядоченное расположение характерно для всего твердого вещества.
Твердые тела, как и жидкости, обладают небольшой сжимаемостью, поскольку их свободный объем невелик. Уменьшить объем твердого вещества под действием внешнего давления можно только путем еще большего сближения молекул. Межмолекулярные силы, которые сопротивляются сжатию, могут быть очень большими.
Так как частицы твердого вещества (атомы, молекулы или ионы) не обладают достаточной свободой и не могут перемещаться на большие расстояния, твердые вещества характеризуются механической прочностью. Молекулы, находящиеся внутри твердого вещества практически не имеют кинетической энергии поступательного движения, поскольку они должны оставаться вблизи занимаемых ими мест. Однако они могут обладать колебательной энергией, т.е. могут периодически перемещаться вперед-назад относительно положений, занимаемых ими в кристаллической решетке. Запас колебательной энергии твердого вещества пропорционален его абсолютной температуре, подобно запасу колебательной энергии газа. Исходя из представлений молекулярно-кинетической теории, можно сравнить три физических состояния вещества в схематичной форме (рис. 10).
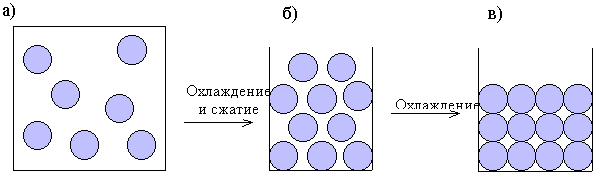
Рис. 10. Сравнение газов, жидкостей и твердых веществ на молекулярном уровне: а - газ; б - жидкость; в - твердое вещество
Из приведенной схемы следует, что:
а – полная неупорядоченность, много свободного пространства, частицы обладают полной свободой перемещения благодаря большому расстоянию между ними и слабым силам межмолекулярного притяжения;
б – неупорядоченность, частицы свободно перемещаются относительно друг друга; частицы находятся в близком контакте;
в – упорядоченное расположение, частицы могут колебаться, но находятся в фиксированных средних положениях; частицы находятся в тесном контакте.
Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами.
Различают аморфное и кристаллическое состояния твердых тел.
При аморфном состоянии частицы расположены беспорядочно. В отличие от кристаллических аморфные тела не имеют постоянной температуры плавления. Примером аморфного состояния является обычное стекло. При нагревании оно постепенно размягчается, переходя в жидкое состояние.
Кристаллическое состояние твердых тел характеризуется правильным расположением частиц (структурных единиц) в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас –кристаллическая решетка. Точки, в которых размещены частицы кристалла, называют узлами решетки. В узлах решетки могут находиться молекулы, атомы или ионы, способные совершать колебательные движения. В зависимости от природы структурных единиц и характера связи между ними различают следующие типы кристаллических решеток:
1. Молекулярная решетка – в узлах находятся как полярные, так и неполярные молекулы, связанные слабыми межмолекулярными силами. Природа сил – электрическая. В зависимости от вида молекул, находящихся в узлах решетки, в кристалле действуют ориентационные силы (полярные молекулы), индукционные (полярные и неполярные), дисперсионные (неполярные молекулы). Такая кристаллическая решетка наблюдается у газов, находящихся в твердом состоянии (водород, кислород, галогены), а также у органических веществ молекулярной структуры (кислоты, спирты). Кристаллы с молекулярной решеткой обладают умеренной мягкостью, температурой плавления от низкой до умеренно высокой, плохой тепло- и электропроводностью. В кристаллах молекулярного типа могут действовать и водородные связи (вода, спирты, органические кислоты в твердом состоянии).
2. Атомные решетки – в узлах расположены отдельные атомы, связанные между собой прочными ковалентными связями. Такие решетки наблюдаются у алмаза, графита, бора, кремния, германия и др. Кристаллы с атомной решеткой отличаются большой твердостью и тугоплавкостью, могут быть изоляторами и полупроводниками.
3. Ионные решетки – в узлах находятся противоположно заряженные ионы, которые прочно связанны кулоновскими силами друг с другом. Типичными представителями кристаллических веществ, обладающих ионными решетками, являются соли, образованные галогеноводородными кислотами и щелочными металлами, например NaCl. Ионные соединения тугоплавки, малолетучи, легко растворяются в полярных растворителях, обладают сравнительно большой твердостью и хрупкостью, и очень слабой ионной проводимостью.
Металлические решетки – в узлах находятся положительно заряженные ионы металлов, между которыми движутся делокализованные валентные электроны. Такая решетка обусловливает определенные свойства металлов (степень твердости различная, температура плавления – от низкой до очень высокой, высокие тепло- и электропроводность, ковкость и пластичность).
Кристаллическая решётка - присущее находящемуся в кристаллическом состоянии веществу правильное пространственное расположение атомов (ионов,молекул), характеризующееся периодической повторяемостью в трёх измерениях. Нельзя смешивать понятия кристаллическая структура и кристаллическая решетка. Первый термин относится к реальной картине атомного строения кристалла, второй - к геометрическому образу, описывающему трехмерную периодичность в размещении атомов (или иных частиц) в кристаллическом пространстве. Различие между ними вытекает хотя бы из того, что существует огромное количество разнообразных кристаллических структур, которым соответствует всего лишь 14 решеток Бравэ. Необходимым следствием этого является то, что одна и та же ячейка Бравэ может описывать различные на первый взгляд кристаллические структуры. Благодаря такой периодичности для описания кристаллической структуры достаточно знать размещение атомов в элементарной ячейке. Её повторением путём параллельных дискретных переносов (трансляций) образуется вся структура кристалла. В соответствии с симметрией кристалла его элементарная ячейка имеет форму косоугольного или прямоугольного параллелепипеда, трехугольной, четырехугольной или шестиугольной призмы, куба. Наличием у кристаллов кристаллической решётки объясняются анизотропия свойств кристаллов, плоская форма их граней, постоянство углов и другие законы кристаллографии. Изучение геометрии и измерение углов кристалла даёт информацию о параметрах углов его элементарной ячейки. Кристаллическая структура не является статической конструкцией. Образующие её атомы или молекулы колеблются около определённых положений равновесия. Характер этих колебаний зависит от симметрии, координации атомов, энергии межатомных связей. С повышением температуры колебания частиц усиливаются, что приводит к разрушению кристаллической решётки и к переходу вещества из кристаллического в жидкое состояние.