
- •Ізомеризація алканів:
- •Електроліз по Кольбе:
- •Циклоалкани
- •Механізм реакції електрофільного приєднання
- •Зсув подвійного зв’язку:
- •Алкадієни
- •Піроліз нафтопродуктів або горючих газів:
- •Взаємодія дигалогенопохідних алканів зі спиртовим розчином лугу.
- •Взаємодія солей ароматичних кислот і натронного вапна:
- •Багатоядерні арени
- •Правила заміщення в бензеновому ядрі
- •Галогенопохідні вуглеводнів
- •Заміщення Гідрогену вуглеводнів галогеном:
- •Приєднання галогенів і галогенводню до ненасичених вуглеводнів:
- •Заміщення гідроксильної групи спирту атомом галогену:
- •Окремі представники галогенпохідних вуглеводнів
Зсув подвійного зв’язку:
![]()
Алкадієни
Алкадієни, або дієнові вуглеводні (дієни, діолефіни) – ненасичені вуглеводні, в молекулах яких є два подвійних зв’язки.
Загальна формула гомологічного ряду алкадієнів: СnH2n-2
Гомологічний ряд ‑ С3Н4, С4Н6, С5Н8, С6Н10, С7Н12.

Номенклатура алкадієнів
Називають відповідний дієну алкан, в назві якого літеру суфікса «-ан» заміняють на суфікс «–дієн».
Цифрами вказують місця розміщення подвійних зв’язків у карбоновому ланцюзі. Нумерацію карбонового ланцюга проводять так, щоб цифри мали найменше значення.
Решта принципів найменування дієнів залишається такою ж, як у всіх попередніх вуглеводнів.
|
|
|
1,3-бутадієн |
2-метил-1,3-бутадієн (ізопрен) |
З-метил-1,4-гексадієн |
Ізомерія дієнів
Для дієнів характерно два види ізомерії – структурна і просторова.
ізомерія будови карбонового ланцюга (прямий і розгалужений):
![]() 2-метил-1,3-бутадієн
(ізопрен)
2-метил-1,3-бутадієн
(ізопрен)
ізомерія розміщення подвійних зв’язків в молекулі:
![]()
1,3-гексадієн 2,4-гексадієн
ізомерія гомологічних рядів (дієни ізомерні алкінам):

стереоізомерія (обумовлена просторовим розміщенням атомів і атомних груп навколо подвійних зв’язків і зумовлює існування цис- і транс-ізомерів дієнів):

Будова алкадієнів
1,3-бутадієн – дієн зі спряженими зв’язками СН2 = СН ‑ СН =СН2 містить чотири атоми Карбону в Sр2-гібридизованому стані, має плоску будову. В ній перпендикулярно до площини розміщені 2р-орбіталі всіх чотирьох атомів Карбону. Орбіталі електронів, що утворюють π- зв’язки між C1 і С2, а також С3 і С4, знаходяться на близькій відстані одна від одної і перекриваються по лінії зв’язку С2 і С3. |
|
Тут виникає додатковий частковий π- зв’язок (формується єдина π-електронна хмара з найбільшою густиною по краях молекули і дещо меншою в середині). Виникає ефект спряження, який сприяє зменшенню загальної енергії системи в цілому і молекули зокрема. |
|
|
|
Гіпотетична структура молекули 1,3-бутадієну |
Реальна структура 1,3-бутадієну |
|
|
Фізичні властивості
Пропадієн і бутадієн – безбарвні гази, наступні представники гомологічного ряду – рідини, вищі дієни – тверді речовини.
Хімічні властивості дієнів
Визначаються наявністю в молекулі двох подвійних зв’язків і їх розміщенням у карбоновому ланцюзі.
І. Реакції приєднання
Дієни з ізольованими подвійними зв’язками вступають в реакції приєднання водню, галогенів, галогенводнів, води як ненасичені вуглеводні:
СН2 = СН –СН2 ‑СН =СН2 + 2Н2 → СН3 – СН2 –СН2 –СН2 – СН3 пентан
СН2 = СН –СН2 ‑СН =СН2 + 2СІ2 → СН2СІ ‑ СНСІ – СН2 –СНСІ ‑ СН2СІ
1,2,3,4-тетрахлорпентан
СН2 = СН –СН2 ‑СН =СН2 + 2НСІ → СН3 – СНСІ –СН2 –СНСІ – СН3
2,4 -дихлорпентан
СН2 = СН –СН2 ‑СН =СН2 + 2Н2О → СН3 – СНОН –СН2 –СНОН – СН3
2,4-пентадіол
Дієни зі спряженими зв’язками мають високу реакційну здатність, утворюються продукти 1,2-приєднання та 1,4-приєднання. Вихід продуктів залежить від характеру речовини, що приєднується, наявності окремих каталізаторів, температури та інших умов перебігу реакції.
гідрування 1,3-бутадієну – утворюється 2-бутен (1,4-приєднання):

гідрування 1,3-бутадієну у присутності каталізатора Nі ‑ бутан:

галогенування 1,3-бутадієну – 1,4-приєднання (1,4 – дибром-2-бутен):
![]()
галогенування 1,3-бутадієну – 1,2-приєднання (3,4 – дибром-1-бутен):
![]()
дієновий синтез (реакція Дільса-Альдера), відбувається 1,4-приєднання алкенів або алкінів до молекул дієнів зі спряженими зв’язками:

ІІ Реакція полімеризації.
Дієни зі спряженими подвійними зв’язками здатні до полімеризації. дану властивість використовують для одержання з дієнів синтетичних каучуків (СК). Полімеризація 1,3-дієнів може відбуватися за типом 1,4-приєднання, або за змішаним типом 1,2- і 1,4-приєднання. Напрям приєднання залежить від умов проведення реакції.
Каучуки. Гума. Гутаперча.
Каучуки (дослівно – «сльози дерева») – еластичний і міцний матеріал органічного походження, який одержують з природної сировини (натуральний каучук – НК) і синтетичними способами (синтетичний каучук – СК).
Натуральний каучук – продукт, що має вигляд пружної аморфної маси, його добувають з молочного соку деяких рослин. НК – стереорегулярний полімер, у молекулах якого до 98 ‑ 100%, ланок ізопрену з’єднані між собою в 1,4-положенні:

НК має молекулярну масу 1,4 – 2,6 млн., стійкий до дії води, добре розчиняється в органічних розчинниках. З часом НК втрачає еластичність, стає твердим і крихким.
Геометричним ізомером НК є гутаперча, яку одержують з рослин роду палаквіум. Молекула гутаперчі складається з гути (50 – 90%), смол, білків, мінеральних та органічних солей. Молекулярна маса шкіроподібного полімеру досягає 20 – 50тис. За структурою молекули гутаперча є поліізопреном (транс-ізомером). Виробляють ізоляційні матеріали для електропроводів та різноманітні вироби.
Перший синтетичний каучук, одержаний за методом С.В.Лебедєва, внаслідок полімеризації дивінілу (1,3-бутадієну) при наявності металічного натрію – полімер нерегулярної будови зі змішаним типом 1,2- і 1,4-приєднання:

У присутності органічних пероксидів (радикальна полімеризація) також утворюється полімер нерегулярної будови зі змішаним типом 1,2- і 1,4-приєднання. Каучуки нерегулярної будови характеризуються невисокою якістю при експлуатації.
Вибіркове 1,4-приєднання відбувається при використанні металоорганічних каталізаторів (бутіллітій С4Н9Li). Таким чином одержаний стереорегулярний 1,4-цис-поліізопрен – синтетичний аналог натурального каучуку:
![]()
Для практичного використання каучуки перетворюють у гуму. Гума – це вулканізований каучук з наповнювачем (сажа). Сутність процесу вулканізації: нагрівання суміші каучуку та сірки призводить до утворення трьохмірної сітчастої структури з лінійних макромолекул каучуку, надаючи йому підвищеної міцності. Атоми Сульфуру приєднуються за подвійними зв’язками макромолекул і утворюють між ними дисульфідні містки. Сітчастий полімер є більш міцний і еластичний. |
|
Залежно від кількості взятої сірки можна одержати сітки з різною частотою зшивання. Наприклад, ебоніт (20 – 40% S) – твердий матеріал, не має еластичності. Використовують для виготовлення деталей електричних приладів, акумуляторних баків, посуду для зберігання агресивних рідин, електроізоляційних матеріалів.
Методи одержання алкадієнів
Каталітичне дегідрування алканів (2 стадії) через стадію утворення алкенів. У промисловості одержують дивініл з бутану:
![]()
Каталітичне дегідрування ізопентану (2-метилбутан) використовують для одержання ізопрену:

Синтез дивінілу (синтез Лебедєва):

Дегідратація гліколей (алкандіолів):

Дія спиртового розчину лугу на дигалогенопохідні алканів:

Полієни
Полієни (ненасичені вуглеводні з багатьма подвійними зв’язками) – це вуглеводні, в складі молекул яких є не менше трьох подвійних зв’язків.
Наприклад, лікопін (молекула містить 13 подвійних зв’язків) С40Н56 – речовина жовто-червоного кольору, надає забарвлення стиглим помідорам і плодам шипшини. Структурним мономером лікопіну є ізопрен. Полієнами є пігмент каротин (провітамін А), вітаміни А, Е. Головною структурною ланкою їх є ізопрен.
Алкіни
Алкіни (вуглеводні ацетиленового ряду) – ненасичені вуглеводні, в молекулах яких є один потрійний зв’язок.
Загальна формула гомологічного ряду алкінів: СnH2n-2
Гомологічний ряд ‑ С3Н4, С4Н6, С5Н8, С6Н10, С7Н12.
Номенклатура
За основу номенклатури береться назва алкану, що має найбільш довгий карбоновий ланцюг, в якому суфікс -ан замінюється на суфікс -ін, а цифрою, що стоїть перед назвою алкіну вказується місце розміщення потрійного зв’язку в карбоновому ланцюзі. Нумерацію карбонового ланцюга починають з того боку, до якого ближче розміщений потрійний зв’язок. У назві алкіну перед коренем зазначають бічні замісники (радикали), перед якими ставлять цифру, що вказує їх положення:
 5-метил-2-гексин
5-метил-2-гексин
В номенклатурі різних класів органічних сполук використовують історичні назви: ацетилен (етин), алілен (пропін), кротонілен (бутин), валерілен (1-пентин). Також використовують назви одновалентних радикалів:
![]()
етиніл пропаргіл
Ізомерія
ізомерія карбонового ланцюга (починаючи С5Н8):
![]()
1-пентин 3-метил-1-бутин
ізомерія за місцем розміщення потрійного зв’язку:
![]()
ізомерія гомологічних рядів (алкіни ізомерні алкадієнам):

Будова
Типовим представником алкінів – ацетилен (етин) С2Н2: СН ≡ СН.
Потрійний зв'язок у молекулі ацетилену являє собою поєднання одного σ – і двох π- зв’язків (знаходяться в двох взаємно перпендикулярних площинах). Атоми карбону знаходяться в стані sp-гібридизації, два р-електрони негібридизовані. sp – гібридизовані орбіталі максимально віддалені одна від одної і розміщені по прямій (кут – 1800).
|
|
Фізичні властивості
Перші два члени гомологічного ряду алкінів – гази, С4Н6 – С16Н30 – рідини, від С17Н32 і вище – тверді речовини. Всі алкіни безбарвні, майже не розчинні у воді, розчиняються в органічних розчинниках. Із збільшенням молекулярної маси зростають температури плавлення та температури кипіння алкінів нормальної будови. Температури плавлення і кипіння вищі, ніж у відповідних алкенів.
Хімічні властивості
У молекулах ацетилену і його гомологів π-електрони переважно сконцентровані в просторі між ядрами атомів Карбону, що утворюють потрійний зв'язок. Зовнішні області ядер мають знижену електронну густину, що обумовлює меншу активність потрійного зв’язку в порівнянні з подвійним зв’язком етилену в реакціях приєднання і більшу схильність до реакцій заміщення.
В алкінах спостерігається зміщення σ - зв’язку С- ← Н+ до карбонового атома. При цьому відбувається поляризація зв’язку, зменшується відстань між атомами Карбону, збільшується дипольний момент. Зростає здатність до відриву атома Гідрогену. Як результат – кислотність алкінів вища, ніж алканів і алкенів – вступають в реакції з активними металами з утворенням солей (алкіни з кінцевим потрійним зв’язком).
І.Реакції приєднання
реакції приєднання водню (гідрування), проходять легко в присутності каталізаторів через стадію утворення алкенів:
![]()
При використанні менш активного каталізатора Рd/CаCO3 / Pb(CH3COO)2 гідрування припиняється на стадії утворення алкену.
приєднання галогенів відбувається повільніше, ніж у алкенів (утворюються дигалогенопохідні алкенів або тетрапохідні алканів):
![]()
Алкіни знебарвлюють бромну воду (якісна реакція).
реакція гідрогалогенування (приєднання галогенводнів).
Гідрохлорування ацетилену використовують у промисловому способі одержання вінілхлориду:
![]()
Продукти приєднання до несиметричних алкінів визначаються правилом Марковнікова:
![]()
приєднання води ‑ реакція гідратації (М.Г.Кучеров, 1881).
При дії на ацетилен водою у присутності каталізаторів (НgSO4 або Hg(NO2)2) розривається потрійний зв'язок, приєднується молекула води і утворюється нестійкий ненасичений вініловий спирт, який у подальшому перетворюється на оцтовий альдегід:
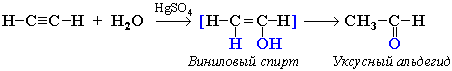
вініловий спирт оцтовий альдегід
Для гомологів ацетилену продуктом приєднання води є кетон:

ІІ Полімеризація
димеризація ацетилену в присутності водно-аміачного розчину СuСІ:
![]()
тримеризація ацетилену над активованим вугіллям (реакція Зелінського) – утворення бензолу:

окислювальна поліконденсація ацетилену у присутності СuCІ – утворюється карбін (ВМС) – одна з алотропних модифікація Карбону:
![]()
ІІІ. Утворення солей (кислотні властивості) –реакції заміщення
взаємодія з активними металами, утворюються ацетиленіди, які використовують для одержання гомологів ацетилену:
![]() ацетиленід натрію
ацетиленід натрію
взаємодія алкінів з аміачними розчинами оксиду аргентуму або хлориду купруму(І), утворюються осади нерозчинних ацетиленідів:

Утворення сірувато-білого осаду ацетиленіду аргентуму або червоно-коричневого – ацетиленіду купруму (І) є якісною реакцією на кінцевий потрійний зв'язок:
НС ≡ СН + СuCI → СuC ≡ ССu ↓ + 2HCI
У сухому стані ацетиленіди важких металів нестійкі і легко вибухають, розкладаються під дією кислот:
![]()
Якщо потрійний зв’язок знаходиться не на кінці карбонового ланцюга, то кислотні властивості – відсутні:
![]() реакція
не відбувається
реакція
не відбувається
ІV. Реакції окислення
Алкіни легко окислюються різними окислювачами (перманганат калію в кислому або лужному середовищах, дихроматом калію в кислому середовищі).
жорстке окислення (нагрівання, концентровані розчини, кисле середовище) супроводжується розщепленням молекули алкіну за потрійним зв’язком (руйнується σ- зв'язок між С – С атомами), утворюються карбонові кислоти:
![]()
м’яке окислення – знебарвлення водного розчину перманганату калію (якісна реакція на кратний зв'язок). За цих умов відбувається лише розрив π- зв’язку. При взаємодії ацетилену з розбавленим розчином КМnО4 (кімнатна температура) утворюється щавлева кислота:

повне окислення (згорання алкінів) до СО2 і Н2О:
![]()
Температура ацетиленово-кисневого полум’я досягає 2800 – 30000С. На цьому базується використання ацетилену для зварювання і нарізання металів. Ацетилен у зрідженому стані вибухонебезпечний від удару. Тому зберігають його у стальних балонах у вигляді розчинів в ацетоні, яким просочують азбест або кізельгур.
Методи одержання алкінів
Одержання ацетилену з карбіду кальцію (Ф.Велер, 1862).
Спочатку одержують карбід кальцію: в електропечах при t = 25000С нагрівають суміш вугілля (коксу) і негашеного вапна:
СаО + 3С → СаС2 + СО
У спеціальних приладах внаслідок взаємодії карбіду кальцію і води утворюється ацетилен:
СаС2 + 2Н2О → СН ≡ СН + Са(ОН)2







