
- •Учебно-методический комплекс по дисциплине «органическая химия»
- •Предисловие
- •Содержание
- •Раздел I Основы строения и реакционная способность органических соединений…………………………………………………………………………...7
- •Раздел II Насыщенные, ненасыщенные и ароматические ув……………15
- •Раздел III Производные ув…………………………………………………30
- •Содержание дисциплины «органическая химия»
- •Краткий курс лекций
- •Раздел I Основы строения и реакционная способность органических соединений
- •1.1 Теория строения органических соединений
- •1.2 Классификация органических соединений
- •1.3 Изомерия органических соединений
- •1.4 Строение атома углерода. Типы гибридизаций
- •1.5 Классификация органических реакций
- •Раздел II Насыщенные, ненасыщенные и ароматические ув
- •2.1 Алканы (предельные ув)
- •2.2 Циклоалканы
- •2.3 Алкены (непредельные ув, олефины)
- •3. Гидрирование алкинов:
- •2.4 Алкины (ненасыщенные ув)
- •2.5 Алкадиены
- •2.6 Арены (ароматические ув)
- •Раздел III Производные ув
- •3.1 Кислородсодержащие производные ув
- •3.1.1 Спирты
- •2) Взаимодействие с аммиаком с образованием аминов (300ºС).
- •3.1.2 Альдегиды (оксосоединения)
- •2. Циклическая полимеризация (тримеризация, тетрамеризация).
- •3.1.3 Карбоновые кислоты
- •2. Взаимодействие с аммиаком с образованием амидов кислот.
- •1. Общие способы получения:
- •3.1.4 Сложные эфиры. Жиры
- •Получение жиров.
- •3.2 Галогенпроизводные ув
- •3.3 Азотсодержащие производные ув
- •3.3.1 Амины. Анилин
- •3.3.2 Аминокислоты
- •Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1. Качественный элементный анализ органических соединений
- •Экспериментальная часть.
- •Экспериментальная часть
- •Экспериментальная часть.
- •Экспериментальная часть.
- •Методические указания для самостоятельной работы студентов Задания в тестовой форме для самоконтроля
- •1 Предельные, непредельные и ароматические ув
- •2 Кислородсодержащие производные ув: спирты, карбонильные соединения, карбоновые кислоты.
- •30. Определите промежуточное вещество х в синтезе ацетона по схеме: пропен → х → ацетон
- •3 Азотсодержащие производные ув: амины, нитросоединения, аминокислоты
- •4 Высокомолекулярные соединения
- •Перечень контрольных вопросов
- •Список рекомендуемой литературы
Раздел II Насыщенные, ненасыщенные и ароматические ув
2.1 Алканы (предельные ув)
Алканы – это ациклические углеводороды, содержащие только простые связи С-С. Их характеристики: 1) общая формула СnH2n+2; 2) все атомы углерода находятся в состоянии sp3-гибридизации, угол между связями C–C 109°28', длина связи равна 0,154 нм; 3) имеют прочные ковалентные σ-связи; 4) характерные реакции – замещения, полного и частичного окисления.
Гомологический ряд алканов представлен в таблице 4.
Изомерия: 1) углеродного скелета; 2) оптическая.
Таблица 4 – Гомологический ряд алканов
Молекулярная формула алкана СnН2n+2 |
Название алкана |
Молекулярная формула радикала (алкила) – CnH2n+1 |
Название алкила (алкильного радикала) |
СН4 |
Метан |
-CH3 |
Метил |
C2H6 |
Этан |
-С2Н5 |
Этил |
С3Н8 |
Пропан |
-C3H7 |
Пропил |
С4Н10 |
Бутан |
-С4Н9 |
Бутил |
C5H10 |
Пентан |
-С5Н11 |
Пентил (амил) |
С6Н14 |
Гексан |
-С6Н13 |
Гексил |
C7H16 |
Гептан |
-С7Н15 |
Гептил |
С8H18 |
Октан |
-C8H17 |
Октил |
С9Н2о |
Нонан |
-С9Н19 |
Нонил |
С10Н22 |
Декан |
-С10Н21 |
Децил |
Физические свойства. При обычных условиях СН4 ... С4Н10 – газы, С5Н12 ... С15Н32 – жидкости, с С16Н34 – твердые вещества. С ростом относительной молекулярной массы, возрастают температуры кипения и температуры плавления. Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
Химические свойства. Алканы содержат σ-связи С-Н и С-С, для которых характерны высокая прочность, малая полярность, низкая поляризуемость. Алканы обладают низкой реакционной способностью.
I. Реакции замещения (SR) осуществляются по свободно-радикальному (цепному) механизму.
1. Галогенирование (образуются галогенпроизводные УВ). Реакция протекает при УФ-облучении или высокой температуре:
![]()
метан хлор- дихлор- трихлор- тетра-
метан метан метан хлорметан
2. Нитрование (образуются нитросоединения):
– в жидкой фазе (М.И. Коновалов). Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
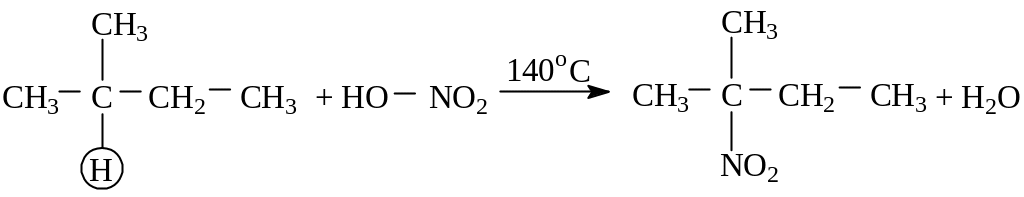
2-метилбутан 2-метил–2-нитробутан
– в газовой фазе. При температуре 400–5000С образуется смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С–С:
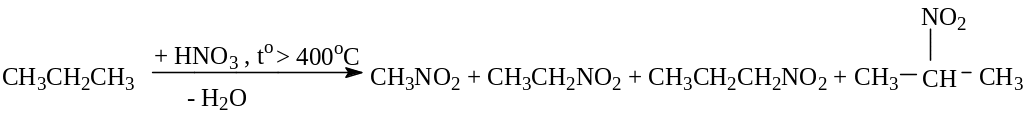 3.
Сульфирование.
Сульфирование
алканов происходит при действии очень
концентрированной H2SО4
при небольшом нагревании.
3.
Сульфирование.
Сульфирование
алканов происходит при действии очень
концентрированной H2SО4
при небольшом нагревании.
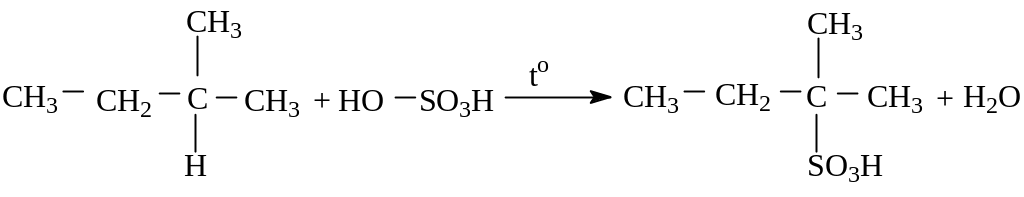
(2-метил–2-сульфобутан)
II. Реакции окисления.
1. Полное окисление (избыток O2):
![]()
2. Неполное окисление (недостаток О2):
![]()
![]()
3. Неполное каталитическое окисление в присутствии О2. В зависимости от природы катализатора и условий проведения реакции могут образоваться альдегиды RCOH, кетоны R–СО– R, спирты ROH, карбоновые кислоты RCOOH.
III. Термические превращения алканов.
1. Термический крекинг (пиролиз) осуществляется при температуре 450—7000С:
![]()
2. Дегидрирование осуществляется в присутствии катализаторов при повышенных температурах.
![]()
![]()
![]()
3. Дегидроциклизация – ароматизация, дегидрирование алканов с образованием ароматических соединений:
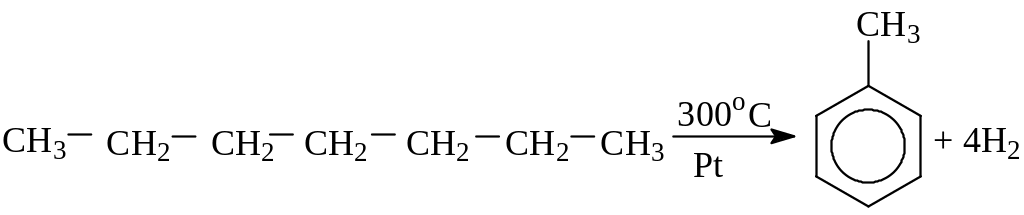
4. Изомеризация – превращение химического соединения в его изомер:
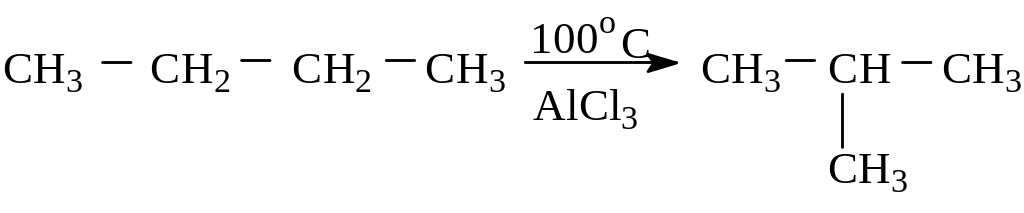
Получение алканов. Основные природные источники алканов – нефть и природный газ. Различные фракции содержат алканы от С5Н12 до С30Н62. Природный газ состоит из метана (95 %) с примесью этана и пропана.
Получение метана.
1. В промышленности:
- из природного газа;
- синтез из оксида углерода (II) и водорода (оксосинтез):
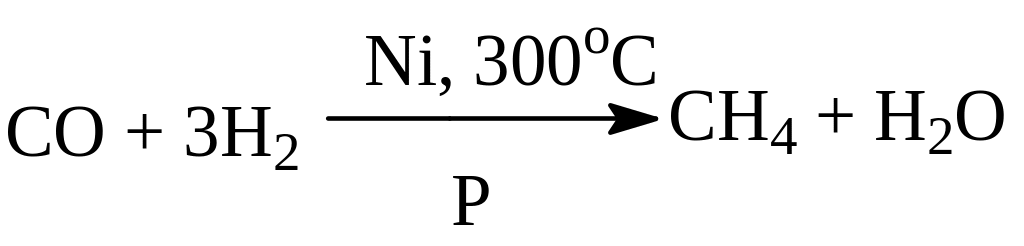
nCO + (2n+1) H2→ CnH2n+2 + nH2O
2. В лаборатории:
- гидролиз карбида алюминия:
А14С3 + 12Н2О → 3СН4↑ + 4А1(ОН)3;
- сплавление солей уксусной кислоты со щелочами
![]()
Получение гомологов метана.
1. В промышленности:
- из природного сырья (нефть, газ, горный воск);
- синтез из оксида углерода (II) и водорода
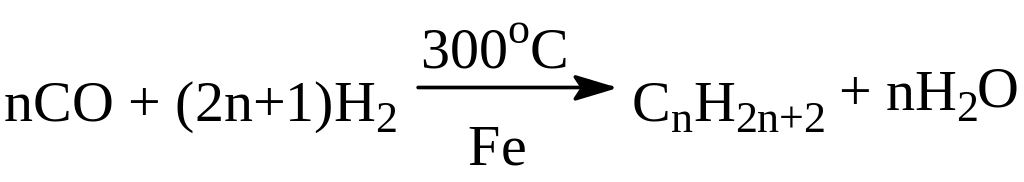
2. В лаборатории:
- каталитическое гидрирование (+Н2) непредельных УВ
![]()
![]()
- взаимодействие галогеналканов с натрием (реакция А. Вюрца).
![]()
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
3R-Br + 3R'-Br + 6Na→R-R + R-R' + R'-R'+ 6NaBr
