
- •Учебно-методический комплекс по дисциплине «органическая химия»
- •Предисловие
- •Содержание
- •Раздел I Основы строения и реакционная способность органических соединений…………………………………………………………………………...7
- •Раздел II Насыщенные, ненасыщенные и ароматические ув……………15
- •Раздел III Производные ув…………………………………………………30
- •Содержание дисциплины «органическая химия»
- •Краткий курс лекций
- •Раздел I Основы строения и реакционная способность органических соединений
- •1.1 Теория строения органических соединений
- •1.2 Классификация органических соединений
- •1.3 Изомерия органических соединений
- •1.4 Строение атома углерода. Типы гибридизаций
- •1.5 Классификация органических реакций
- •Раздел II Насыщенные, ненасыщенные и ароматические ув
- •2.1 Алканы (предельные ув)
- •2.2 Циклоалканы
- •2.3 Алкены (непредельные ув, олефины)
- •3. Гидрирование алкинов:
- •2.4 Алкины (ненасыщенные ув)
- •2.5 Алкадиены
- •2.6 Арены (ароматические ув)
- •Раздел III Производные ув
- •3.1 Кислородсодержащие производные ув
- •3.1.1 Спирты
- •2) Взаимодействие с аммиаком с образованием аминов (300ºС).
- •3.1.2 Альдегиды (оксосоединения)
- •2. Циклическая полимеризация (тримеризация, тетрамеризация).
- •3.1.3 Карбоновые кислоты
- •2. Взаимодействие с аммиаком с образованием амидов кислот.
- •1. Общие способы получения:
- •3.1.4 Сложные эфиры. Жиры
- •Получение жиров.
- •3.2 Галогенпроизводные ув
- •3.3 Азотсодержащие производные ув
- •3.3.1 Амины. Анилин
- •3.3.2 Аминокислоты
- •Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1. Качественный элементный анализ органических соединений
- •Экспериментальная часть.
- •Экспериментальная часть
- •Экспериментальная часть.
- •Экспериментальная часть.
- •Методические указания для самостоятельной работы студентов Задания в тестовой форме для самоконтроля
- •1 Предельные, непредельные и ароматические ув
- •2 Кислородсодержащие производные ув: спирты, карбонильные соединения, карбоновые кислоты.
- •30. Определите промежуточное вещество х в синтезе ацетона по схеме: пропен → х → ацетон
- •3 Азотсодержащие производные ув: амины, нитросоединения, аминокислоты
- •4 Высокомолекулярные соединения
- •Перечень контрольных вопросов
- •Список рекомендуемой литературы
3.1.3 Карбоновые кислоты
Карбоновые кислоты – это производные УВ, содержащие в молекуле одну или несколько карбоксильных групп –COOH. Карбоксильная группа (карбоксил) – сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:

Количество карбоксильных групп определяет основность кислоты.
Характеристики карбоновых кислот: 1) общая формула СnН2nO2; 2) карбоксильный атом углерода находятся в sp2-гибридизации; 3) связь С=О сильно поляризована, свойства гидроксильной и карбонильной групп в карбоновых кислотах отличаются от свойств соответствующих групп в спиртах и альдегидах; 4) диссоциируют с образованием Н+; 5) не характерны реакции присоединения по связи С=О.
Гомологический ряд предельных карбоновых кислот: НСООН – метановая (муравьиная) кислота, СН3СООН – этановая (уксусная) кислота, СН3(СН2)2СООН – бутановая (масляная) кислота и т.д.
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны сложным эфирам); 3) оптическая.
Физические свойства. При обычных условиях С1...С9 – жидкости, с С10 ...– твердые вещества. В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей:

Водородная связь в кислотах сильнее, чем в спиртах. В водных растворах кислоты образуют линейные димеры.
Химические свойства.
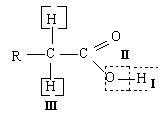
I. Кислотные свойства.
1. Диссоциация. В водных растворах монокарбоновые кислоты диссоциируют с образованием карбоксилат-ионов. Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:

Карбоновые кислоты – слабые кислоты. В гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2. Взаимодействие с активными металлами, основными оксидами, щелочами (р. нейтрализации), аммиаком, солями более слабых кислот.
2НСООН + Са → (HCOO)2Са + Н2↑;
формиат кальция
СН3СН2СООН + NaОН → СН3СН2СООNa + Н2О;
пропионат натрия
СН3СООН + NH3 → CH3COONH4
ацетат аммония
СН3СН2СН2СООН + КHCО3 → CH3CH2CH2COOК + CО2↑ + H2О
бутират калия
II. Реакции замещения (SN) ОН-группы.
1. Взаимодействие со спиртами (см. свойства спиртов).
2. Взаимодействие с аммиаком с образованием амидов кислот.
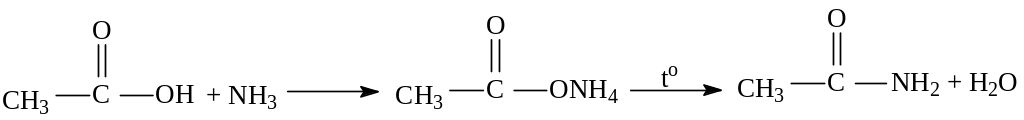
ацетамид
3. Взаимодействие с галогенидами фосфора (РС15, РСl5) или тионилхлоридом SOCl2 с образованием галогенангидридов.
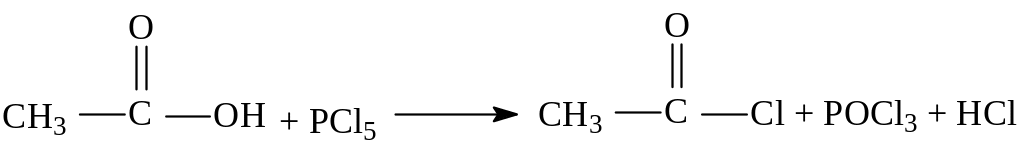
ацетилхлорид

формилхлорид
4. Межмолекулярная дегидратация карбоновых кислот:
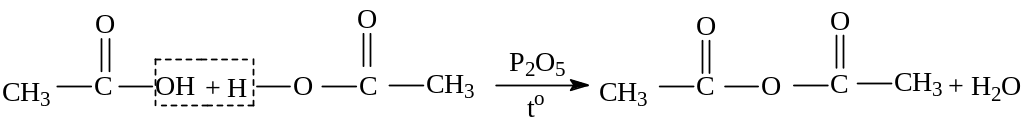
уксусный ангидрид (ангидрид уксусной кислоты)
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты.
III. Реакции замещения у α-углеродного атома. Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галогенкарбоновых кислот:
![]()
Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных предельных монокарбоновых кислот.
Муравьиная кислота проявляет общие свойства кислот, так как имеет функциональную карбоксильную группу. От остальных карбоновых кислот муравьиная кислота отличается тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиную кислоту можно рассматривать и как кислоту, и как альдегид:
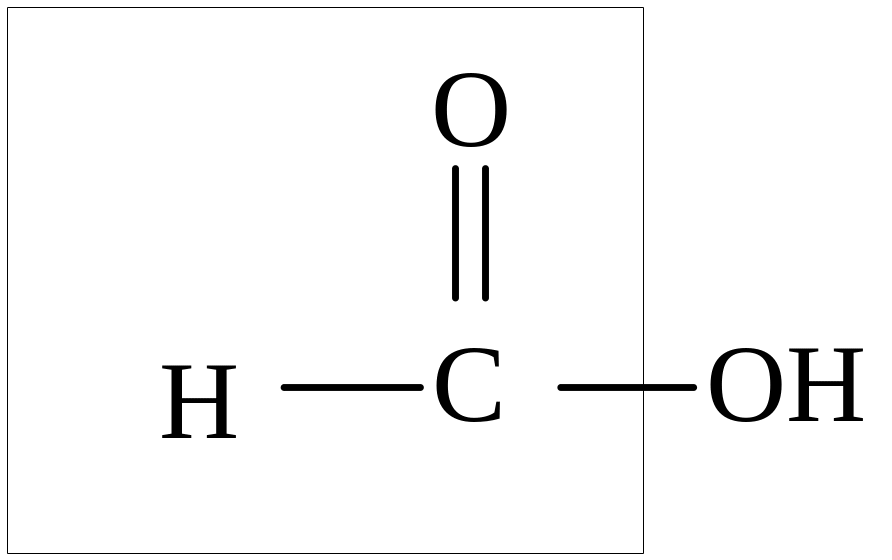
Муравьиная кислота вступает и в реакции, характерные как для альдегидов. Она легко окисляется до угольной кислоты:
HCOOH + [O] → HOCOOH →CO2↑ + H2O
В качестве окислителей можно использовать аммиачный раствор оксида серебра (I) Ag2O и гидроксид меди (II) Cu(OH)2. Таким образом, для муравьиной кислоты характерны качественные реакции на альдегиды (реакция «серебряного зеркала» и реакция с гидроксидом меди (II)
Специфическое свойство муравьиной кислоты – способность разлагаться на оксид углерода (II) и воду под действием H2SO4(конц):
![]()
Получение карбоновых кислот.
