
- •Часть II
- •1. Тема занятия № 18
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 20
- •3. Задачи самостоятельной работы:
- •Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 21
- •3. Задачи самостоятельной работы:
- •4.Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 23
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 25
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 27
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 28
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 29
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 31
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 32
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
1. Тема занятия № 23
СТРУКТУРА И ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
2. Цели самостоятельной работы: расширить знания о структуре, переваривании и обмене нуклеиновых кислот.
3. Задачи самостоятельной работы:
- знать механизмы синтеза и распада нуклеиновых кислот в тканях,
- научиться оценивать клинико-диагностическое значение изменения уровня мочевой кислоты в сыворотке крови и моче.
- знать основные этапы биосинтеза белка, механизмы ингибирующего действия на них некоторых антибиотиков, уяснить механизмы онкостатического действия ингибиторов синтеза ДНК и РНК.
- сформировать навык работы с новой информацией, её анализа, логичного изложения
- сформировать навык использования полученных знаний в учебной и профессиональной деятельности
4. Перечень вопросов для самостоятельной работы
Разделы и темы для самостоятельного изучения |
Виды и содержание самостоятельной работы |
Структура и функции РНК Структура и функции ДНК Репликация и репарация ДНК Транскрипция, процессинг РНК Трансляция, посттрансляционная модификация белков Антибиотики- ингибиторы матричных синтезов |
Проработка учебного материала для самостоятельной работы и подготовка рефератов Работа с тестами Решение ситуационных задач Подготовка презентаций
|
Нуклеиновые кислоты
Нуклеиновые кислоты – высокомолекулярные полимерные соединения, мономером которых являются нуклеотиды. Мононуклеотиды, в свою очередь, включают в свой состав азотистое основание, углевод, фосфорную кислоту
Н
Н
Н3С


аденозилмонофосфат тимидилмонофосфат
В зависимости от количества остатков фосфорной кислоты в составе нуклеотида различают:
нуклеозидмонофосфаты: циклоАМФ, ФАФС, S-аденозилметионин;
нуклеозиддифосфаты - активаторы углеводов, липидов (УДФ-глюкоза, ЦДФ-холин);
нуклеозидтрифосфаты – макроэрги, исходные вещества для синтеза нуклеиновых кислот.
Нуклеотиды соединяются в полинуклеотидную цепь фосфодиэфирными связями, образованными за счёт фосфорной кислоты и рибозы соседних нуклеотидов (к одной рибозе фосфат присоединяется в третьем положении, а к другой - в пятом положении).

Пример соединения нуклеотидов в полинуклеотидную цепь
Рибонуклеиновые кислоты
РНК состоят из одной полинуклеотидной цепи (ПНЦ). Азотистые основания в РНК представлены аденином, гуанином, урацилом, цитозином, углевод - рибозой. В клетках присутствуют несколько видов РНК.
т

рРНК (рибосоамальная РНК), на долю которой приходится до 80% всей РНК клетки. Она локализована в рибосомах и обеспечивает биосинтез белка. В рибосомах человека молекулярной массой 80S большая субъединица (60S) содержит РНК с массой 5S, 5,8S, 25S, а малая субъединица (40S) содержит РНК с массой 18S. Вторичная структура рРНК представляет компактную укладку, формирующую каркас большой и малой субъединицы.
иРНК (информационная РНК). На её долю приходится около 3% РНК клетки, она имеет большую молекулярную массу (106 дальтон). В первичной структуре иРНК представлены кодоны, среди которых различают инициирующие (начальный нуклеотид А), терминирующие (начальный нуклеотид У) и определяющие порядок аминокислот в синтезируемом белке. Кроме кодонов имеется «шапочка - КЭП» для связывания с малой субъединицей рибосомы в начале синтеза белка стабилизирующий «полиадениловый хвост».
определяющий
порядок
а/к
ААА

Дезоксирибонуклеиновая кислота
ДНК включает азотистые основания А, Г, Т, Ц, (углевод - дезоксирибоза). Биологическая роль ДНК заключается в хранении и реализации генетической информации. В отличие от РНК в ДНК две полинуклеотидные цепи, которые соединяются по принципу комплементарности. Принципы комплементарности впервые были сформулированы в 1939 году как «правила Чаргафа»:
количество остатков аденина = количеству остатков тимина (А=Т). Количество Г=Ц;
сумма пуриновых оснований (А+Г) равна сумме пиримидиновых (Т+Ц);
количество оснований с аминогруппой равно количеству оснований с кетогруппой в комплементарных позициях. Г+Т = А+Ц;
для всех видов ДНК существует коэффициент видовой специфичности – отношение Г+Ц/А+Г<1.
На основании этих правил Уотсон и Крик создали модель структуры ДНК, согласно которой в молекуле ДНК две цепи располагаются антипараллельно и соединяются водородными связями между комплементарными азотистыми основаниями А=Т (2 Н-связи), Г=Ц (3 Н-связи).
Вторичная структура ДНК представляет собой правозакрученную двойную спираль, в одном витке которой содержится 10 пар нуклеотидов (шаг спирали 3,4 нм). В фагах присутствует также Z- форма (зигзагообразная) и кольцевая форма ДНК.
Для молекулы ДНК характерна более компактная укладка в виде суперспирали. ДНК формирует надмолекулярную структуру, объединяясь с ядерными белками, формируя полинуклеосомы.
Свойства ДНК. ДНК имеет высокую молекулярную массу (109 дальтон), образует вязкие растворы с двойным лучепреломлением, поглощающие УФЛ в интервале 260-280 нм. Под действием концентрированных растворов кислот, мочевины, физических факторов возможна денатурация ДНК. При денатурации происходит разрыв водородных связей и расхождение цепей ДНК. Денатурация может носить обратимый характер и переходить в ренативацию – восстановление водородных связей и структуры ДНК после удаления денатурирующего фактора. При ренативации возможно явление гибридизации – объединение молекул ДНК из разных организмов, если они комплементарны на продолжительных участках молекулы. Возможна также гибридизация нитей ДНК и РНК.
Биосинтез ДНК
Возможны 2 пути биосинтеза ДНК в организме: репликация, репарация
Репликация - самовоспроизведение молекулы ДНК с целью передачи генетической информации. В репликации ДНК участвует сложный репликационный комплекс, который включает в себя:
нуклеотиды в виде трифосфатов (АТФ, ГТФ, ТТФ, ЦТФ). Они являются одновременно и структурным материалом, и источником энергии;
ДНК-матрица – программа, по которой будет синтезироваться ДНК;
праймер (затравка) - короткая молекула РНК, к которой присоединяется первый нуклеотид ДНК;
ферменты:
- ДНК-полимеразы соединяют нуклеотиды в полинуклеотидную цепь,
- ДНК-рестриктазы разрывают полинуклеатидную цепь ДНК.
- ДНК-лигазы соединяют фрагменты ДНК,
- хеликазы раскручиват молекулу ДНК,
- топоизомеразы осуществляют кратковременные разрывы ДНК в процессе синтеза и контролируют конформацию вновь синтезированной ДНК,
- праймазы – осуществляют синтез затравки;
белковые факторы;
ионы металлов.
Репликация ДНК происходит в S-фазу клеточного цикла. Важную роль в чередовании циклов выполняют белки - циклины.
Сущность репликации сводится к соединению нуклеотидов в комплементарную антипараллельную дочернюю цепь ДНК. В репликации выделяют 3 стадии: инициация (начало синтеза), элонгация (удлинение цепи), терминация (окончание синтеза).
Матрицей для синтеза ДНК являются обе полинуклеотидные цепи материнской ДНК. Репликация начинается в нескольких участках материнской ДНК (точки репликации, точки Ориджины). В них происходит частичный разрыв водородных связей с формированием репликационных утолщений (узелков). В последующем, при участии ферментов ДНК-рестриктаз происходит разрезание молекулы ДНК. Под действием ферментов хеликаз возникает расплетание (раскручивание) двух цепей, и при участии топоизомераз формируется репликационная вилка, в которой одна цепь имеет направление 5→3, а вторая 3→5. Затем на каждой из ПНЦ синтезируются дочерние нити ДНК по принципу комплементарности. Поскольку ДНК- полимераза замыкает связь только в направлении 5’→3’, то на одной цепи ДНК происходит синтез непрерывной (лидирующей) нити ДНК в направлении 5→3. При синтезе лидирующей цепи праймазы синтезируют праймер, затем ДНК- полимераза присоединяет к праймеру первый ДНК-овый нуклеотид и по принципу комплементрности происходит удлинение молекулы ДНК. На второй материнской нити ДНК синхронно синтезируется отстающая нить ДНК, которая синтезируется в виде небольших фрагментов в направлении 5→3. В последующем эти фрагменты (фрагменты Оказаки) соединяются между собой ДНК-лигазами. Праймеры при этом расщепляются.
Таким образом, биосинтез ДНК проходит по полуконсервативному типу, при котором в новой ДНК одна цепь материнская, а другая - дочерняя.

Репарация ДНК происходит при появлении в её молекуле повреждений, искажений. При репарации вначале распознаётся место повреждения, затем ферменты рестриктазы вырезают дефектный участок, ДНК-полимеразы по принципу комплементарности синтезируют отсутствующий участок, а ДНК-лигазы прикрепляют его к сохранившимся участкам неповреждённой ДНК.
Биосинтез РНК (транскрипция)
Транскрипция – синтез молекулы РНК по матрице ДНК. Биологическая роль: перенос генетической информации с ДНК на РНК. Для транскрипции необходимы:
матрица (программа) – кодирующая нить ДНК,
субстраты – АТФ, ГТФ, УТФ, ЦТФ,
ферменты – РНК-полимеразы,
белковые факторы,
ионы магния, марганца.
Выделяют 3 стадии транскрипции: инициация, элонгация, терминация
На молекуле ДНК имеется особый участок промотор, с которым связывается РНК-полимераза. Промотор иногда называют ТАТА участком (преобладает тимин, аденин, между которыми 2 Н-связи). Рядом с промотором расположены сигнальные участки, определяющие скорость транскрипции. Далее в молекуле ДНК располагаются кодирующие (экзоны) и некодирующие (интроны) участки гена. Участок (сайт) терминации определяет окончании синтеза РНК.
Инициация заключается во взаимодействии иницирующих белков с промотором и расхождении нитей ДНК, их раскручивании и формировании транскрипционной вилки. РНК-полимераза связывается с промоторным участком и по принципу комплементарности соединяет нуклеотиды цепи РНК в направлении от 5 конца к 3. РНК-полимераза - это олигомерный фермент, состоящий из нескольких субъединиц, не тербующий затравки. При достижении РНК – полимеразой участка терминации происходит его связывание с белками терминации, что сопровождается отсоединением РНК-полимеразы от ДНК, диссоциацией её и окончанием транскрипции.
Процессинг РНК
Синтезированная РНК переписывает с кодирующей нити ДНК как кодирующие участки, так и некодирующие участки гена и является про-РНК (незрелой РНК). Про-РНК в последующем подвергается созреванию (процессингу). Существует несколько механизмов процессинга:
сплайсинг – вырезание копий интронов и соединение копий экзонов;
присоединение к про-РНК добавочных нуклеотидов;
модификация азотистых оснований в составе про-РНК
Особенности процессинга для рРНК, тРНК, иРНК.
Процессинг иРНК заключается в добавлении КЭП - участка и полиаденилового хвоста в сочетании со сплайсингом.
Процессинтг тРНК происходит путём метилирования азотистых оснований и добавления акцепторного участка ЦЦА в сочетании со сплайсингом.
Процессинтг рРНК заключается в вырезании из большого предшественника фрагментов всех видов РНК: 18S; 5S; 5,8S; 28S;.
Возможен альтернативный сплайсинг, который состоит в том, что для разных белков интроны могут играть роль экзонов и наоборот.
Возможен и безматричный синтез РНК; он происходит из нуклеозиддифосфатов при участии фермента полинуклеотидфосфорилазы. В этом варианте синтезируются стандартные, небольшие молекулы РНК, необходимые для синтеза стандартных белков.
Таким образом, передача генетической информации происходит в следующем направлении: ДНК→ РНК→ белок. Однако, в некоторых фагах, эмбриональных тканях возможен синтез ДНК по матрице РНК (РНК→ДНК). Этот вариант синтеза катализирует фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). В вирусах возможен также вариант синтеза РНК→РНК при участии РНК-репликазы.
Биосинтез белков – трансляция
Основной структурой синтезируемых белков является первичная структура (последовательность аминокислот в полипептидной цепи), которая заложена в генетическом коде ДНК.
Генетический код имеет ряд характеристик.
Триплетность –1 аминокислота кодируется тремя нуклеотидами. Из 4 видов нуклеотидов ДНК при триплетности кода возможно 64 различных сочетания, что достаточно для кодирования 20 аминокислот.
Однозначность – 1 триплет кодирует только 1 аминокислоту.
Вырожденность – для кодирования 1 аминокислоты имеется несколько триплетов
Непрерывность – между триплетами отсутствуют нуклеотиды, не принадлежащие соседним триплетам.
Неперекрываемость – один нуклеотид не может одновременно принадлежать 2-м триплетам.
Универсальность – код в разных организмах одинаков, отвечает за одни и те же аминокислоты.
Таким образом, код ДНК является линейным непрерывным и однонаправленным. Последовательность нуклеотидов строго соответствует последовательности аминокислот в синтезируемом белке – принцип коллинеарности.
Трансляция
Для трансляции необходимы следующие факторы:
все виды РНК (тРНК, иРНК, рРНК),
аминокислоты в активной форме,
макроэрги (донаторы энергии),
ферменты,
добавочные белковые факторы,
ионы Mg2+
На первой подготовительной стадии происходит активация аминокислот и связывание их со своей транспортной РНК. В этой стадии участвуют ферменты аминоацил-тРНК-синтетазы. Это специфичные ферменты, обеспечивающие соединение аминокислоты с соответствующей тРНК.
+![]()
Инициация синтеза белка происходит при образовании инициирующего комплекса, который включает в себя инициирующий кодон (АУГ, АГУ) и РНК, аминоацил-тРНК, рибосому. КЭП-участком иРНК соединяется с малой субъединицей рибосомы. К инициирующему кодону присоединяется тРНК со своей первой аминокислотой (чаще всего метионином). К малой субъединице присоединяется большая субъединица рибосомы, и на рибосоме формируется два функциональных участка: пептидильный (Р-участок) и аминоацильный (А-участок). Первая тРНК с первой аминокислотой присоединена к Р-участку, а А-участок оказывается свободным.
Элонгация включает в себя замыкание пептидной связи, транслокацию рибосомы по иРНК с использованием энергии ГТФ и АТФ. К свободному А-участку присоединяется своим антикодоном вторая тРНК со второй аминокислотой. Под действием фермента пептидилтрансферазы первая аминокислота отрывается от первой тРНК и присоединяется ко второй аминокислоте с формированием дипептида. В последующем происходит смещение (транслокация) рибосомы по иРНК на расстояние 3 нуклеотидов. При этом вторая тРНК с дипептидом оказывается в пептидильном участке, а аминоацильный участок освобождается. Первая тРНК покидает рибосому и уходит в цитозоль за новой аминокислотой, а к А-участку присоединяется третья тРНК с третьей аминокислотой. Затем дипептид переносится на третью аминокислоту→трипептид. Синтез полипептидной цепи белка происходит в направлении от N-конца к С-концу. В процессе трансляции тРНК выполняет своеобразную адапторную роль в переводе четырёхзначной информации иРНК в двадцатизначную в белках.
Терминация происходит при приближении белоксинтезирующего комплекса к терминирующему кодону иРНК (УАГ, УГА). Этому кодону не соответствует ни одна из тРНК, поэтому не приносится новая аминокислота, и синтез белка обрывается.
Посттрансляционная модификация белков
Многие синтезированные белки в последующем подвергаются посттрансляционной модификации. Существует несколько её вариантов. Наиболее часто встречается:
частичный протеолиз – отщепление «ненужных» участков
(профермент→фермент; прогормон→гормон);
модификация отдельных аминокислот:
окисление (пролин→гидроксипролин в коллагене);
фосфолирирование (присоединение фосфата);
гликозилирование (присоединение углевода);
карбоксилирование (присоединение группы СООН в некоторых факторах свёртывания крови);
присоединение простетической группы;
замыкание дисульфидных мостиков;
изменение олигомерности белка (объединение нескольких мономеров)
В посттрансляционной модификации белков играют важную роль белки - шапероны (они «следят» за правильностью модификации).
В клинической практике применяют в качестве антибактериальных препаратов ингибиторы синтеза нуклеиновых кислот и белка в микроорганизмах. Они проявляют эффект на различных стадиях:
на стадии репликации
Антимицин Д – встраивается в молекулу ДНК и блокирует синтез новой ДНК,
Новобиацин – ингибирует ДНК-гиразу (топоизомеразу),
на стадии транскрипции
Рифамицин – блокирует РНК-полимеразу,
на стадии трансляции
Тетрациклин, левомицетин – связывают либо малую, либо большую субъединицу рибосомы и тем самым блокируют синтез белка,
Пенициллин – блокирует синтез белков, входящих в оболочку микроорганизмов.
Регуляция биосинтеза белка
Наиболее подробно выяснена регуляция синтеза белка на микроорганизмах. Общепринятой является схема авторегуляции Моно и Жакоба. Согласно этой схеме, в молекуле ДНК выделяют ген-регулятор, который отвечает за синтез особой РНК и в последующем за синтез особого белка репрессора. На удалении от этого участка находятся ген-оператор и струрктурные гены. Структурные гены (цистроны) служат матрицей для синтеза иРНК, а в последующем – белков. Белки в процессе обмена образуют метаболиты. Метаболиты связываются с репрессором. Репрессор регулирует активность гена – оператора, который, в свою очередь, влияет на структурные гены.
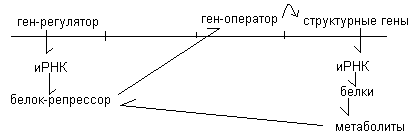
Угнетение биосинтеза белков осуществляется по принципу обратной связи. Высокая концентрация белка и метаболитов приводит к тому, что метаболиты связываются с регрессором и активируют его. Активный репрессор подавляет ген - оператор, а тот - структурные гены, в силу чего синтез белка прекращается.
5. Тесты
1. В состав РНК входят азотистые основания:
Аденин. Гуанин. Урацил. Тимин. Цитозин.
2. Отдельные нуклеотиды в полинуклеотидной цепи соединены связями:
Пептидными. Фосфодиэфирными. Дисульфидными. Водородными.
3. В переваривании нуклеиновых кислот - составных частей нуклеопротеидов пищи участвуют ферменты:
Пепсин. Рибонуклеаза. Трипсин. Фосфолипазы. Дезоксирибонуклеаза. Амилаза. Нуклеотидазы. Фосфатазы.
4. Наименьшей молекулярной массой обладают нуклеиновые кислоты:
ДНК. рРНК. тРНК. иРНК.
5. Конечным продуктом распада пуриновых азотистых оснований в организме человека является:
Мочевина. Мочевая кислота. Аммонийные соли. Креатинин.
6. Величина суточной экскреции с мочой мочевой кислоты у взрослого здорового человека составляет:
0,01-0,05 г. 0,06-0,15 г. 0,35-1,5 г. 2,5-5,0 г.
7. Конечным продуктом распада в организме человека пиримидиновых азотистых оснований является:
Мочевина. Мочевая кислота. Аммонийные соли. Креатинин.
8. При нарушении обмена пуриновых азотистых оснований могут возникать патологические состояния:
Подагра. Базедова болезнь. Мочекаменная болезнь. Болезнь Леш-Нихана. Гипераммониемия.
9. Строительным материалом при матричном синтезе нуклеиновых кислот являются вещества:
Нуклеозидмонофосфаты. Нуклеозиддифосфаты. Нуклеозидтрифосфаты. Циклические нуклеотиды.
10. Процесс биосинтеза РНК называется:
Транскрипция. Трансляция. Репликация. Репарация. Рекомбинация.
11. Биосинтез белка, осуществляющийся с участием полисом и тРНК, называется:
Транскрипция. Трансляция. Репликация. Репарация. Рекомбинация.
12. Основной путь воспроизводства генетической информации
называется:
Транскрипция. Трансляция. Репликация. Репарация. Рекомбинация.
13 Превращение про-РНК в "зрелые" формы называется:
Рекомбинация. Процессинг. Репликация. Трансляция. Терминация.
14. Процессинг и-РНК, т.е. ее созревание сводится к следующему:
Удаление интронов. Удаление экзонов. Специфическая модификация (метилирование, дезаминирование и др.).
15 "Нонсенс - кодоны" (бессмысленные кодоны) в структуре и-РНК являются сигналом:
Сигнал к запуску синтеза белка. Мутантно измененный кодон. Сигнал к терминации синтеза белка. Сигнал для присоединения к синтезированному белку простетических групп.
16. Под термином "вырожденность" генетического кода понимают:
Способность аминокислоты кодироваться более чем одним кодоном. Способность кодона кодировать несколько аминокислот. Содержание в кодоне четырёх нуклеотидов. Содержание в кодоне двух нуклеотидов.
17. К правилам Чаргаффа, характеризующим особенности биспиральной структуры ДНК, относятся:
А = Т. Г = Ц. А = Ц. Г = Т. А + Г = Ц + Т. А + Т = Г + Ц.
17. Для синтеза пиримидиновых оснований de novo используются вещества:
Углекислый газ. Глютамат. Глютамин. Аспартат. Аланин.
19. Для формирования пуринового цикла в ходе синтеза пуриновых нуклеотидов используются вещества:
Углекислый газ. Аспартат. Аланин. Гликокол. Глютамин. Производные тетрагидрофолата.
20. Специфичность взаимодействия аминокислот с т-РНК обусловлена:
Составом антикодона. Особенностью структурной организации тРНК. Специфичностью аминоацил-тРНК-синтетаз. Строением аминокислоты.
21. Предшественником синтеза пуриновых нуклеотидов являются:
Инозиновая кислота. Оротовая кислота. Мочевая кислота
22. Оротатацидурия развивается при «блоке» фермента:
Карбамоиласпартаттрансфераза. Оротатфосфорибозилтрансфераза
Ксантиноксидаза.
23. Первым веществом пиримидинового кольца является:
Карбамоилфосфат. Рибозо-5-фосфат. Оротовая кислота. Аспартат
24. Нуклеотидом - предшественником в синтезе пиримидиновых нуклеотидов является:
Инозинмонофосфат. Оротидилмонофосфат. Ксантиловая кислота. Оротовая кислота
25. Ключевыми ферментами в синтезе пиримидиновых нуклеотидов являются:
Карбамоилфосфасинтетаза. Карбамоиласпартаттрансфераза. Фосфорибозиламидотрансфераза
26. Ключевыми ферментами в синтезе в синтезе пуриновых нуклеотидов являются:
Карбамоилфосфасинтетаза. Карбамоиласпартаттрансфераза. Фосфорибозиламидотрансфераза
27. При иммунодефицитах снижена активность ферментов:
Аденозиндезаминаза. Ксантиноксидаза. Пуриннуклеозидфосфорилаза
28. При синдроме Леш-Нихана снижена активность фермента:
Ксантиноксидаза. Аденинфосфорибозилтрансфераза. Гипоксантин-гуанинфосфорибозилтрансфераза
29. При оротатацидурии снижена активность фермента:
Оротатфосфорибозилтрансфераза. Дигидрооротатдегидрогеназа. Карбамоиласпартаттрансфераза
30. Сигналом начала и конца синтеза полипептидной цепи служит:
Определённые кодоны иРНК. Определённые ферменты. Определённые аминокислоты
31. Процесс превращения про-РНК в зрелые формы называется:
Рекомбинация. Процессинг. Трансляция. Терминация. Репликация
32. При сплайсинге происходит:
Вырезание копий интронов. Вырезание копий экзонов. Соединение информативных участков РНК
33. Для транскрипции необходимы:
ДНК. Праймер. РНК-полимераза. Белковые факторы. Нуклеозидтрифосфаты. Топоизомераза
34. В синтезе РНК участвуют ферменты:
РНК-полимеразы. ДНК-полимеразы. Топоизомеразы. Праймазы
35. «Экзонами» про-РНК называются:
Некодирующие участки. Вспомогательные белки. Терминальный сайт. Кодирующие участки. Стартовый сайт
36. В репарации ДНК участвуют ферменты:
ДНК-лигазы. ДНК – полимеразы. ДНК-рестриктазы. Праймазы
37. Для репликации необходимы:
ДНК. Праймер. И-РНК. Белковые факторы. Нуклеозидтрифосфаты.
Топоизомераза
38. В синтезе ДНК участвуют ферменты:
РНК-полимеразы. ДНК-полимеразы. Пептидилтрансферазы. Топоизомеразы. Праймазы
39. В регуляции синтеза белков участвуют:
Ген-регулятор. Экзон. Ген-оператор. Репрессор. Интрон. Структурный ген
40. При посттрансляционной модификации белков возможны:
Частичный протеолиз. Гликозилирование. Модификация аминокислот. Присоединение простетической группы
41. Процесс перемещения иРНК по рибосоме называется:
Транслокация. Трансляция. Терминация
42. В образовании пептидной связи при биосинтезе белков участвует фермент:
Пептидилтрансфераза. Топоизомераза. Хеликаза
43. Суточная экскреция мочевины у взрослого человека составляет:
1,0-2,0 г. 20-30,0 г. 2,0-8,0 г. 35,0-50,0 г. 8,0-20,0 г
44. Содержание мочевой кислоты в крови у детей составляет:
0.1-0.3 мМ/л. 0,17-0,41 мМ/л. 0.05-0,1 мМ/л
45. Доля азота мочевой кислоты в моче у детей составляет:
1-3%. 3-8,5 %. 0,5-1,0 %.
46. Доля азота мочевины в моче у новорожденных детей составляет:
30% . 75% . 50%.
6. Ситуационные задачи
1. Больной жалуется на боли в суставах. Содержание мочевой кислоты в крови составляет 0,26 ммоль/л. Количество сиаловых кислот – 4,5 ммоль/л ( норма 2,0-2,6 ммоль/л). Какое заболевание можно исключить?
2. У ребёнка обнаружен генетический дефект фермента гипоксантин-гуанинфосфорибозил трансферазы. К каким последствиям это может привести?
3. Больной жалуется на боли в суставах. Содержание мочевой кислоты в крови составляет 0,56 ммоль/л. Количество сиаловых кислот – 2,5 ммоль/л (норма 2,0-2,6 ммоль/л). Какое заболевание наиболее вероятно? Какая диета показана?
4. В результате мутации гена изменён порядок чередования нуклеотидов в кодоне. К чему это может привести?
5. У ребёнка, страдающего гиповитаминозом, снижен обмен нуклеиновых кислот. Объясните причины нарушений. Какие витамины показаны в первую очередь?
6. При сахарном диабете существенно падает скорость синтеза нуклеиновых кислот. Опишите возможные причины этого нарушения.
7. Опухолевые клетки характеризуются ускоренным клеточным делением и ростом. Как можно этому восприпятствовать, влияя на синтез азотистых оснований?
7. Основная и дополнительная литература к теме
Основная
Биохимия. Под ред. Е.С. Северина. 2003. С. 521-544
Биохимия. Краткий курс с упражнениями и задачами. 2001. С. 59-94,
256-266
А.Я. Николаев Биологическая химия. 2004. С. 366-380
О.Д. Кушманова. Руководство к лабораторным занятиям по биологической химии. 1983. С. 66-73
Лекционный материал
Дополнительная
Т.Т. Березов, Б.Ф. Коровкин. Биологическая химия. 1990. С.77-89, 399-420
Р.Марри. Биохимия человека. С 5-126 (2)
Ю.Е. Вельтищев, М.В. Ермолаев, А.А. Ананенко, Ю.А. Князев. «Обмен веществ у детей». М.: Медицина. 1983. 462 с.
Р.М. Кон, К.С. Рот. Ранняя диагностика болезней обмена веществ. М. «Медицина».- 1986.
Макаренко Т.Г., Стунжас Н.М. Учебно-методические пособия «Биохимические особенности детского организма». 2001. 2007.
Макаренко Т.Г., Стунжас Н.М. Учебно-методическое пособие «Особенности обмена веществ у новорожденных и грудных детей» (Рекомендовано УМО). Смоленск. 2012.
Занятие № 24
Итоговое занятие по теме «Обмен нуклеопротеидов»
Экзаменационные вопросы
Нуклеиновые кислоты как полимерные соединения. Состав и строение нуклеотидов, их функции в организме. Биологическое значение нуклеиновых кислот. Уровни структурной организации. Видовая специфичность первичной структуры.
Основные виды нуклеиновых кислот в тканях. Их общая характеристика. Особенности химического состава, структуры и свойств молекул ДНК. Комплементарность азотистых оснований. Денатурация и ренативация ДНК. Гибридизация ДНКДНК и ДНКРНК.
Распад в тканях пиримидиновых и пуриновых нуклеотидов. Конечные продукты распада. Особенности выведения мочевой кислоты из организма. Гиперурикемия. Подагра.
Биосинтез пиримидиновых нуклеотидов. Аллостерические механизмы регуляции.
Биосинтез пуриновых нуклеотидов. Происхождение частей пуринового ядра. Начальные стадии биосинтеза. Инозиновая кислота как предшественник адениловой и гуаниловой кислот. Аллостерические механизмы регуляции биосинтеза.
Биосинтез ДНК. Репликиция и репарация повреждений. Ферменты биосинтеза ДНК. Матрица. Соответствие первичной структуры продукта реакции первичной структуре матрицы. Затравка (праймер). Матричная роль РНК. Ревертаза.
Биосинтез РНК. РНК-полимеразы. Транскрипция как передача информации от ДНК к РНК. Образование первичного транскрипта, его созревание (процессинг).
Биосинтез белков. Матричная (информационная) РНК. Основной постулат молекулярной биологии: ДНКиРНКбелок. Соответствие нуклеотидной последовательности гена аминокислотной последовательности белка (коллинеарность). Проблема перевода (трансляция) четырёхзначной нуклеотидной записи информации в двадцатизначную аминокислотную запись. Характеристика нуклеотидного кода.
Транспортные РНК (тРНК), особенности структуры и функций. Изоакцепторные формы тРНК. Биосинтез аминоацил-тРНК. Значение высокой субстратной специфичности аминоацил-тРНК-синтетаз.
Биологические системы биосинтеза белков. Строение рибосом. Последовательность событий при биосинтезе полипептидной цепи. Инициация, элонгация, терминация. Регуляция биосинтеза белков. Ингибиторы матричного биосинтеза: лекарственные препараты, вирусные и бактериальные токсины. Посттрансляционное изменение полипептидной цепи.
