
- •Часть II
- •1. Тема занятия № 18
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 20
- •3. Задачи самостоятельной работы:
- •Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 21
- •3. Задачи самостоятельной работы:
- •4.Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 23
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 25
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 27
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 28
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 29
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 31
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
- •1. Тема занятия № 32
- •3. Задачи самостоятельной работы:
- •4. Перечень вопросов для самостоятельной работы
1. Тема занятия № 20
ПЕРЕВАРИВАНИЕ БЕЛКОВ. ГНИЕНИЕ БЕЛКОВ В
ТОЛСТОМ КИШЕЧНИКЕ. КАТАБОЛИЗМ
АМИНОКИСЛОТ В ТКАНЯХ
2. Цели самостоятельной работы: расширить знания о процессах переваривания белков, их гниении в толстом кишечнике и механизмах детоксикации продуктов гниения в печени
3. Задачи самостоятельной работы:
- выработать навык оценки клинико-диагностического значения количественного определения активности трансаминаз в сыворотке крови,
обнаружения индикана в моче.
- ознакомиться с особенностями переваривания и гниения белков у детей
- сформировать навык работы с новой информацией, её анализа, логичного изложения
- сформировать навык использования полученных знаний в учебной и профессиональной деятельности
Перечень вопросов для самостоятельной работы
Разделы и темы для самостоятельного изучения |
Виды и содержание самостоятельной работы |
Азотистый обмен. Характеристика белкового питания Переваривание белков. Особенности переваривания и всасывания белков у детей Гниение белков в толстом кишечнике Обезвреживание продуктов гниения в печени Биогенные амины
|
Проработка учебного материала для самостоятельной работы Работа с тестами Решение ситуационных задач Написание рефератов Подготовка презентаций |
Обмен белков и аминокислот
Белки являются источником азота для организма. Поступающий с белками азот выводится в виде конечных продуктов азотистого обмена. Обмен белков характеризуется понятием азотистый баланс.
Азотистый баланс – разница между поступающим в организм и выводимым из организма азотом. Различают три его вида: азотистое равновесие, положительный азотистый баланс, отрицательный азотистый баланс
При положительном азотистом балансе поступление азота преобладает над его выделением. Чаще встречается истинный положительный баланс (беременность, лактация, детский возраст). Для детей 1-го года жизни задержка азота составляет +30%, в 4 года +25%, в подростковом (14 лет) +14%. При ложном положительном балансе происходит задержка в организме конечных продуктов азотистого обмена (при заболевании почек).
При отрицательном азотистом балансе преобладает выделение азота над его поступлением. Это может наблюдаться при тяжелых заболеваниях (туберкулез, ревматизм, онкологические заболевания).
При азотистом равновесии поступление азота равно его выделению (характерно для здоровых взрослых людей). Азотистый обмен характеризуется коэффициентом изнашивания - количеством белка, которое теряется из организма в условиях полного белкового голодания. Для взрослого он равен 53 мг N/кг или 24 г белка/сутки. У новорожденных коэффициент изнашивания выше, чем у взрослых людей и составляет 120 мг N/кг.
Характеристика белкового питания
Азотистое равновесие обеспечивается рациональным белковым питанием. Белковый рацион имеет опредёленные количественные и качественные критерии.
Для взрослых людей приняты такие нормы белка в питании как белковый минимум и белковый оптимум. Белковый минимум – то количество белка, которое обеспечивает азотистое равновесие при условии, что все энергетические затраты организма обеспечиваются углеводами и жирами (40-45 г/сутки). При продолжительном использовании белкового минимума постепенно наблюдается снижение иммунитета, процессов кроветворения, репродуктивной системы. Поэтому оптимальным для взрослых людей является белковый оптимум, который обеспечивает выполнение всех его функций без ущерба для здоровья (100 – 120 г/сутки).
В настоящее время норма потребления белка для детей пересматривается в сторону её снижения. Для новорожденного потребность в белках при естественном вскармливании составляет примерно 2 г/кг, к концу первого года снижается до 1 г/кг. При искусственном вскармливании необходимо 2 – 4 г/кг.
Все пищевые белки различаются по их ценности для организма. Полноценные белки должны отвечать ряду требований, в частности, содержать набор всех незаменимых аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, аргинин, гистидин, триптофан, фенилаланин) в соотношении близком к их соотношению в тканевых белках, хорошо перевариваться в желудочно-кишечном тракте. К полноценным белкам относятся в основном белки животного происхождения. Для новорожденных детей все пищевые белки должны быть полноценными (белки грудного молока). В возрасте трёх - четырёх лет на них должно приходиться 70-75% потребляемых белков, для взрослых - около 50%.
Переваривание белков в желудочно-кишечном тракте
Переваривание белков состоит в их гидролитическом расщеплении до аминокислот, при котором теряется видовая специфичность пищевых белков. Протеолитические ферменты желудочно-кишечного тракта выделяются в неактивном состоянии (это защитный механизм от переваривания тканевых белков, сопутствующих ферментов). Их активирование происходит в просвете желудка и кишечника путём частичного протеолиза. Протеазы могут относиться к эндопептидам, расщепляющим внутренние пептидные связи в молекуле белка, или к экзопептидазам, отрывающим концевые аминокислоты. Протеолитические ферменты отличаются субстратной специфичностью. Переваривание белков происходит в желудке и в тонком кишечнике.
Основным ферментом, расщепляющим белки в желудке, является пепсин. Он выделяется в неактивном состоянии, в виде профермента пепсиногена. Под действием HCl происходит частичный протеолиз пепсиногена с превращением его в активную форму пепсин. Это сопровождается обнажением активного центра, повышением активности фермента.
![]()
Пепсин относится к эндопептидазам, расщепляет внутренние пептидные связи, образованные тирозином, фенилаланином.
Важную роль в желудке играет HCl. Она является специфичным активатором пепсиногена, обеспечивает оптимум рН для пепсина (рН = 1-2), вызывает частичную денатурацию белка, создаёт бактерицидный барьер.
Слизистая желудка имеет целый ряд защитных механизмов от агрессивного действия пепсина и HCl. К ним относятся выработка слизи (её основной компонент гликозаминогликаны), выделение пепсина в неактивном состоянии, выделение бикарбонатов.
У детей процессы переваривания белков в желудке менее активны, чем у взрослых, так как выделяется менее активный пепсин в более щелочной среде. У грудных детей в переваривании белков в желудке участвуют также химозин (фермент, створаживающий молоко), гастриксин (оптимум рН 4-5), катепсины. При грудном вскармливании в протеолизе участвуют протеазы грудного молока. В желудке происходит частичное переваривание белков до пептидов.
Дальнейшее переваривание белков осуществляется в тонком кишечнике под действием ферментов поджелудочной железы и собственных ферментов энтероцитов. К ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза, карбоксипептидазы.
Т
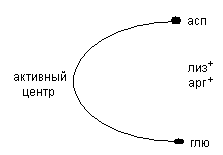
Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется трипсином путём частичного протеолиза, относится к эндопептидазам. Он содержат в активном центре гидрофобные аминокислоты, в связи с чем, расщепляет в белках связи ароматических кислот (фен, тир).
Эластаза активируется из проэластазы трипсином путём частичного протеолиза. В активном центре эластазы преобладают разветвлённые аминокислоты, поэтому эластаза расщепляет внутренние пептидные связи, образованные аминокислотами с небольщим радиалом (глицин, аланин).
Карбоксипетидазы являются экзопептидазами. Карбоксипетидаза А отщепляет С-концевые ароматические аминокислоты, карбоксипептидаза В отщепляет концевые лизин и аргинин.
К ферментам слизистой кишечника относятся аминопептидазы и дипептидазы.
Аминопептидазы – экзопептидазы, отщепляют N-концевые аминокислоты. К аминопептидазам принадлежит лейцинминопептидаза (ЛАП).
Дипептидазы расщепляет дипептиды. В тонком кишечнике происходит полное гидролитическое расщепление пищевых белков до аминокислот. Образовавшиеся аминокислоты подвергаются всасыванию.
У детей снижена активность протеолитических ферментов слизистой кишечника и поджелудочной железы.
Всасывание аминокислот
Всасывание аминокислот - Na-зависимый активный процесс, требующий АТФ. Перенос отдельных аминокислот осуществляется специальными переносчиками. Среди транспортных систем аминокислот наиболее важной является система, включающая трипептид глютатион (глю-гли-цис), фермент γ-глютаминтранспептидазу (ГГТП). Аминокислота образует временный комплекс с глютаминовой кислотой глютатиона и подвергается всасыванию.
У детей могут всасываться не только аминокислоты, но и пептиды, низкомолекулярные белки. Благодаря этому в организм ребёнка из грудного молока могут поступать Jg, антитела. В то же время возможны аллергические реакции на чужеродные белки.
Гниение белков в толстом кишечнике
Процессу гниения подвергаются не полностью расщепившиеся белки и отдельные аминокислоты. Оно происходит под действием ферментов гнилостной микрофлоры толстого кишечника. При гниении образуется большое количество газообразных и негазообразных токсичных веществ. К продуктам гниения белков относятся CO2, CH4, NH3, H2S, меркаптаны, альдегиды, кетоны, карбоновые кислоты, диамины, циклические токсичные вещества.
Диамины образуются при декарбоксилировании диаминокислот (лизин, орнитин).
NH2-(CH2)5-NH2
кадаверин
![]()
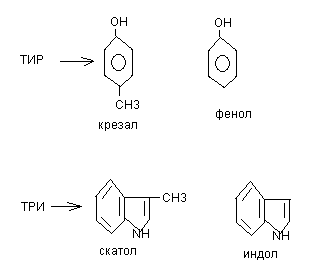
Из триптофана и тирозина могут образовываться токсичные циклические продукты: скатол, индол, крезол, фенол.
Т
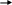 оксичные
продукты подвергаются всасыванию, по
системе vena porta поступают в печень, где
подвергаются обезвреживанию.
оксичные
продукты подвергаются всасыванию, по
системе vena porta поступают в печень, где
подвергаются обезвреживанию.
крезол
О безвреживание
продуктов гниения белков в печени
безвреживание
продуктов гниения белков в печени
К процессам детоксикации продуктов гниения белков в печени относятся биосинтез мочевины из NН3, микросомальное окисление токсичных продуктов и образование парных нетоксичных соединений (реакции коньюгирования).
В микросомальном окислении токсичных веществ участвуют ферменты моноксигеназы. В результате гидроксилирования происходит снижение токсичности, повышается водорастворимость, повышается реакционная способность обезвреживаемых веществ.
R H2
+1/2 O2
монооксигеназа
RH-OH (нетоксичное соединение)
H2
+1/2 O2
монооксигеназа
RH-OH (нетоксичное соединение)
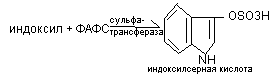
Образование парных нетоксичных соединений происходит путём присоединения к токсическим веществам Н2SО4, глюкуроновой кислоты, гликокола. Серная кислот в процессах обезвреживания участвует в активной форме ФАФС (фосфо-аденозил-фосфо-сульфат), которая обезвреживает, например, индоксил:
сульфотрансфераза
OSO3H
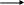
К
глюкуронил
трансфераза
Например:
ф енол
+ УДФ-глюкуроновая к-та
фенилгюкуроновая к-та
енол
+ УДФ-глюкуроновая к-та
фенилгюкуроновая к-та
Для оценки антитоксической функции печени применяется проба Квика. При её проведении в организм вводится бензойная кислота, которая соединяясь с глицином, образует гиппуровую кислоту. Её количество, выделяемое с мочой, характеризует обезвреживающую функцию печени. Более современной является антипириновая проба (аптипирин в печени подвергается микросомальному окислению).
У новорожденных детей гнилостные процессы отсутствуют. У взрослых людей усиление гнилостных процессов наблюдается при снижении активности протеолитических ферментов желудка и кишечника, при снижении моторики кишечника, дисбактериозах.
Биогенные амины
Биогенные амины образуются при декарбоксилировании аминокислот в тканях, обладают широким спектром метаболических и физиологических эффектов. К биогенным аминам относятся гистамин, серотонин, катехоламины, гамма-аминомасляная кислота, полиамины.
Гистамин
CH2-CH2-NH2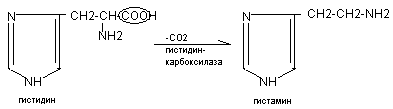
 Гистамин синтезируется в тучных клетках,
накапливается в секреторных гранулах,
выделяется при раздражении.
Гистамин синтезируется в тучных клетках,
накапливается в секреторных гранулах,
выделяется при раздражении.
Эффекты: расширение сосудов, снижение АД, увеличение тканевой проницаемости, развитие местного отёка, стимулирование желудочной секреции, бронхоспатический эффект. В высокой концентрации – медиатор воспалительных и аллергических реакций.
Серотонин
CH2-CH2-
NH2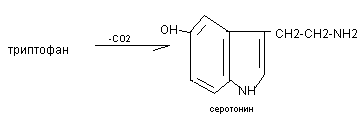

Серотонин синтезируется в хромафинных клетках кишечника, в некоторых ядрах подкорковых структур, тромбоцитах.
Серотонин вызывает спазм сосудов, повышает артериальное давление, регулирует перистальтику кишечника, участвует в терморегуляции, в механизмах сна, оказывает влияние на психические реакции человека, служит исходным веществом для синтеза гормона мелатонина. С нарушением обмена серотонина связывают развитие шизофрении.
Катехоламины: дофамин, адреналин, норадреналин
+CH3
СН3
дофамин
норадреналин адреналин![]()
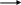
Дофамин – возбуждающий медиатор, при его дефиците может развиться болезнь Паркинсона (адинамия, ригидность, тремор).
Норадреналин – нейромедиатор симпатической нервной системы
Адреналин вызывает спазм сосудов, повышает АД, стимулирует работу сердца, является гормоном стресса
ГАМК (гамма-аминомасляная кислота)
Г
![]()
кровоснабжение мозга, активирует окислительные процессы.
HOOC-CH2-
CH2-
CH2-NH2
ГАМК
Полиамины - спермин, спермидин синтезируются из орнитина и метионина, входят в состав хроматина, участвуют в регуляции процессов трансляции, транскрипции, репликации.
Окислительное дезаминирование аминов:
Так как биогенные амины очень активны, они быстро инактивируются. Основным способом их инактивации является окислительное дезаминирование под действием ферментов аминооксидаз (МАО, полиаминооксидазы). Ингибиторы МАО широко применяются в клинической практике.
2Н+
NH3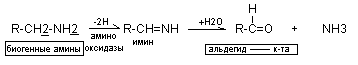
5. Тесты
1. К основным функциям белков пищевых продуктов относятся:
Основной источник азота для организма. Субстрат для жизнедеятельности гнилостной микрофлоры кишечника. Источник энергии для организма. Источник заменимых аминокислот. Источник незаменимых аминокислот. Способствуют угнетению бродильной микрофлоры кишечника.
2. Понятие "коэффициент изнашивания" организма означает:
Максимальное количество белка, расходуемое тканями при обычном питании. Максимальное количество белка, "сгораемое" в организме при максимальных энергозатратах. Минимальное количество белка, теряемое организмом ежесуточно при его полном отсутствии в пищевом рационе. Количество белка, теряемое организмом ежедневно при патологии почек.
3. Понятие "белковый минимум" означает:
Количество белка в пище, которое создает положительный азотистый баланс организма. Количество белка в пищевом рационе, которое соответствует коэффициенту изнашивания. Количество белка в пищевом рационе, которое создает отрицательный азотистый баланс. Минимальное количество белка в пищевом рационе, которое способно непродолжительное время поддерживать азотистое равновесие.
4. Полноценные белки должны отвечать требованиям:
Содержать все заменимые аминокислоты. Содержать набор незаменимых аминокислот. Обладать хорошими вкусовыми качествами. Иметь животное происхождение. Иметь растительное происхождение. Содержать аминокислоты в соотношении близком к потребностям организма человека. Подвергаться действию протеаз желудочно-кишечного тракта человека. Легко подвергаться термической обработке.
5. В составе желудочного сока присутствуют ферменты:
Пепсин. Трипсин. Гастриксин. Химотрипсин. Эластаза. Карбоксипептидазы. Аминопептидазы. Дипептидазы.
6. Сущность процесса активации протеаз желудочно-кишечного тракта состоит:
В комплексировании с углеводным компонентом. В комплексировании с липидным компонентом. В частичном протеолизе. В фосфорилировании.
7. Интенсификации процессов гниения непереваренных белков в толстом кишечнике способствуют:
Усиленная перистальтика кишечника. Ослабленная перистальтика кишечника. Пищевой рацион с повышенным содержанием клетчатки.
Пищевой рацион с низким содержанием клетчатки. Преобладание в пищевом рационе полноценных белков. Преобладание в пищевом рационе неполноценных белков.
8. К продуктам распада белков под влиянием гнилостной микрофлоры в толстом кишечнике относятся:
Спермидин. Фенол. Скатол. Кадаверин. Аммиак. Путресцин. Индол. Крезол. Гиппуровая кислота.
9. Для обезвреживания в печени некоторых ксенобиотиков путём их коньюгирования (образования парных соединений) могут быть использованы вещества:
Триптофан. Гликокол. Серная кислота. Глюкуроновая кислота. Ацетоуксусная кислота. Аммиак. Ацетил-КоА.
10. К процессам обезвреживания в печени токсичных продуктов гниения белков в толстом кишечнике относятся:
Неоглюкогенез. Орнитиновый цикл. Цикл Кори. Окислительные реакции. Реакции коньюгирования (образования парных соединений). Цикл трикарбоновых кислот.
11. Увеличение экскреции индикана с мочой может свидетельствовать:
О нарушении пигментного обмена. О нарушении углеводного обмена. О поражении почек. Об усилении гниения белков в кишечнике. О поражении печени.
12. Проба Квика, характеризующая состояние антитоксической функции печени, оценивается по экскреции с мочой метаболита:
Аммонийных солей. Индикана. Гиппуровой кислоты. Билирубина. Бензойной кислоты.
13. К образованию биогенных аминов ведёт процесс:
Трансаминирование аминокислот. Декарбоксилирование аминокислот. Восстановительное аминирование альфа-кетокислот. Внутримолекулярное дезаминирование аминокислот. Окислительное дезаминирование аминокислот.
14. К биогенным аминам относятся вещества:
Креатин. Гамма-аминомасляная кислота. Креатинин. Серотонин. Карнозин. Спермидин. Норадреналин. Адреналин. Гистамин.
15. ГАМК (гамма-аминомасляная кислота) образуется при декарбоксилировании аминокислоты:
Триптофана. Гистидина. Глютамина. Глютамата. Тирозина. Фенилаланина.
16. Адреналин и норадреналин (катехоламины) образуются в результате химических превращений аминокислоты:
Триптофана. Гистидина. Тирозина. Глютамата. Лизина. Аргинина.
17. Серотонин - биогенный амин с медиаторным эффектом образуется при окислении и последующем декарбоксилирование аминокислоты:
Глютамата. Тирозина. Серина. Гистидина. Триптофана. Глютамина.
18. В реакциях трансаминирования и декарбоксилирования аминокислот принимает участие витамин:
Рибофлавин. Пиридоксин. Витамин РР. Витамин С. Биотин. Ретинол.
19. В реакциях трансаминирования акцептором переносимой аминогруппы служит:
Пировиноградная кислота. Молочная кислота. Щавелевоуксусная кислота. Бета-гидроксимасляная кислота. Альфа-кетоглутаровая кислота. Ацетоуксусная кислота.
20. В реакциях окислительного дезаминирования аминокислот участвуют ферменты:
Моноаминооксидазы. Аминокислотоксидазы. Глициноксидаза. Глютаматдегидрогеназа. Гистидиндезаминаза.
21. Наиболее часто с клинико-диагностической целью определяются ферменты обмена аминокислот:
Фолатредуктаза. Моноаминоксидазы. Аланинаминотрансфераза. Глютаматдегидрогеназа. Глютаминсинтетаза. Аспартатаминотрансфераза. Глициноксидаза. Глютаминаза.
22. Для катаболизма аминокислот в тканях человека наиболее характерны виды дезаминирования:
Восстановительное. Окислительное. Гидролитическое. Внутримолекулярное.
23. Вследствие нарушения обмена аминокислот развиваются заболевания:
Фруктоземия. Подагра. Алкаптонурия. Микседема. Альбинизм. Фенилкетонурия. Рахит.
24. К фенилпировиноградной олигофрении (фенилкетонурии) приводит нарушение обмена аминокислоты:
Тирозин. Лизин. Фенилаланин. Гистидин. Аргинин.
25. Причиной развития алкаптонурии является нарушение обмена аминокислоты:
Цистеина. Триптофана. Тирозина. Метионина. Гистидина. Аргинина.
26. Отличия гнилостной микрофлоры кишечника у детей имеет следующие отличия от взрослых:
Более высокая активность. Менее выражена, чем у взрослых. Отсутствует у новорожденных.
27. В реакциях трансаминирования участвуют:
Амины. Аминокислоты. Аммиак. Кетокислоты. Аминокислоты. Карбоновые кислоты. Альдегиды.
28. К особенностям переваривания белков у грудных детей относятся:
Более низкая активность пепсина. Более кислая среда в желудке. Более низкая активность кишечных протеиназ. Более высокая активность кишечных протеиназ.
6. Ситуационные задачи
1. Больному, в анамнезе которого недавно перенесенный гепатит, назначен продолжительный курс антибиотиков для лечения пневмонии. Какие диетические рекомендации в отношении белковой пищи должен дать врач пациенту? Опишите в виде схемы все процессы, которые происходят у данного больного с белками в желудочно-кишечном тракте.
2. У пожилого больного, длительно находящегося на постельном режиме после перелома шейки бедра, при анализе мочи обнаружено повышенное количество индикана. Объясните химизм его образование и причины индиканурии?
3. Врач назначил снотворное, поскольку пациент страдал бессоницей. Концентрация мочевины у больного составляла 1,8 мМ/л. Правильное ли назначение сделал врач с учётом того, что снотворный препарат ухудшает функцию печени? Объясните.
4. При недостатке в пище витамина В1 в крови возрастает концентрация аланина и глутаминовой кислоты. При недостаточном поступлении витаминов В1 и В6 содержание этих аминокислот в крови не меняется. С помощью химических реакций объясните причину данных явлений.
5. Больной около полугода назад перенес инфекционный гепатит. В последнее время появились жалобы на усиление слабости, плохой аппетит.
В крови выявлено некоторое повышение активности фермента аланинаминотрансферазы, однако коэффициент аспартатаминотрансфераза/ /аланинаминотрансфераза значительно снизился (с 1,33 в норме до 0,95). Подтверждают ли данные биохимического исследования крови обострение заболевания печени?
6. Больной страдает анацидным гастритом (снижена продукция соляной кислоты в желудке). Как улучшить протеолитическую способность пепсина? Какие функции выполняет соляная кислота в желудке?
7. Причиной развития болезни Паркинсона считается резкое снижение концентрации дофамина. Для лечения применяют ингибиторы МАО и производные ДОФА. Объясните принцип действия данных препаратов.
8. У ребёнка выявлена высокая концентрация аминокислот и низкое содержание индикана в моче.
Каковы нарушения переваривания белков в желудочно-кишечном тракте? Какие дополнительные анализы необходимы?
9. Врач-педиатр назначил ребёнку с заболеванием желудка пепсин. Какой препарат необходим дополнительно? Почему?
10. С пищей в организм подростка поступает 80 г белка в сутки. С мочой за это время выделилось 16 г азота. Каков азотистый баланс у ребёнка? О чём он свидетельствует?
11. Ребёнок поступил в хирургическое отделение с болями в животе. При лабораторном обследовании выявлено резкое повышение индикана в моче. Какова возможная причина этого нарушения?
12. В желудочном соке больного обнаружена молочная кислота. При каких заболеваниях возможно данное нарушение? Какие компоненты желудочного сока необходимо определить дополнительно для уточнения диагноза?
7. Основная и дополнительная литература к теме
Основная
Биохимия. Под ред. Е.С. Северина. 2003. С. 458-476
А.Я. Николаев Биологическая химия. 2004. С. 330-365
Биохимия. Краткий курс с упражнениями и задачами. 2001. С. 226-255
А.Я.Николаев Биологическая химия. 2004. С. 330-340
О.Д. Кушманова. Руководство к лабораторным занятиям по биологической химии. 1983. С. 66-73
Лекционный материал
Дополнительная
Т.Т. Березов, Б.Ф. Коровкин. Биологическая химия. 1990. С. 318-364
Р. Марри и др. Биохимия человека. С. 299-355 (1)
Ю.Е. Вельтищев, М.В. Ермолаев, А.А. Ананенко, Ю.А. Князев. «Обмен веществ у детей». М.: Медицина. 1983. 462 с.
Р.М. Кон, К.С. Рот. Ранняя диагностика болезней обмена веществ. М. «Медицина».- 1986.
Макаренко Т.Г. , Стунжас Н.М. Учебно-методические пособия «Биохимические особенности детского организма». Смоленск. 2001. 2007.
Макаренко Т.Г., Стунжас Н.М. Учебно-методическое пособие «Особенности обмена веществ у новорожденных и грудных детей» (Рекомендовано УМО). Смоленск. 2012.
