
Раздел 2. Специфика полимерного строения вещества
Специфика физико-химических свойства полимеров в значительной степени определяется их макромолекулярным строением. Определяющую роль в связи свойств и строения полимеров играет гибкость цепи макромолекулы.
Гибкость цепи - это ее способность изменять форму под влиянием теплового движения звеньев или под действием внешних силовых полей.
Исследование природы гибкости макроцепи следует начать с рассмотрения отдельных мономерных групп, ее составляющих.
2.1. Внутреннее вращение в макромолекулах
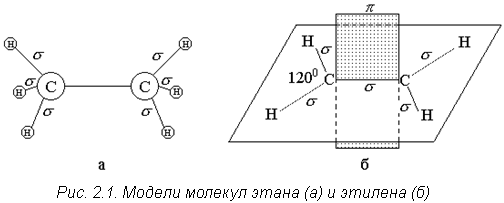
Простейшим примером насыщенного углеводородного звена полимера может служить молекула этана - С2Н6 (рис. 2.1, а). В ней атомы углерода и водорода соединены ковалентными с образованием так называемой s-связи. Валентный угол между σ-связями составляет 109°28’. В пространстве такая молекула имеет структуру тетраэдра.
Атомные группировки молекулы этана могут вращаться вокруг углеродной связи, определяя внутреннее вращение звеньев. При этом звенья в пространстве могут занимать два предельных положения (конфигурации) - цис- и транс-:
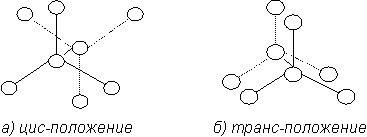
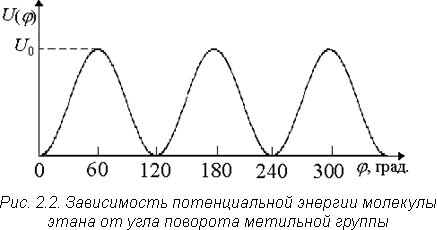
Два таких крайних положения, сдвинутых на угол 60°, характеризуются разными значениями потенциальной энергии (U), т.е. потенциальная энергия есть функция угла поворота U = f(φ) (рис. 2.2). Самым энергетически невыгодным является цис-положение, самым выгодным - транс-положение. Энергия, необходимая для перехода молекулы из положения с минимальным значением потенциальной энергии в положение, соответствующее ее максимальному значению, потенциальным или активационным барьером вращения. Для молекулы этана высота такого барьера = 12,1 кДж/моль. Изменения положений атомов возможны без разрыва углеродной химической связи.
Взаимное расположение атомов и атомных групп в молекуле, которое может быть изменено в результате вращения отдельных частей молекулы без разрыва химических связей называется конформацией молекулы.
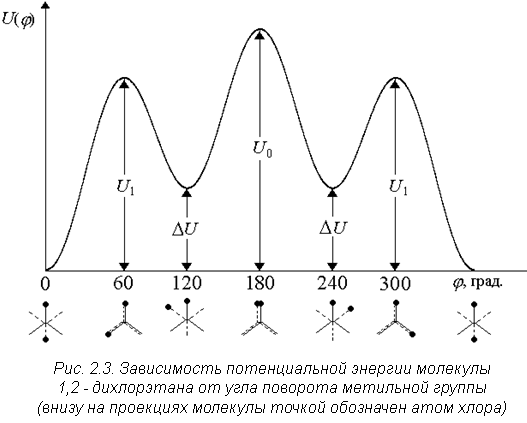
Для молекул с меньшей степенью симметрии по сравнению с молекулой этана, например, молекулы 1,2-дихлорэтана, кривая принимает более сложную форму (рис. 2.3).
На этой кривой выражены три минимума, соответствующие углам поворота равным 0; 120 и 240°. Самый глубокий минимум соответствует плоской транс-форме, два других - скошенным или гош-формам. Формы молекул, которые они могут под влиянием теплового движения, называют поворотными изомерами. Энергии двух гош-форм одинаковы и превышают энергию транс-формы примерно на 2100 ÷ 3350 Дж/моль.
Двойная связь в молекуле этилена осуществляется при помощи обычной σ-связи и специфической π-связи (рис. 2.1, б). Особая конфигурация электронного облака π-связи обусловливает фиксированное направление остальных четырех ковалентных σ-связей при двух углеродных атомах. Эти связи расположены в одной плоскости под углом 1200 относительно друг друга и относительно направления σ-связи при двух атомах углерода. Вращение атомных групп вокруг двойной связи невозможно без разрыва этой связи. Взаимное расположение атомов и атомных групп в молекуле, которое не может быть изменено в результате вращения отдельных частей молекулы без разрыва химических связей называется конфигурацией молекулы.
В случае с этиленом, обе возможные конфигурации равнозначны. Но уже конфигурации молекулы, имеющей двойную связь и два разных заместителя - A и B, принципиально различаются:

Рассчитанные на основе свойств идеальных газов потенциальные барьеры вращения дают для большинства органических соединений значения 4 ÷ 19 кДж/моль (табл. 2.1).
Таблица 2.1. Значения потенциальных барьеров вращения для некоторых изолированных молекул
Органическое соединение |
Потенциальный барьер вращения Дж/моль |
Органическое соединение |
Потенциальный барьер вращения Дж/моль |
Н3С – СН3 |
11,7 |
Н3С – OН |
4,5 |
Н3С – СН2 |
14,3 |
Н3С – SН |
4,45 |
Н3С – СН(СН3)2 |
16,4 |
Н3С – NН2 |
8,0 |
Н3С – С(СН3)3 |
18,5 |
Н3С – SН3 |
7,1 |
Н3С – СН=СН2 |
8,2 |
F3С – CF3 |
18,3 |
Н3С – СF3 |
15,5 |
|
|
Если запаса кинетической энергии атомов или звеньев макромолекулы недостаточно для преодоления барьера вращения, вращения не происходит. Наблюдается только колебательное движение элементов в пределах потенциальной ямы. Такое явление получило название заторможенного или ограниченного внутреннего вращения.
