
- •Часть 2
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Список литературы
Примеры решения задач
Пример 1. Определите заряд комплексообразователя в соединении [Co(NH3)4Cl2]NO2. Назовите это соединение.
Р е ш е н и е
Внешняя сфера КС состоит из одного аниона NO , следовательно, заряд всей внутренней сферы равен +1, т. е. [Co(NH3)4Cl2]+. Внутренняя сфера содержит две группы лигандов NH3 и Cl–. Степень окисления комплексообразователя обозначаем через х и решаем уравнение
+1 = 1 х + 0 · 4 + 2 · (–1).
Отсюда х = +1.
Таким образом, КС является комплексным катионом. Название соединения – нитрит дихлоротетрааммин кобальта (+1).
Пример 2. Почему ион [Cu(NH3)2]+ имеет линейное строение?
Р е ш е н и е
Определяем заряд комплексообразователя в данном комплексном ионе
+1 = 1 х + 0 · 2 .
Отсюда х = +1.
Электронное строение валентных подуровней иона Cu+ отвечает конфигурации 3d104s04р0. Так как 3d-подуровень не содержит вакансий, то в образовании связей по донорно-акцепторному механизму (в качестве акцептора) со стороны Cu+ участвуют одна 4s- и одна 4p- орбитали, которые гибридизируются по типу sp. Такому типу гибридизации (см. табл. 1) соответствует линейное строение комплекса.
Пример 3. Определите тип гибридизации АО центрального иона и геометрическое строение комплекса [HgCl4]2–.
Р е ш е н и е
Электронная конфигурация центрального иона Hg2+ имеет вид: 5d106s06р0, а электронно-графическая схема может быть представлена следующим образом:
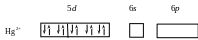


Х имическая
связь образуется по донорно-акцепторному
механизму, где каждый из четырех
лигандов-доноров (ионы Cl–)
предоставляет по одной неподеленной
паре электронов (пунктирные стрелки),
а комплексообразователь (ион Hg2+)
– свободные АО: одну 6s-
и три 6p-АО
имическая
связь образуется по донорно-акцепторному
механизму, где каждый из четырех
лигандов-доноров (ионы Cl–)
предоставляет по одной неподеленной
паре электронов (пунктирные стрелки),
а комплексообразователь (ион Hg2+)
– свободные АО: одну 6s-
и три 6p-АО
Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
Пример 4. Составьте энергетическую диаграмму образования связей в комплексе [Fe(CN)6]3– и укажите тип гибридизации орбиталей центрального атома. Какими магнитными свойствами обладает комплекс?
Р е ш е н и е
Электронная конфигурация центрального иона Fe3+: ... 3d 54s 0 4p0 4d0. Шесть монодентатных лигандов CN– создают сильное октаэдрическое поле и образуют шесть σ-связей, предоставляя неподеленные пары электронов атома углерода на свободные АО комплексообразователя Fe3+, при этом происходит снятие вырождения АО 3d-подуровня комплексообразователя. Энергетическая диаграмма комплекса имеет следующий вид:
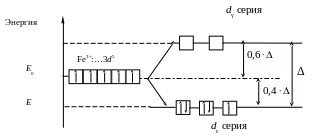
Пять 3d-электронов полностью распределяются на орбиталях 3dε серии, так как энергия расщепления, которая возникает при взаимодействии с лигандами сильного поля, оказывается достаточной для максимального спаривания электронов. Свободные 3d-, 4s- и 4р-орбитали подвергаются d2sp3-гибридизации и обусловливают октаэдрическую структуру комплекса. Комплекс является парамагнетиком, так как имеется один неспаренный электрон:
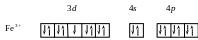
d 2 sp 3
Пример 5. Составьте энергетическую диаграмму образования связей в комплексе [CrF4]– и укажите тип гибридизации.
Р е ш е н и е
Электронная формула Cr3+: …3d 34s04p04d 0. Монодентатные лиганды F– образуют четыре σ-связи, являются лигандами слабого поля и создают тетраэдрическое поле:
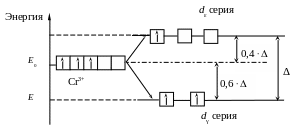
Свободные две 3d-, одна 4s- и одна 4р-АО комплексообразователя гибридизируются по типу d 2sp, в результате образуется парамагнитный комплекс тетраэдрической конфигурации.
Пример 6. Объясните, почему ион [CoF6]3– парамагнитный, а ион [Co(CN)6]3– – диамагнитный.
Р е ш е н и е
Электронная формула комплексообразователя Со3+: …3d 6. В октаэдрическом поле лигандов F– (лиганд слабого поля) происходит незначительное расщепление d-подуровня, поэтому электроны заполняют АО в соответствии с правилом Гунда (см. рис. 3). В этом случае имеется четыре непарных электрона, поэтому ион [CoF6]3– –парамагнитный. При образовании иона [Co(CN)6]3– с участием лиганда сильного поля (ион CN–) энергия расщепления d-подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. Электроны будут заполнять АО иона Со3+ с нарушением правила Гунда (см. рис. 4). В этом случае все электроны спарены, сам ион – диамагнитный.
Пример 7. Для иона [Cr(H2O)6]3+ энергия расщепления равна 167,2 кДж · моль–1. Какова окраска соединений хрома (III) в водных растворах?
Р е ш е н и е
Для определения окраски вещества определяем длину волны, при которой происходит поглощение света:
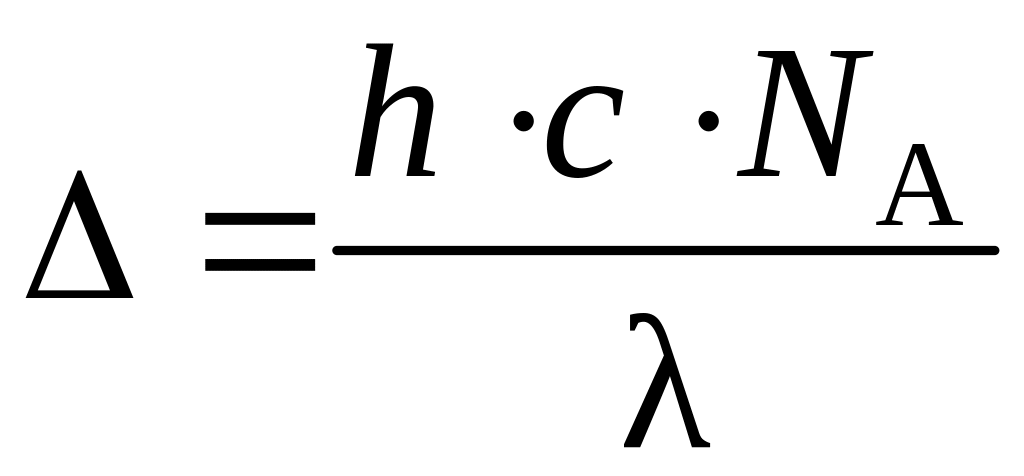
или
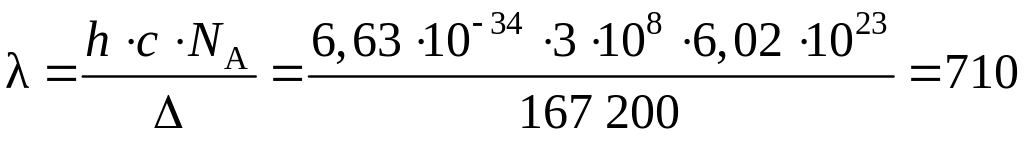 нм.
нм.
Таким образом, ион [Cr(H2O)6]3+ поглощает свет в красной части спектра, что соответствует окраске соединения хрома (III) зелёного цвета.
Пример 8. Установите, выпадет ли осадок сульфида серебра (I) при температуре 25 °С, если смешать равные объемы 0,001 М раствора [Ag(CN)2]–, содержащего одноименный лиганд CN– с концентрацией 0,12 моль/дм3, и раствора иона-осадителя S2–– с концентрацией 3,5 · 10–3 М.
Р е ш е н и е
Процесс диссоциации для данного иона можно представить схемой
[Ag(CN)2]– ↔ Ag+ + 2CN–,
а процесс осаждения можно записать так:
2Ag+ + S2– ↔ Ag2S.
Чтобы определить, будет ли образовываться осадок, необходимо рассчитать произведение растворимости сульфида серебра ПР(Ag2S) по формуле
![]() .
.
Для определения концентрации ионов серебра запишем выражение для константы нестойкости комплексного иона:
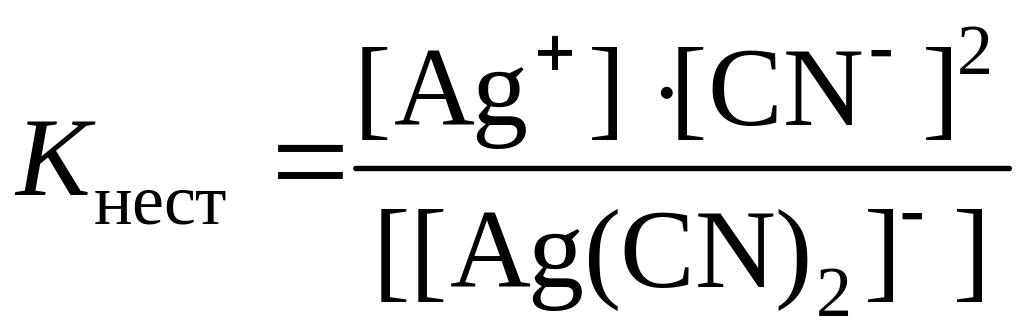 .
.
Отсюда
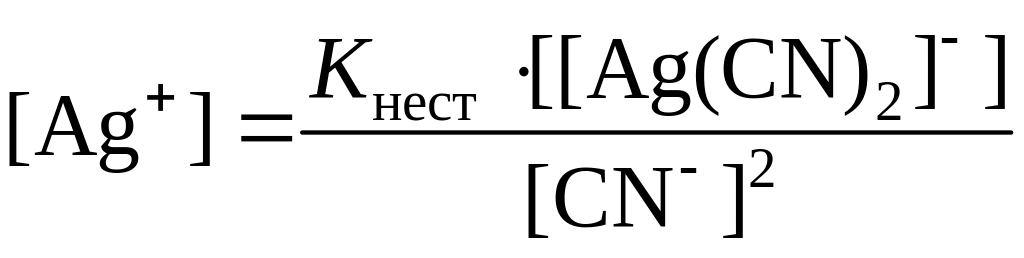 .
.
По справочнику выбираем значение константы нестойкости комплекса [Ag(CN)2]– (Kнест = 1·10-21). Тогда
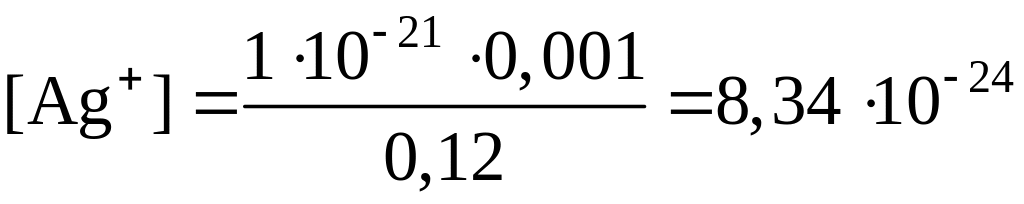 моль/дм3.
моль/дм3.
Рассчитаем произведение растворимости образующегося осадка
![]() .
.
По справочнику выбираем табличное значение произведения растворимости сульфида серебра [ПР(Ag2S)табл = 5,7 · 10–51] и сравниваем его с расчетным. Поскольку ПРтабл < ПРрасчет, то из данного раствора осадок выпадет, так как соблюдается условие выпадения осадка.
Пример 9. Вычислите концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0,3 моль/дм3 при избытке цианид-ионов в растворе, концентрация которого равна 0,01 моль/дм3.
Р е ш е н и е
Первичная диссоциация протекает практически полностью по схеме
Na2[Zn(CN)4] → 2Na2+ + [Zn(CN)4]2–
Вторичная диссоциация идет по уравнению
[Zn(CN)4]2– ↔ Zn2+ + 4CN–
Запишем для данного процесса выражение константы нестойкости
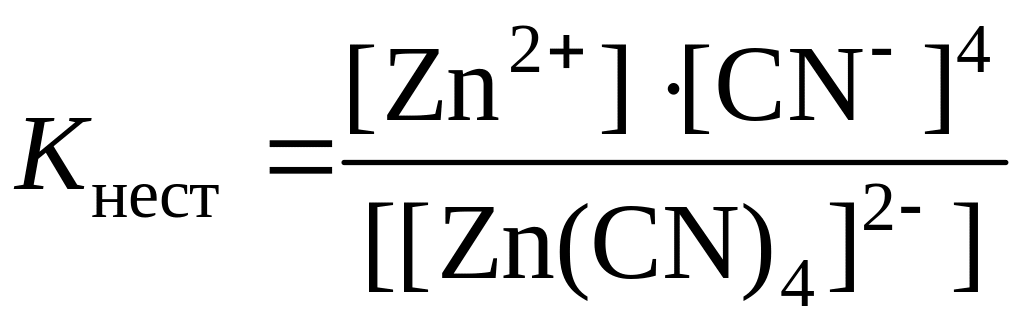 .
.
Отсюда
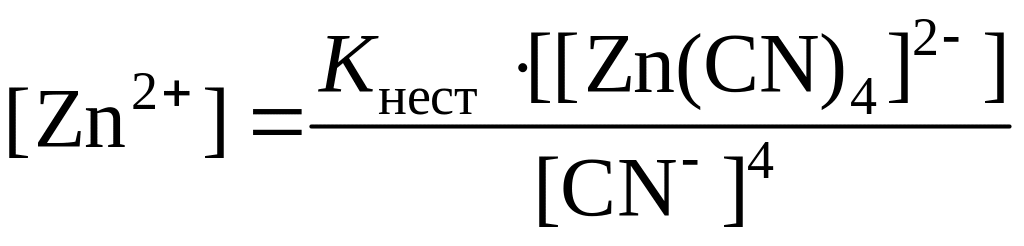 .
.
По справочнику находим значение константы нестойкости данного иона (Kнест = 1,3 · 10-17). Концентрация цианид-ионов, образующихся в результате диссоциации комплекса, гораздо меньше концентрации введенного избытка, и можно полагать, что [CN–] 0,01 моль/дм3, т. е. концентрацией ионов CN–, образующихся в результате диссоциации, можно пренебречь. Тогда
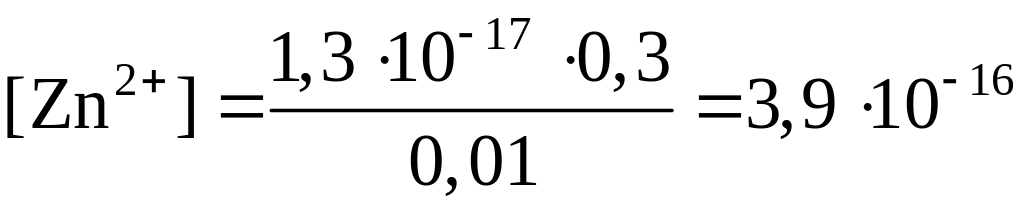 моль/дм3.
моль/дм3.
