
- •По дисциплине «химия»
- •Природа химической связи и ее характеристики
- •Разрыв связи в молекуле может быть осуществлен:
- •Находим объем, занимаемый 1 атомом хрома в кристаллической решетке
- •14. Произведите оценку длины связей в молекулах no и so, используя справочные данные о межъядерных расстояниях в простых веществах.
- •22. Оцените длины связей в молекулах ClO и co, используя справочные данные о межъядерных расстояниях в простых веществах.
- •Ковалентная связь. Гибридизация атомных орбиталей и геометрическая форма молекул
- •Из табл. 2 приложения находим эо атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность эо атомов
- •По графику, приведенному на рис. 1, определяем си связи. Си 5 %. Тогда
- •Метод молекулярных орбиталей
- •Ионная связь и межмолекулярные взаимодействия
- •Многовариантное задание
- •Исходные данные
- •Список литературы
- •Приложение
- •Значения длины связи
- •Относительная электроотрицательность некоторых элементов
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Ионные радиусы
- •Содержание
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общематематических и естественнонаучных дисциплин

Кафедра химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ТЕМЕ
«ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ»
По дисциплине «химия»
Учебно-методическое пособие
Череповец
2005
Методические указания к практическим занятиям по теме «Химическая связь и строение молекул» по дисциплине «Химия»: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2005. – 37 с.
Рассмотрено на заседании кафедры химии, протокол № 7 от 07.04.05.
Одобрено редакционно-издательской комиссией Факультета общематематических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 3 от 19.04.05.
Составители: О.А. Калько – канд. техн. наук, доцент; Ю.С. Кузнецова.
Рецензенты: Г.В. Козлова – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Т.А. Окунева (ГОУ ВПО ЧГУ)
Научный редактор: Г.В. Козлова – канд. хим. наук, доцент

© О.А. Калько, Ю.С. Кузнецова, 2005
© ГОУ ВПО Череповецкий государст-
венный университет, 2005
ВВЕДЕНИЕ
Данное учебно-методическое пособие включает в себя краткие теоретические сведения, примеры решения задач и варианты контрольных заданий по теме «Химическая связь и строение молекул» курса общей химии. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Химия» для химических и инженерно-технических специальностей.
Природа химической связи и ее характеристики
Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать взаимодействия, такие как водородная связь и вандерваальсовые силы.
Основными характеристиками химической связи являются ее энергия, длина и валентный угол.
Энергия
химической связи ЕА – В
(кДж/моль) – мера прочности связи, которая
определяется работой, необходимой для
разрушения данной связи, или энергией,
которая выделяется при образовании
связи из отдельных атомов. Чем больше
ЕА – В,
тем прочнее (устойчивее) частица. Для
двухатомных простых молекул типа А2
(например, Н2
или N2)
энергия связи равна энергии
атомизации молекулы
Еатом,
т. е. энергии, которая затрачивается на
распад 1 моль молекул типа А2
до атомарного состояния. Для многоатомных
молекул типа АВn
(например, СН4
или NH3)
принято говорить о средней
энергии связи
![]() ,
которая может быть определена по формуле
,
которая может быть определена по формуле
 ,
,![]() (1)
(1)
где
![]() -
энергия образования вещества, кДж/моль;
n
– число однотипных связей (обычно
совпадает с числом атомов В
в молекуле).
-
энергия образования вещества, кДж/моль;
n
– число однотипных связей (обычно
совпадает с числом атомов В
в молекуле).
Для расчета энергии одной связи необходимо (в кДж/моль) разделить на постоянную Авогадро NА.
Энергия химической связи может быть определена по положению границы между линейным и сплошным спектром молекулы. Эта граница характеризует минимальное количество энергии, необходимое для разрыва связи, то есть саму энергию связи. Энергия химической связи и длина волны света связаны между собой выражением
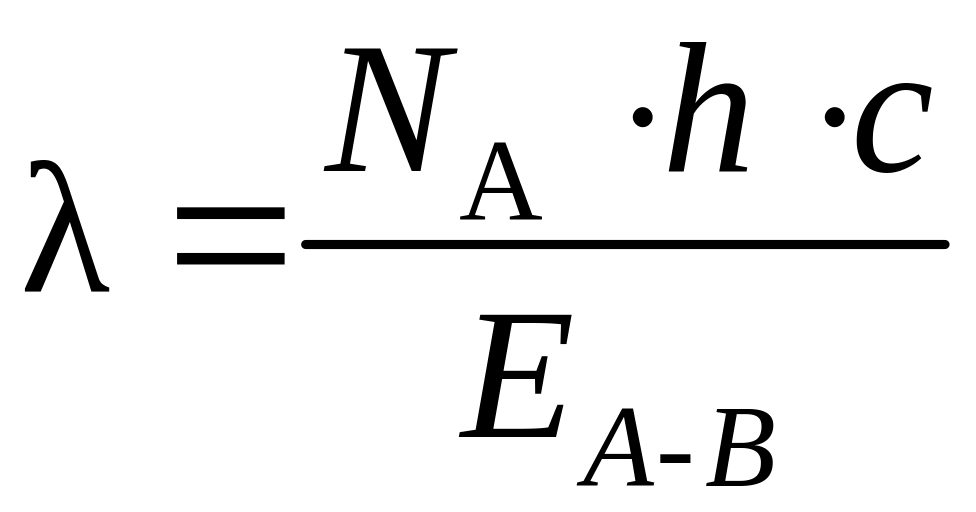 ,
(2)
,
(2)
где h – постоянная Планка; с – скорость света.
