
- •Часть 2
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Список литературы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(Для студентов заочной формы обучения)
Часть 2
Учебно-методическое пособие
Специальности: 240301 Химическая технология
неорганических веществ; 280201 Охрана окру-
жающей среды и рациональное использование
природных ресурсов; 240801 Машины и аппара-
ты химических производств
Череповец
2006
Примеры решения задач по дисциплине «Общая и неорганическая химия» для студентов заочной формы обучения: В 2 ч. Ч. 2: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2006. – 56 с.
Рассмотрено на заседании кафедры химии, протокол № 8 от 24.04. 06.
Одобрено редакционно-издательской комиссией факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 6 от 16.05. 06.
Составители: О.А. Калько – канд. техн. наук, доцент;
Н.В. Кунина;
Ю.С. Кузнецова
Рецензенты: Г.В. Козлова – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Л.Ю. Кудрявцева – канд. техн. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.В. Козлова – канд. хим. наук, доцент
© Калько О.А., Кунина Н.В.,
Кузнецова Ю.С., 2006
© ГОУ ВПО Череповецкий государст-
 венный
университет, 2006
венный
университет, 2006

ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по следующим разделам курса «Общая и неорганическая химия»: энергетика химических процессов; химическая кинетика и равновесие; комплексные соединения. Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства при выполнении домашних контрольных работ. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
Энергетика химических процессов Краткие теоретические сведения
Изучение энергетики химических процессов составляет основу химической термодинамики, объектом изучения которой является термодинамическая система – совокупность тел, мысленно выделенная из пространства, в которой возможен массо- и теплообмен между ее составными частями.
Состояние системы принято характеризовать термодинамическими параметрами (свойствами системы). При изменении хотя бы одного из параметров система переходит из начального состояния № 1 в конечное состояние № 2, т. е. совершает термодинамический процесс. Такие процессы бывают изобарические (протекают при условии постоянства давления, Р = const); изохорические (V = const); изотермические (T = const) и адиабатические (нет теплообмена с окружающей средой, т. е. q = 0).
Любая система обладает определенным запасом энергии, которую называют внутренней энергией U, Дж/моль. Внутренняя энергия включает в себя энергию движения и взаимодействия молекул, атомов, ядер и других частиц, внутриядерную и другие виды энергий, кроме кинетической энергии движения системы как целого и потенциальной энергии ее положения. Количественный учет всех составляющих внутренней энергии невозможен, поэтому пользуются величиной изменения внутренней энергии U.
Численное значение U не зависит от пути, которым осуществляли процесс. Величины, обладающие таким свойством, называют функциями состояния системы (ФСС).
Для процессов, протекающих в изолированных системах, т. е. системах, не обменивающихся с окружающей средой ни веществом, ни энергией, выполняется I закон термодинамики: вся сообщенная системе теплота q расходуется на увеличение внутренней энергии системы U и на совершение работы против внешних сил А.
q = U + А .
Положительной (А > 0) считается работа, совершаемая системой против внешних сил, а q > 0 в том случае, когда система поглощает тепло извне. Теплоту и работу называют функциями процесса, так как их значения зависят от способа проведения процесса.
Если на систему не действуют никакие другие силы, кроме постоянного внешнего давления, то при протекании химического процесса единственным видом работы является работа расширения А = Р V. В этом случае I закон термодинамики передается уравнением
qp = U + Р V = H ,
где qp – теплота изобарического процесса, Дж; H = H2 – H1 – изменение энтальпии, Дж или Дж/моль.
Величина H = U + Р V называется энтальпией и является ФСС.
Для изохорического процесса работа расширения системы равна нулю, следовательно, I закон термодинамики будет выражаться уравнением
qV = U,
где qV – теплота изохорического процесса, Дж или Дж/моль.
Для химических реакций U и H связаны между собой соотношением
U = H – n R T,
где
n
– изменение числа моль газообразных
веществ в реакции, моль; T
– температура,
К; R = 8,314
![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Химические реакции обычно сопровождаются выделением или поглощением тепла. Тепловым эффектом химической реакции Q называют количество теплоты, которое поглощается или выделяется при полном необратимом протекании реакции в изобарно-изотермических или изохорно-изотермических условиях. Если в результате реакции теплота выделяется во внешнюю среду, то Q считается положительным, а реакцию называют экзотермической. При протекании процесса с поглощением теплоты реакцию называют эндотермической, а Q < 0. Согласно принятой системе знаков,
Q = – q .
Тепловой эффект реакции, определенный в условиях Р, Т = const, обозначается QP, а в изохорно-изотермических – QV . Из I закона термодинамики следует:
QV = – qV = – U ; QP = – qp = – H .
Основным законом термохимии является закон Гесса: тепловой эффект химической реакции не зависит от пути ее протекания, т. е. числа и характера промежуточных стадий, а зависит только от природы и состояния исходных веществ и продуктов реакции.
Поясним закон Гесса на примере образования СО2, который может быть получен двумя способами:
I способ: С + О2 = СО2 + Q1 ;
II
способ: 1) С +
![]() О2
= СО + Q2
; 2) СО +
О2
= СО2
+ Q3
.
О2
= СО + Q2
; 2) СО +
О2
= СО2
+ Q3
.
Согласно закону Гесса, тепловые эффекты образования СО2 по I и II способам должны быть равны, т. е. Q1 = Q2 + Q3 .
Уравнение химической реакции, записанное с указанием его теплового эффекта, называется термохимическим уравнением. В таких уравнениях необходимо указывать фазовое состояние веществ (например: г – газовое, ж – жидкое, к – кристаллическое, т – твердое, р – растворенное и др.), кроме очевидных случаев; допускается введение дробных коэффициентов перед веществами; имеется возможность производить с уравнениями некоторые алгебраические операции (сложение, вычитание, деление или умножение на целое число).
В термохимических уравнениях тепловой эффект принято записывать либо непосредственно в уравнении реакции, например:
Н2, г + О2, г = Н2Ож + QP , кДж,
либо после уравнения, например:
Н2,
г +
О2,
г = Н2Ож
, Н
= – QP,
![]() .
.
Последняя форма записи употребляется чаще.
Тепловые
эффекты различных процессов определяют
при одинаковых условиях: давление равно
101 325 Па (1 атм), температура составляет
298 К. Такие условия называются стандартными,
а соответствующий им тепловой эффект
– стандартным
тепловым эффектом,
который
обозначают H![]() (или U
).
(или U
).
Из закона Гесса вытекает несколько важных следствий.
Следствие 1 (иначе закон Лавуазье – Лапласа). Теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части. Это означает, что, например, для реакций
СаСО3, т = СаОт + СО2, г, Н1;
СаОт + СО2, г = СаСО3, т, Н2
при T = const будет выполняться соотношение Н1 = –Н2 .
Следствие 2. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции общего вида a A + b B = d D + f F данное следствие имеет вид
Н
= d
Н![]() (D)
+ f
Н
(F)
– a
Н
(A)
– b
Н
(B),
(D)
+ f
Н
(F)
– a
Н
(A)
– b
Н
(B),
где Н – энтальпия образования вещества, т. е. Н реакции образования 1 моль данного вещества из простых веществ, Дж/моль.
Если
Н
вещества определена при стандартных
условиях, то ее называют стандартной
энтальпией образования вещества
и обозначают Н![]() .
Для большинства химических соединений
значения Н
.
Для большинства химических соединений
значения Н![]() приведены в справочной литературе, а
значения Н
простых веществ, устойчивых при
стандартных условиях, приняты равными
нулю.
приведены в справочной литературе, а
значения Н
простых веществ, устойчивых при
стандартных условиях, приняты равными
нулю.
Следствие 3. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Или математически для реакции вида a A + b B = d D + f F
Н
= a
Н![]() (A)
+ b
Н
(B)
– d
Н
(D)
– f
Н
(F),
(A)
+ b
Н
(B)
– d
Н
(D)
– f
Н
(F),
где
Н![]() – энтальпия
сгорания вещества,
т. е. Н
реакции окисления кислородом элементов,
входящих в состав вещества, до образования
высших оксидов, Дж/моль.
– энтальпия
сгорания вещества,
т. е. Н
реакции окисления кислородом элементов,
входящих в состав вещества, до образования
высших оксидов, Дж/моль.
Значения Н для многих веществ имеются в справочной литературе, а Н для высших оксидов равно нулю.
Большинство
процессов представляют собой два
одновременно происходящих явления:
передачу энергии и изменение в
упорядоченности расположения частиц
относительно друг друга. Мерой
неупорядоченности среди частиц в системе
служит ФСС, называемая энтропией
S,
![]() .
В отличие от других ФСС, можно определить
не только изменение энтропии S,
но и абсолютное значение энтропии. Для
большинства веществ абсолютные энтропии
в стандартных условиях S
.
В отличие от других ФСС, можно определить
не только изменение энтропии S,
но и абсолютное значение энтропии. Для
большинства веществ абсолютные энтропии
в стандартных условиях S![]() определены и приведены в справочниках.
определены и приведены в справочниках.
При переходе вещества из твердого состояния в жидкое и далее в газообразное значительно снижается упорядоченность частиц, поэтому
Sгаза >> Sж > Sтв .
При одинаковом агрегатном состоянии энтропия вещества тем выше, чем больше атомов содержится в молекуле. Например, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и 239 .
Переход вещества из одного агрегатного состояния в другое сопровождается изменением энтропии Sфп, которое можно оценить по формуле, Дж/К:
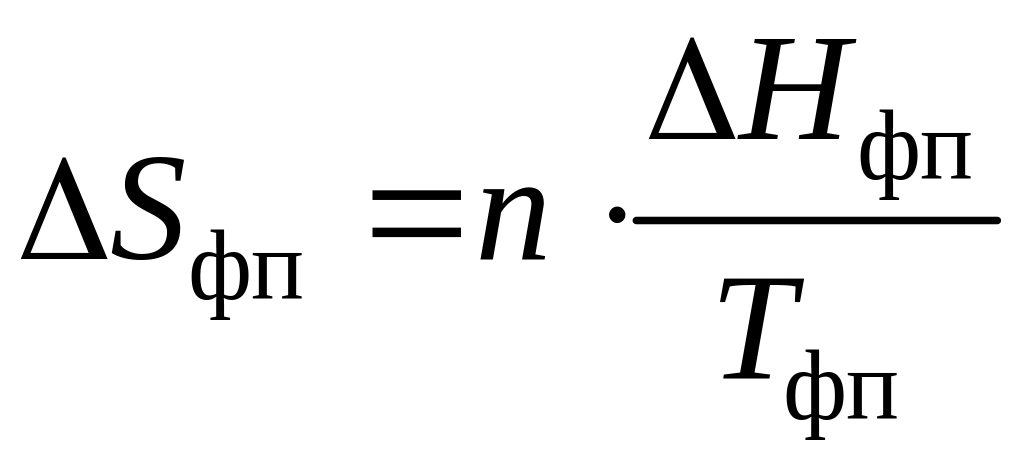 ,
,
где
![]() – тепловой эффект, которым сопровождается
данный фазовый переход, Дж/моль;
– тепловой эффект, которым сопровождается
данный фазовый переход, Дж/моль;
![]() – температура фазового перехода, К; n
– количество вещества, моль.
– температура фазового перехода, К; n
– количество вещества, моль.
Расчет S химической реакции осуществляют по формуле
S = d S (D) + f S (F) – a S (A) – b S (B).
Качественно об изменении энтропии можно судить по изменению объема системы в ходе реакции. Если объем системы увеличивается, то S > 0, а если реакция протекает с уменьшением объема, то S < 0.
Процессы, протекающие без подвода энергии от внешнего источника, называют самопроизвольными. Согласно второму закону термодинамики, в изолированной системе самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии. То есть, знак S является критерием направления самопроизвольного протекания процессов в изолированных системах:
1) если S > 0, то процесс идет в прямом направлении;
2) если S < 0, то направление протекания процессов – обратное;
3) если S = 0, изолированная система находится в состоянии равновесия.
В условиях Р, Т = const самопроизвольному протеканию процессов способствуют уменьшение энтальпии и рост энтропии системы. Первая тенденция характеризуется энтальпийным фактором и выражается через Н, а вторая – характеризуется энтропийным фактором и количественно выражается через T S . Совместное влияние энтальпийного и энтропийного факторов учитывает изменение энергии Гиббса G, кДж/моль:
G = Н – T S.
Самопроизвольно при Р, Т = const в прямом направлении могут протекать реакции, для которых G < 0. Если для реакции G > 0, то такой процесс может протекать самопроизвольно только в обратном направлении, а реакции, имеющие G = 0, находятся в состоянии равновесия, т. е. для них термодинамическая вероятность прямого и обратного течения процесса одинакова.
Направление химической реакции можно определять по сочетанию знаков энтальпийного и энтропийного факторов. Для экзотермических реакций (Н < 0), сопровождающихся возрастанием числа моль газообразных веществ (S > 0), при любой температуре G < 0. То есть независимо от температуры такие реакции могут протекать только в прямом направлении. Наоборот, эндотермические реакции (Н > 0), сопровождающиеся уменьшением числа моль газообразных веществ (S < 0), независимо от значения Т могут протекать только в обратном направлении, так как в этом случае G > 0.
При сочетании величин Н > 0 и S > 0 или Н < 0 и S < 0 вероятность протекания реакции в прямом направлении будет зависеть от температуры:
1)
при невысоких температурах
![]() ,
поэтому энтальпийный фактор вносит
больший вклад в значение G
и определяет его знак;
,
поэтому энтальпийный фактор вносит
больший вклад в значение G
и определяет его знак;
2)
при высоких температурах, когда
![]() ,
знак G
будет определяться знаком энтропийного
фактора.
,
знак G
будет определяться знаком энтропийного
фактора.
Расчет изменения энергии Гиббса в стандартных условиях G для реакции вида a A + b B = d D + f F можно осуществить либо по уравнению
G = Н – Т S ,
либо по формуле
G = d G (D) + f G (F) – a G (A) – b G (B),
где G – стандартная энергия Гиббса образования вещества, кДж/моль.
Значения G для простых веществ равны нулю, а для сложных – содержатся в справочной литературе.
