
- •Часть 2
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Список литературы
Примеры решения задач
Пример 1. При постоянном давлении 1,01 105 Па газ расширили от объема 1 10–2 м3 до объема 1,6 10–2 м3, при этом система поглотила 125,6 Дж тепла. Вычислите изменение внутренней энергии в данном процессе.
Р е ш е н и е
Вычисляем работу расширения системы:
А = Р V = 1,01 105 Па (1,6 10-2 – 1 10-2) м3 = 606 Дж.
Используем первый закон термодинамики:
U = q – A = 125,6 – 606 = – 480,4 Дж .
Пример 2. Рассчитайте U при испарении 100 г воды при 20 С, если на испарение 1 г воды расходуется 2,4 кДж тепла. Пар считать идеальным газом, а объемом жидкой воды пренебречь.
Р е ш е н и е
Вычисляем количество теплоты, необходимое для испарения 100 г воды:
q = 100 г 2,4 кДж/г = 240 кДж = 240 000 Дж.
При испарении жидкости Р, Т = const, поэтому работу расширения системы можно определить, используя закон Менделеева – Клапейрона:
A
= Р
(Vпара
– Vжид )
Р
Vпара
=
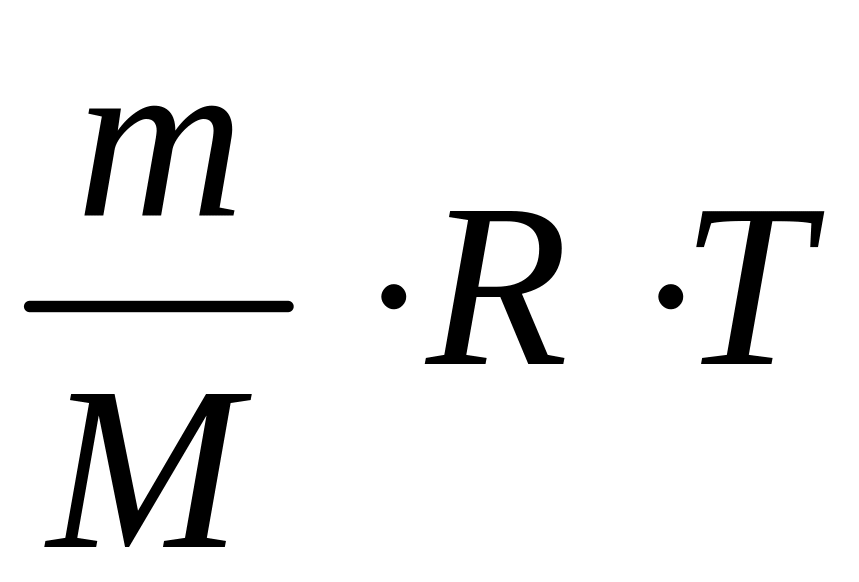 =
=
=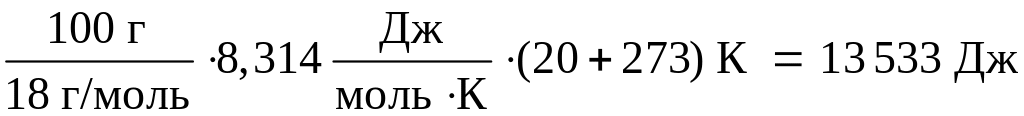 .
.
Тогда U = q – A = 240 000 – 13 533 = 226 467 Дж = 226,5 кДж.
Пример 3. Определите U реакции 2 Cl2, газ + 2 Н2Ожид = = 4 НСlгаз + О2, газ при 298 К, если Н298 реакции равно 114,5 кДж.
Р е ш е н и е
Вычисляем изменение числа моль газов в данной реакции:
![]() моль.
моль.
Число моль воды не учитываем, так как это вещество не является газом. Тогда изменение внутренней энергии реакции составит
U = H – n R T = 114 500 Дж –
– 3 моль 8,314 298 К = 107 067 Дж.
Пример 4. Вычислите H реакции
СН4, г + Cl2, г = СH3Cl г + НCl г ,
используя следующие термохимические уравнения:
СН4, г + 2О2, г = СО2, г + 2Н2О ж, H = – 892,0 кДж;
2СН3Cl г + 3О2, г = 2СО2, г + 2Н2О ж + 2HCl г , H = –1374 кДж;
2Н2,г + О2, г = 2Н2О ж , H = – 571,7 кДж;
Н2, г + Сl2, г = 2НСl г , H = –185,0 кДж .
Р е ш е н и е
Из предлагаемого набора термохимических уравнений попытаемся получить уравнение, тепловой эффект которого нужно найти. Для этого необходимо сложить уравнения реакций 1 и 4 и вычесть из этой суммы уравнения реакций 2 и 3, причем в реакциях 2 и 3 коэффициенты перед веществами следует уменьшить вдвое. То есть требуется провести алгебраические действия, отвечающие схеме
(1) + (4) – (2) – (3) .
Проверим данную гипотезу:
СН4, г + 2О2, г + Н2, г + Сl2, г – СН3Cl г – 1,5О2, г – Н2, г – 0,5О2, г =
= СО2, г + 2Н2Ож + 2НСlг – СО2, г – Н2Ож – HCl г – Н2О ж .
После сокращения подобных членов и смены знаков перед веществами с минуса на плюс путем переноса их из одной части уравнения в другую получим искомое уравнение
СН4, г + Cl2, г = СH3Cl г + НCl г.
Произведя аналогичные действия с тепловыми эффектами реакций, получим требуемый тепловой эффект
H = H (1) + H (4) – H (2) – H (3) =
= – 892, 0 – 185,0 + 1374 + 571,7 = – 104,2 кДж .
Пример
5. Вычислите
Н![]() (N2O),
если Н
(СО2)
=
= –393,5 кДж/моль, а Н
реакции Сграфит
+ 2N2O
= CO2
+ 2N2
равно –575,5 кДж.
(N2O),
если Н
(СО2)
=
= –393,5 кДж/моль, а Н
реакции Сграфит
+ 2N2O
= CO2
+ 2N2
равно –575,5 кДж.
Р е ш е н и е
Используем второе следствие закона Гесса:
Н![]() = Н
(СО2)
+ 2Н
(N2)
– Н
(С графит)
–
– 2Н
(N2O)
= Н
(СО2)
+ 2Н
(N2)
– Н
(С графит)
–
– 2Н
(N2O)
или
Н = Н (СО2) – 2Н (N2O),
так как стандартные энтальпии образования простых веществ N2 и С графит равны нулю. Выразим Н (N2O):
Н
(N2O)
=
[Н
(СО2)
– Н
]
=
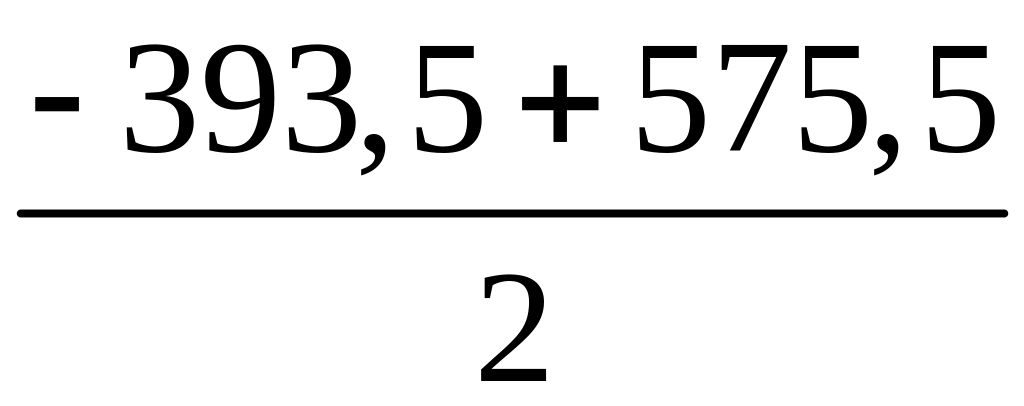 =
= 91 кДж/моль.
=
= 91 кДж/моль.
Пример 6. При взаимодействии 2,1 г железа с серой выделилось 3,77 кДж тепла. Определите энтальпию образования сульфида железа (FeS).
Р е ш е н и е
Запишем уравнение химической реакции получения сульфида железа из простых веществ
Fe + S = FeS .
Н (FeS) – это тепловой эффект данной реакции в расчете на 1 моль сульфида железа (II). Учитывая, что при выделении системой тепла в окружающую среду Н отрицательно, можно составить пропорцию:
2,1 г Fe соответствует –3,77 кДж ,
55,8
г (1 моль Fe)
соответствует Н![]() (FeS)
.
(FeS)
.
Тогда
Н
(FeS)
= –
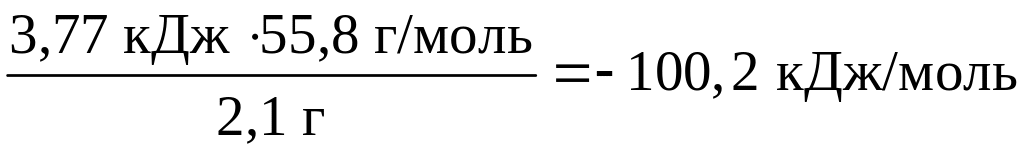 .
.
Пример 7. Вычислите Н реакции 3Fe2O3, т + СО г = 2Fe3O4, т + + СО2, г .
Р е ш е н и е
Согласно второму следствию закона Гесса,
Н = Н (СО2, г) + 2Н (Fe3O4, т) – 3Н (Fe2O3, т) – – Н (СOг).
Тогда, используя справочные данные о стандартных энтальпиях, получим
Н = –393,5 – 2 1120 + 3 825 + 110,5 = – 48,0 кДж.
Пример 8. Вычислите Н реакции 2Сграфит + О2 = 2СО в стандартных условиях, используя данные об энтальпиях сгорания веществ.
Р е ш е н и е
По третьему следствию закона Гесса, используя данные справочника, имеем
Н = 2Н (Сгр) + Н (O2) – 2Н (СO) =
= 2(–397,8) + 0 – 2(–287,2) = –219,8 кДж.
Пример 9. Не производя расчеты, укажите знак S для реакции
2С графит + Н2, г = С2Н2, г.
Сопоставьте вывод с результатами расчетов, если S участников реакции равны: Н2 – 130,5; Сграфит – 5,7; С2Н2 – 200,8 .
Р е ш е н и е
Данная реакция протекает без изменения числа моль газов (в исходных веществах – 1 моль и в продуктах – 1 моль). Однако число атомов в молекуле С2Н2 больше числа атомов в молекуле Н2, т. е. энтропия продукта больше энтропии исходных веществ, поэтому ожидаем, что S > 0.
Вычислим изменение энтропии в стандартных условиях
S = S (С2Н2) – S (H2) – 2S (Cграфит) =
= 200,8 – 130,5 – 2 (–5,7) = 58,9 Дж/К.
По результатам расчета получили также S > 0.
Пример 10. Определите изменение энтропии при конденсации 36 г водяного пара, если Н при испарении 1 моль воды равно 40,9 кДж.
Р е ш е н и е
При испарении вода из жидкого состояния переходит в газообразное. Конденсация – процесс обратный испарению, поэтому Ниспарения = –Нконд . Данные фазовые переходы протекают при температуре кипения воды, равной 373 К (100 С). Тогда
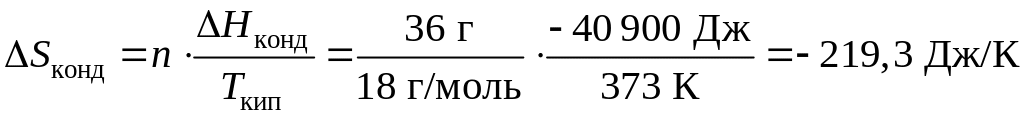 .
.
Пример 11. Вычислите G реакции 2SO2 + О2 = 2SО3 двумя способами. Определите, в каком направлении протекает данная реакция в изолированной системе и в изобарно-изотермических условиях.
Р е ш е н и е
Вычисляем G , используя справочные данные о G :
G = 2 G (SO3) – 2 G (SO2) – G (O2) =
= 2(–371,17) – 2(–300,21) – 0 = –141,92 кДж.
Вычисляем G , используя справочные данные о Н и S веществ:
S = 2S (SO3) – S (O2) – 2S (SO2) =
= 2 256,7 – 205,0 –2 248,1 = –187,8 Дж/К;
Н = 2Н (SО3) – 2Н (SO2) = 2(–395,9) – 2(–296,9) =
= –198,0 кДж.
Тогда
G = Н – Т S = –198 000 – 298 (–187,8) = –142 036 Дж =
= –142,0 кДж.
В изолированной системе направление самопроизвольного течения реакции определяем по знаку S реакции. В данном случае S < 0, значит, реакция идет в обратном направлении.
В условиях Р, Т = const критерием направления реакции является знак G . Для данного процесса G < 0, тогда реакция идет самопроизвольно в прямом направлении.
Пример 12. Не прибегая к расчетам, определите, действием какого фактора, энтальпийного или энтропийного, определяется знак G реакции
СаОт + СО2, г = СаСО3, т ; Н = –178,1 кДж/моль.
Р е ш е н и е
Данная
реакция – экзотермическая, так как Н
< 0. Она протекает с уменьшением числа
моль газообразных веществ (![]() моль),
следовательно, S
<0.
При невысоких температурах
,
тогда знак G
определяется действием энтальпийного
фактора (G
< 0).
При высоких температурах
,
следовательно, знак G
определяется действием энтропийного
фактора (G
> 0).
моль),
следовательно, S
<0.
При невысоких температурах
,
тогда знак G
определяется действием энтальпийного
фактора (G
< 0).
При высоких температурах
,
следовательно, знак G
определяется действием энтропийного
фактора (G
> 0).
Пример 13. Определите температуру равновероятного протекания реакции в прямом и обратном направлениях, если Н = –235 кДж, а S = –95 Дж/К.
Р е ш е н и е
При равновероятном протекании реакции в прямом и обратном направлении G = 0. Тогда Н – T S = 0. Отсюда
T
=
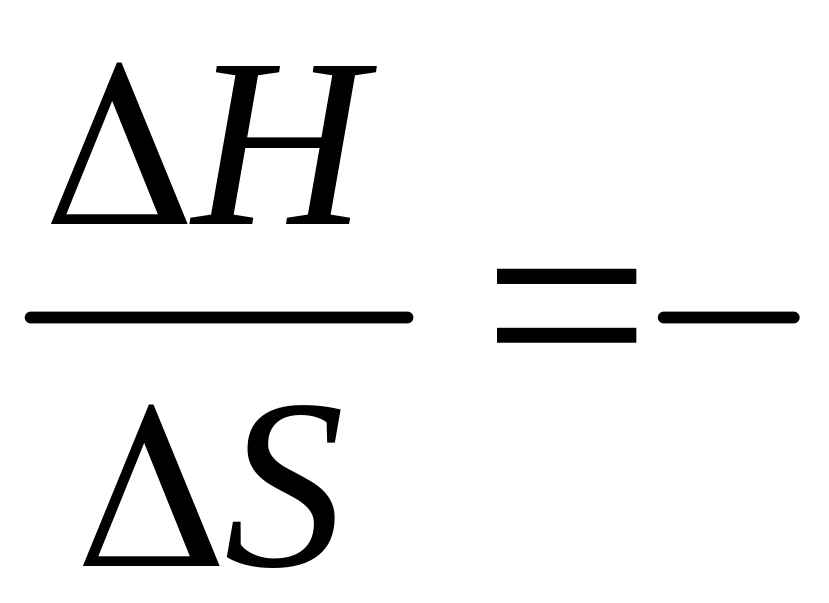
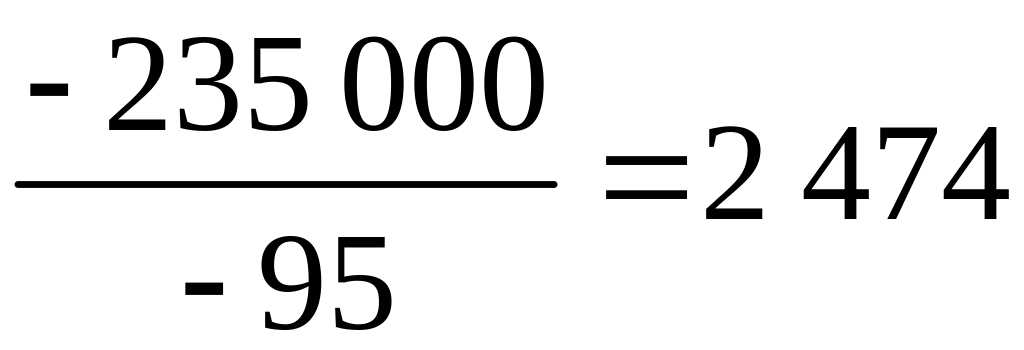 К.
К.
