
- •Часть 2
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Список литературы
Химическая кинетика и равновесие Краткие теоретические сведения
Химическая кинетика изучает механизмы и скорости протекания химических реакций. В зависимости от типа системы различают гомогенные реакции (протекают с одинаковой скоростью по всему объему) и гетерогенные реакции (идут на поверхности раздела фаз, так как только там имеется физический контакт между веществами).
Скорость
реакции в данный момент времени, иначе
мгновенная
скорость реакции
,
равна,
![]() :
:
=
![]() ,
,
где dС – дифференциально-малое изменение концентрации за дифференциально-малый промежуток времени d; знак минус относится к концентрации исходного вещества, а знак плюс – к концентрации продукта.
В ходе реакции нет необходимости следить за концентрациями всех участников реакции, так как стехиометрическое уравнение устанавливает соотношение между концентрациями всех реагентов. Так, для гомогенной реакции общего вида аА + bВ dD + mM скорости изменения концентраций реагентов связаны между собой соотношением
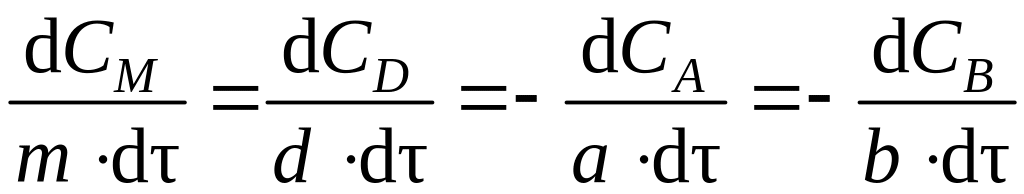 .
.
Скорость реакции зависит от природы взаимодействующих веществ, концентраций реагентов, температуры, присутствия в системе катализатора и др. Зависимость скорости реакции от концентраций реагентов устанавливает основной закон химической кинетики: при постоянной температуре мгновенная скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях частных порядков реакции.
Математическая запись закона для гомогенной реакции общего вида (иначе кинетическое уравнение реакции) будет отражаться уравнением
=
k
[А]![]()
[В]
[В]![]() ,
,
где k – константа скорости реакции; [А], [В] – концентрации реагентов, моль/дм3; nА, nВ – порядок реакции соответственно по веществу А и по веществу В.
Для гетерогенных систем в кинетическое уравнение реакции не включают концентрации твердых реагентов, так как в ходе процесса они практически не изменяются и учтены в k.
Константа скорости реакции зависит от тех же факторов, что и , кроме концентраций веществ. k численно равна скорости реакции, когда концентрации реагентов одинаковые и равны 1 моль/дм3. Единицы измерения k зависят от порядка реакции.
Порядком реакции n называют сумму показателей степеней при концентрациях в кинетическом уравнении реакции. Так, для реакции общего вида порядок реакции n = nА + nВ .
По механизму взаимодействия реакции делят на простые и сложные. Простые – это реакции, протекающие необратимо в одну стадию, при этом уравнение реакции полностью отражает механизм взаимодействия веществ. Все остальные реакции являются сложными. Для простых реакций n равен сумме стехиометрических коэффициентов в уравнении реакции. Например, если реакция аА + bВ продукты – простая, то кинетическое уравнение данной реакции имеет вид
= k [А]а [В]b,
а порядок реакции n = а + b. Для простых реакций основной закон химической кинетики называется законом действующих масс.
Все гетерогенные и многие гомогенные реакции являются сложными. В этом случае закон действующих масс выполняется для каждой стадии отдельно, а общая скорость процесса будет равна наиболее медленной стадии, которую называют лимитирующей.
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на 10 К скорость большинства реакций увеличивается в 24 раза:
2
= 1![]() ,
,
где 1, 2 – скорости реакции при температурах Т1 и Т2; – температурный коэффициент Вант-Гоффа, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 К.
Для многих реакций в интервале температур от комнатных значений до 400 С температурный коэффициент лежит в пределах от 2 до 4. Более точно значение можно вычислить по формуле
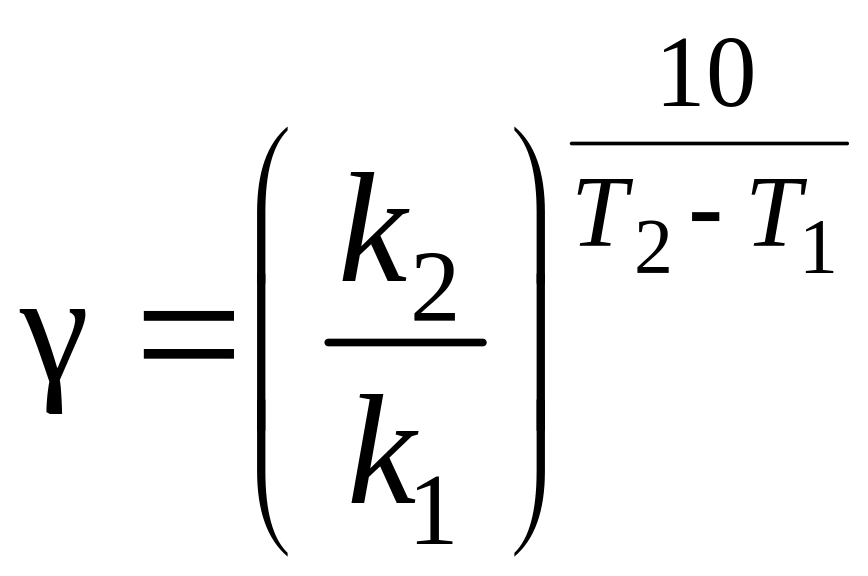 ,
,
где k1, k2 – константы скорости реакции при температурах Т1 и Т2.
Более строгая зависимость скорости реакции от температуры описывается уравнением Аррениуса
k
= k0
![]() ,
,
где k – константа скорости реакции при температуре Т; k0 – предэкспоненциальный множитель; е – основание натурального логарифма; ЕА – энергия активации, Дж/моль.
Энергией активации называют избыток энергии, которым должны обладать молекулы, по сравнению со средним значением энергии частиц в системе, чтобы их столкновение привело к образованию продуктов реакции. Значение энергии активации зависит от природы реагирующих веществ. Для химических реакций значения ЕА лежат в пределах 40400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по формуле
ЕА
=
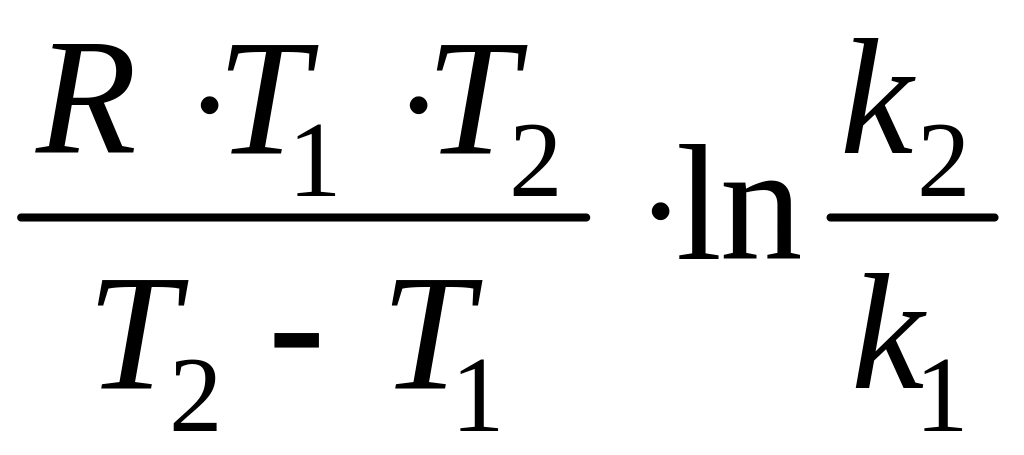 .
.
Реакции,
которые могут одновременно протекать
в прямом и обратном направлениях,
называются обратимыми.
Состояние системы, при которой скорость
прямой реакции
![]() равна скорости обратной реакции
равна скорости обратной реакции
![]() ,
называется химическим
равновесием.
Для гомогенной реакции вида аА
+ вВ
dD
+ mM,
находящейся в состоянии равновесия,
будет выполняться соотношение
,
называется химическим
равновесием.
Для гомогенной реакции вида аА
+ вВ
dD
+ mM,
находящейся в состоянии равновесия,
будет выполняться соотношение
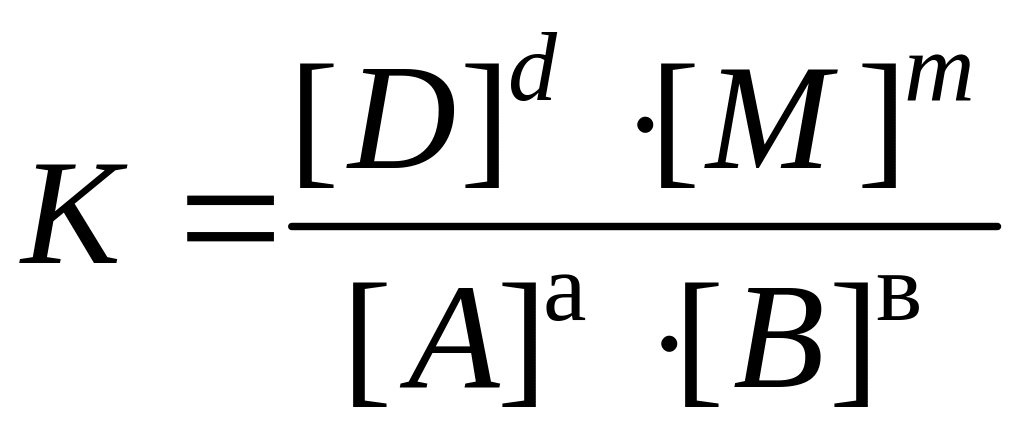 ,
,
где [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации, моль/дм3; K – константа химического равновесия.
Это уравнение является вариантом математической записи закона действующих масс для химического равновесия: при постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов РА, РВ, РD и РM, тогда закон действующих масс пример вид
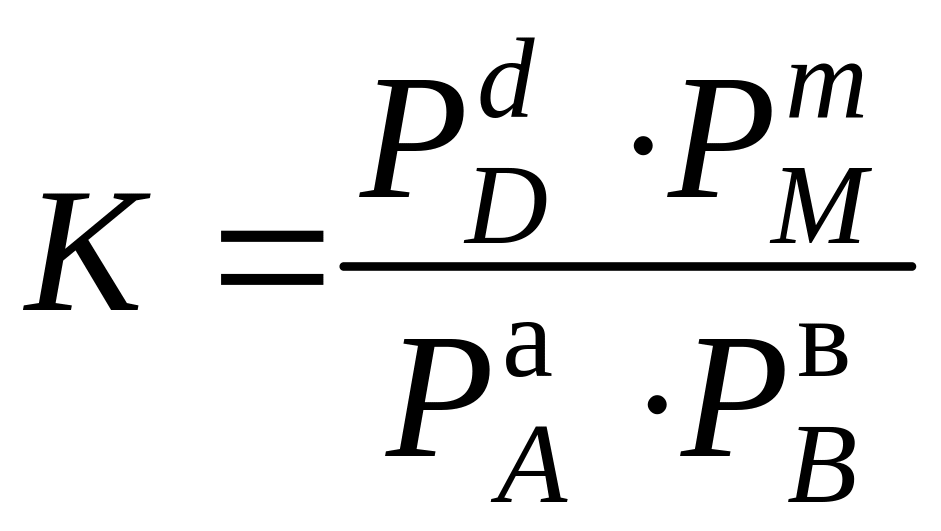 .
.
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции
Сграфит + 2Н2Огаз СО2, газ + 2Н2, газ
константа равновесия выражается уравнением
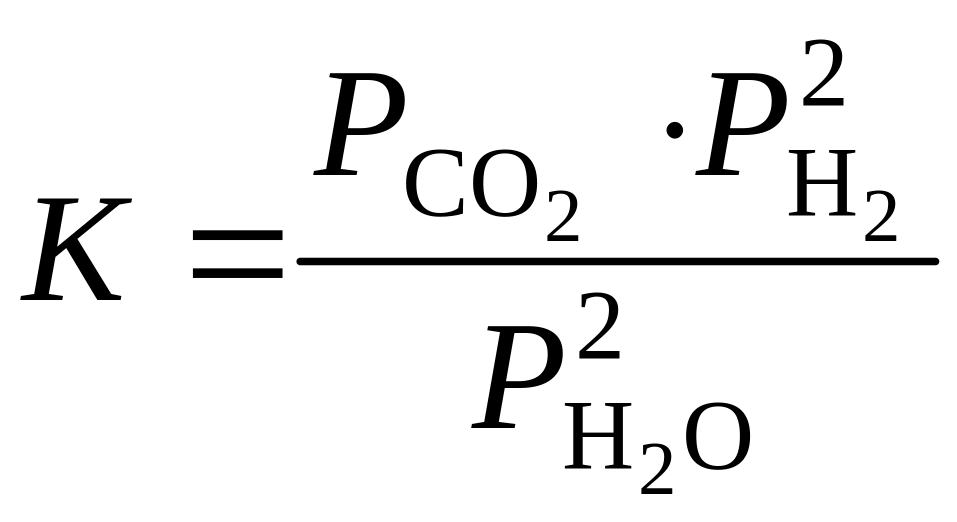 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на K определяется знаком теплового эффекта реакции. Для эндотермической реакции (Н > 0) при повышении Т константа равновесия увеличивается. И наоборот, для экзотермической реакции (Н < 0) при возрастании температуры значения K уменьшается.
В целях более полного превращения исходных веществ в продукты, довольно часто возникает необходимость смещения равновесия в сторону прямой реакции.
При изменении условий проведения реакции смещение химического равновесия в сторону прямой или обратной реакции происходит в соответствии с принципом Ле Шателье: если в равновесной смеси изменить концентрацию одного из реагирующих веществ, температуру или давление, то равновесие смещается в направлении той реакции (прямой или обратной), которая ослабляет эффект от данного воздействия на равновесную систему.
Влияние концентраций (парциальных давлений) компонентов на сдвиг равновесия. При повышении концентрации исходного вещества ускоряется прямая реакция, что приводит к росту концентраций продуктов и уменьшению концентраций исходных веществ, т. е. к смещению равновесия в сторону прямой реакции (вправо). И наоборот, при увеличении концентрации продукта реакции равновесие смещается в сторону обратного процесса (влево). Для гетерогенного равновесия изменение концентраций твердых фаз не влияет на сдвиг равновесия.
Влияние температуры на сдвиг равновесия. С увеличением температуры равновесие смещается в сторону того процесса, который идет с поглощением тепла, т. е. в сторону эндотермической реакции.
Влияние общего давления на сдвиг равновесия. Изменение общего давления влияет на равновесие только для тех реакций, которые протекают с изменением числа моль газообразных веществ. В соответствии с принципом Ле Шателье увеличение общего давления в системе смещает равновесие в том направлении, в котором происходит уменьшение числа моль газов.
