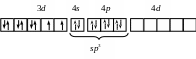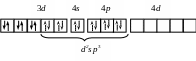- •Часть 2
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Список литературы
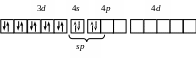
Типы гибридизаций и геометрические конфигурации некоторых комплексов
Тип гибридизации АО |
Комплекс и электронная структура центрального атома |
Структура внешних электронных оболочек комплексообразователя |
Геометри-ческая структура и магнитные свойства комплекса |
sp |
[Cu(NH3)2]+
Cu+ ...3d104s0 |
|
Линейная Диамагнетик |
sp3 |
[NiCl4]2–
Ni2+:..3d 8 |
|
Тетраэдри-ческая Парамагнетик |
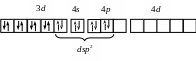
dsp2 |
[Ni(CN)4]2–
Ni2+ …3d 8 |
|
Квадратная Диамагнетик |
d2sp3 |
[Co(NH3)6]3+
Со3+ …3d 6 |
|
Октаэдри-ческая Диамагнетик |
sp3d2 |
[CoF6]3–
Со3+ …3d 6 |
|
Октаэдри-ческая Парамагнетик |
МВС не всегда может объяснить пространственное строение и магнитные свойства комплексов. Например, он не объясняет причин, вызывающих спаривание электронов в ионах [Ni(CN)4]2– и [Co(NН3)6]3–, т. е. нарушение правила Гунда при распределении электронов по d-АО.
ТПЛ дополняет МВС. Согласно ТПЛ, лиганды – заряженные точки, а комплексообразователь рассматривается с детальным учетом его электронной структуры.
В
свободном атоме или ионе АО любого
d-подуровня
пятикратно вырождены, т.е. все пять АО
имеют одинаковую энергию. Если такую
частицу поместить в центре ориентированных
особым образом лигандов, то под действием
их электростатического поля энергия
АО d-подуровня
комплексообразователя изменится. Вне
зависимости от числа и расположения
лигандов вокруг центрального иона АО
d-подуровня
расщепляются на две группы новых
орбиталей: d
серию, образованную dxy,
dxz,
dyz
электронными облаками, и d
серию, содержащую атомные орбитали d![]() и d
и d![]() .
.
В октаэдрическом поле лигандов (КЧ = 6) электроны d серии испытывают более сильное отталкивание со стороны лигандов, чем электроны dε серии, поэтому энергия dсерии более высокая (рис. 1).
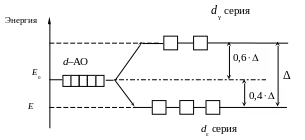

Рис. 1. Расщепление d-АО в октаэдрическом поле лигандов
В тетраэдрическом поле лигандов (КЧ = 4) d-подуровень расщепляется по отношению к октаэдрическому полю в обратном порядке (рис. 2).
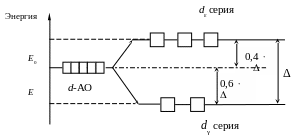
Рис. 2. Расщепление d-АО в тетраэдрическом поле лигандов
Сумма
энергий АО d
и dε
серий, согласно закону сохранения
энергии, равна начальному значению
энергии Е0
вырожденных орбиталей. Разность между
энергиями новых подуровней
![]() называют энергией
(иначе
параметром)
расщепления.
Величина энергии расщепления для данного
комплексообразователя определяется
природой лиганда.
называют энергией
(иначе
параметром)
расщепления.
Величина энергии расщепления для данного
комплексообразователя определяется
природой лиганда.
Для 3d-элементов экспериментально установлен так называемый спектрохимический ряд, в котором слева направо численное значение Δ монотонно возрастает:
I– < Br– < –SCN– < Cl– < NO < F– < OH– < –ONO– < C2O < H2O <
< –NCS– < gly < py < H– < NH3 < Еn < –NC– < NO < CN– < CO
(подчеркнут атом, непосредственно связанный с комплексообразователем).
Лиганды левой части ряда (лиганды слабого поля) вызывают незначительное расщепление энергии d‑подуровня. В этом случае величина Δ не превышает энергию взаимного отталкивания спаренных электронов, что приводит к заполнению АО электронами в соответствии с правилом Гунда (рис. 3).
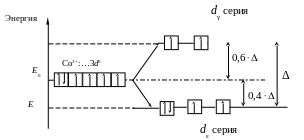


Рис. 3. Распределение электронов d-подуровня в ионе Co3+ при
октаэдрическом расположении лигандов слабого поля
Л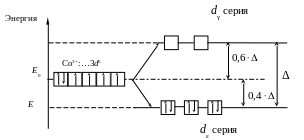 иганды
правой части ряда (лиганды
сильного поля)
приводят к значительному расщеплению
энергии d-подуровня,
при этом величина Δ превышает энергию
межэлектронного отталкивания спаренных
электронов. Это означает, что энергетически
более выгодно заполнять электронами
АО с нарушением правила Гунда. Например,
в случае октаэдрического расположения
лигандов сильного поля электроны будут
заполнять АО сначала по одному, а затем
по второму dε
серию, а
затем
в таком же порядке dγ
серию (рис. 4). Для тетраэдрического поля
порядок будет обратный.
иганды
правой части ряда (лиганды
сильного поля)
приводят к значительному расщеплению
энергии d-подуровня,
при этом величина Δ превышает энергию
межэлектронного отталкивания спаренных
электронов. Это означает, что энергетически
более выгодно заполнять электронами
АО с нарушением правила Гунда. Например,
в случае октаэдрического расположения
лигандов сильного поля электроны будут
заполнять АО сначала по одному, а затем
по второму dε
серию, а
затем
в таком же порядке dγ
серию (рис. 4). Для тетраэдрического поля
порядок будет обратный.
Рис. 4. Распределение электронов d-подуровня в ионе Co3+ при
октаэдрическом расположении лигандов сильного поля
ТПЛ так же, как и МВС, позволяет объяснять магнитные свойства комплексов: при наличии неспаренных электронов комплекс парамагнитен, а при их отсутствии – диамагнитен.
Если на dγ-подуровне в случае октаэдрического поля лигандов (или на dε-подуровне для тетраэдрического поля) есть вакантная (свободная) АО, то при поглощении комплексным ионом кванта света возможен переход электрона с нижнего энергетического подуровня на верхний. Такого рода переходы определяют наличие окраски у КС, так как энергия поглощаемого кванта света равна энергии расщепления. В расчете на 1 моль поглощающего вещества справедливо соотношение (Дж/моль)
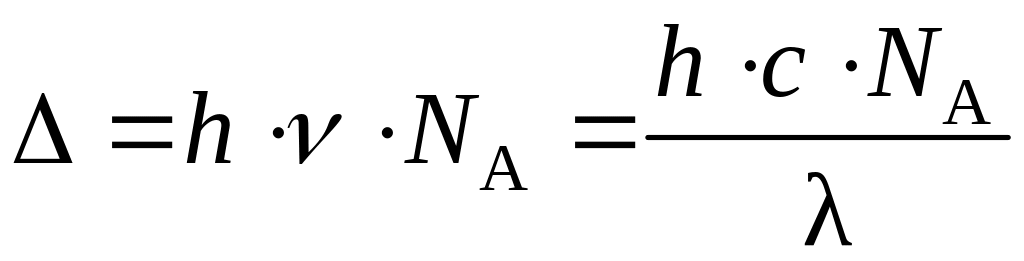 ,
,
где h – постоянная Планка (h = 6,63 10–34 Дж с); с – скорость света (с = 3 108 м/с); NА – постоянная Авогадро (NА = 6, 02 1023 моль–1); – длина волны поглощаемого света, м.
При поглощении света с длиной волны определённой части спектра, вещество оказывается окрашенным в соответствующий цвет. При замене в комплексе одних лигандов на другие, обладающие большей силой поля, значение Δ возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это изменяет его окрас-ку. Например, у комплексов меди (II) при переходе от [CuCl4]2+ к [Cu(H2O)4]4+ и к [Cu(NH3)4]2+ цвет изменяется от зелёного через голубой на сине-фиолетовый.
При характеристике устойчивости комплексов используют такие понятия, как «устойчивость» и «инертность» или «неустойчивость» и «лабильность». Устойчивость комплекса является его термодинамической характеристикой и связана с энергиями образующихся связей и с изменением энтропии при комплексообразовании. Инертность и, наоборот, лабильность комплекса являются его кинетическими характеристиками, зависящими от скоростей замещения его лигандов. Устойчивые комплексы могут быть инертными и лабильными. Например, ионы [Cr(H2O)6]3+ и [Fe(H2O)6]3+ имеют близкие значения энергии связи, т.е. обладают почти одинаковой устойчивостью, но первый комплекс инертен и обменивает лиганды медленно, а второй – лабилен, так как обменивает лиганды быстро. Неустойчивые комплексы чаще всего являются лабильными.
При растворении в воде КС, имеющие внешнюю сферу, диссоциируют как сильные электролиты с образованием комплексного иона, состоящего из частиц внутренней сферы, и ионов внешней сферы. Этот процесс называется первичной диссоциацией. Например:
К4[Fe(CN)6] 4К+ + [Fe(CN)6]4–
Наряду с этим процессом, как правило, протекает обратимая ступенчатая диссоциация внутренней сферы, которую называют вторичной диссоциацией. Так, для иона [Fe(CN)6]4– этот процесс идет по следующим ступеням:
первая ступень – [Fe(CN)6]4– ↔ CN– + [Fe(CN)5]3–;
вторая ступень – [Fe(CN)5]3– ↔ CN– + [Fe(CN)4]2– и т.д.
Количественной характеристикой прочности комплексного иона является константа равновесия процесса вторичной диссоциации, которую называют константой нестойкости Кнест. Например, для иона [Fe(CN)6]4– константы нестойкости первой и второй ступеней выражаются уравнениями:
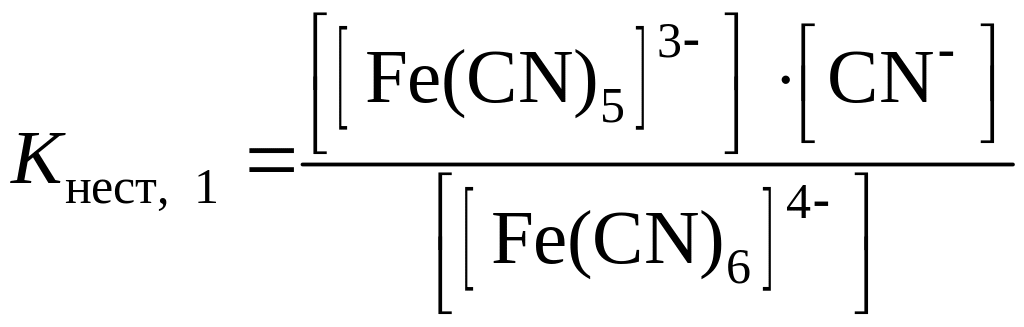 ;
;
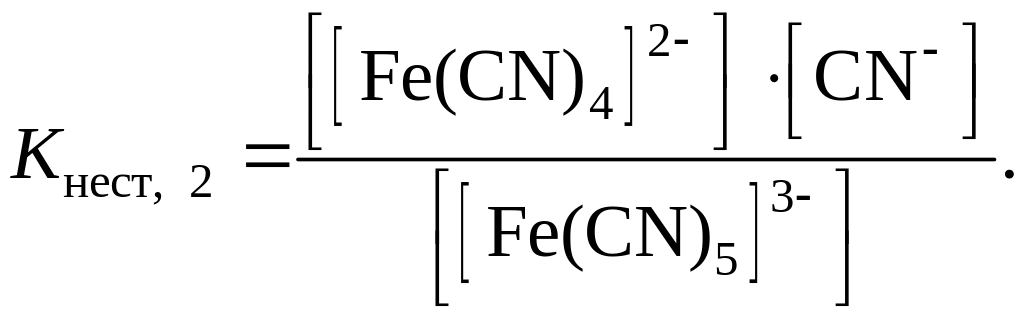
На практике чаще пользуются величиной общей константы нестойкости Kнест, которая характеризует суммарное равновесие вторичной диссоциации. Например, для иона [Fe(CN)6]4–
[Fe(CN)6]4–
↔ 6CN–
+ Fe2+,
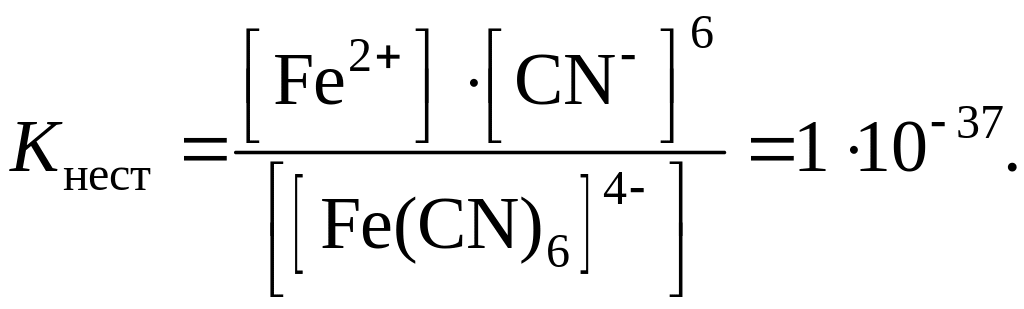
Kнест равна произведению констант нестойкости всех ступеней:
Kнест = Kнест, 1 · Kнест, 2 · Kнест, 3 ·... Kнест, n..
Иногда вместо Kнест пользуются обратной величиной – константой устойчивости Kуст:
Kнест = 1/Kуст .
Если комплексы имеют одинаковое число лигандов, то их устойчивость можно определить по общей константе нестойкости: чем меньше Kнест, тем более устойчив комплексный ион.
Сопоставление Kнест комплексов для реагента и для продукта (при постоянном КЧ) позволяет установить направление смещения равновесия реакции обмена лигандами в растворе. Например, для процесса
K2[PtCl4] + 4KI ↔ K2[PtI4] + 4KCl,
при сравнении Kнест ионов [PtCl4]2– и [PtI4]2–, которые равны 110-16 и 110-31 соответственно, видно, что комплексный ион-продукт намного устойчивее комплекса-реагента. Следовательно, равновесие такого процесса сильно сдвинуто вправо, т. е. данная реакция протекает в прямом направлении.