
- •По дисциплине «Химия»
- •Основная масса атома сосредоточена в ядре и характеризуется массовым числом а, которое определяют по формуле
- •Строение многоэлектронных атомов и ионов
- •Свойства атомов и ионов
- •Многовариантная задача
- •Приложение Относительная электроотрицательность некоторых элементов
- •Литература
- •Содержание
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Институт металлургии и химии

Кафедра химии
Практические занятия по теме
«Строение атома и периодическая система
элементов Д.И. Менделеева»
По дисциплине «Химия»
Учебно-методическое пособие
ЧЕРЕПОВЕЦ
2004
Практические занятия по теме «Строение атома и периодическая система элементов Д.И. Менделеева» по дисциплине «Химия». Учебно-методическое пособие к практическим занятиям по дисциплине «Химия». Череповец: ЧГУ, 2004. с. 34.
Рассмотрено на заседании кафедры химии, протокол № 10 от 07.05.2004 г.
Одобрено редакционно-издательской комиссией Института металлургии и химии ЧГУ, протокол № 5 от 12.05.2004 г.
Составители: О.А. Калько – канд. техн. наук, доцент
Ю.С. Кузнецова – ст. преподаватель
Рецензенты: Т.А. Окунева, доцент (ЧГУ);
Г.В. Козлова, канд. хим. наук, доцент (ЧГУ)
Научный редактор: О.А. Калько – канд. техн. наук, доцент
© Череповецкий государственный
университет, 2004
ВВЕДЕНИЕ
Пособие включает в себя краткие теоретические сведения, примеры решения задач и варианты контрольных заданий по теме «Строение атома и периодическая система элементов Д.И. Менделеева» курса общей химии. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Химия» для инженерно-технических специальностей.
СТРОЕНИЕ АТОМЫХ ЯДЕР. ВОЛНОВЫЕ И
КОРПУСКУЛЯРНЫЕ СВОЙСТВА МИКРООБЪЕКТОВ
Атом – электронейтральная микрочастица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома состоит из двух типов частиц (нуклонов) – протонов и нейтронов. Основные характеристики данных элементарных частиц приведены в табл. 1. Линейные размеры атома составляют ~ 10-8 м, а ядер ~ 10-13 10-12 м.
Таблица 1
Основные характеристики некоторых элементарных частиц
Частица |
Символ |
Масса покоя |
Заряд |
||
абсолют-ная, кг |
относи-тельная, а.е.м. |
электричес-кий, Кл |
относитель-ный |
||
протон |
р |
1,67310-27 |
1,007276 |
1,60210-19 |
+1 |
нейтрон |
n |
1,67510-27 |
1,008665 |
0 |
0 |
электрон |
e |
9,10910-31 |
0,000549 |
1,60210-19 |
-1 |
Основная масса атома сосредоточена в ядре и характеризуется массовым числом а, которое определяют по формуле
А = Z + N (1)
где Z – число протонов, которое равно заряду ядра; N – число нейтронов.
Заряд
ядра – главная характеристика атома,
которая определяет число электронов,
находящихся в атоме и совпадает с
порядковым номером элемента в периодической
системе Д.И. Менделеева. Атомы с одинаковыми
значениями Z,
но различными значениями А
и N
называются изотопами.
Например, известны следующие изотопы
кислорода:
![]() ,
,
![]() ,
,
![]() .
Атомы, обладающие одинаковыми N,
но различными Z
и А,
являются изотонами
(например:
.
Атомы, обладающие одинаковыми N,
но различными Z
и А,
являются изотонами
(например:
![]() ,
,
![]() ,
,
![]() ).
Если же атомы имеют одинаковые значения
А,
но различаются числами Z
и
N,
то их называют изобарами (например:
).
Если же атомы имеют одинаковые значения
А,
но различаются числами Z
и
N,
то их называют изобарами (например:
![]() ,
,![]() ,
,![]() ).
).
Относительная атомная масса элемента является средней величиной массовых чисел его природных изотопов с учетом их распространенности в природе.
Современная теория строения атома основана на законах квантовой механики, согласно которым движущимся микрообъектам присуща двойственная природа: они являются частицами, но имеют волновой характер движения. Математически корпускулярно-волновой дуализм микрообъектов выражается уравнением де Бройля
![]() ,
(2)
,
(2)
где - длина волны, м; h – постоянная Планка (h = 6,6310-34 Джс); m – масса микрочастицы, кг; v – скорость движения микрочастицы, м/с.
Из волновых свойств микрообъектов следует принцип неопределенности Гейзенберга:
микрочастица, так же как и волна, не имеет одновременно точных значений координат положения в пространстве и импульса ее движения.
Математически принцип Гейзенберга отражается системой уравнений
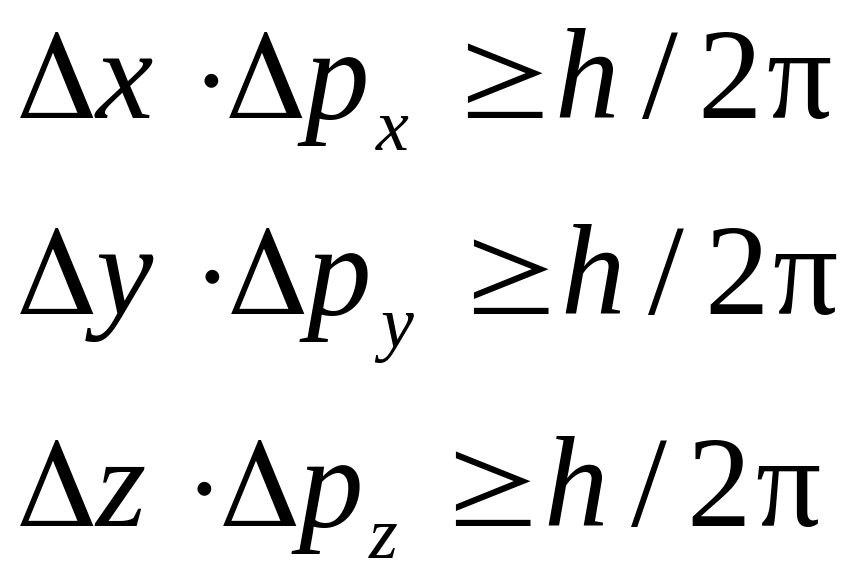 (3)
(3)
где
![]() -
погрешности определения координаты
частицы по соответствующей оси;
-
погрешности определения координаты
частицы по соответствующей оси;
![]() -
погрешности определения проекций
импульса на соответствующие оси.
-
погрешности определения проекций
импульса на соответствующие оси.
Из принципа Гейзенберга вытекает, что чем точнее определяется координата микрочастицы, тем неопределеннее становится информация о скорости ее движения, и наоборот.
Пример
1. По символу
изотопа элемента
![]() указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
Р е ш е н и е
Заряд
ядра атома искомого элемента 92, значит
порядковый номер элемента в периодической
системе тоже 92. Таким образом, искомым
элементом является уран
![]() .
Число протонов Z = 92,
массовое число А = 238, тогда
число нейтронов определяем по формуле
(1)
.
Число протонов Z = 92,
массовое число А = 238, тогда
число нейтронов определяем по формуле
(1)
N = 238 – 92 = 146.
Число электронов в атоме равно заряду ядра, то есть в данном элементе количество электронов равно 92.
Пример
2. Хлор в природе находится в основном
в виде двух изотопов -
![]() (75,43 % атом.) и
(75,43 % атом.) и
![]() (24,57
% атом.). Вычислите среднюю относительную
атомную массу природного хлора.
(24,57
% атом.). Вычислите среднюю относительную
атомную массу природного хлора.
Р е ш е н и е
Ar
=
![]() а.е.м.
а.е.м.
Пример 3. Определите длину волны объекта массой 100 кг, перемещающегося со скоростью 6 м/с. Характерны ли для этого объекта волновые свойства?
Р е ш е н и е
По уравнению де Бройля (формула (2)) определяем длину волны
![]() м.
м.
Современная техника позволяет измерять длины волн в диапазоне от 100 м до 10-15 м. Полученный в данном расчете результат несоизмеримо меньше, то есть его нельзя подтвердить экспериментально. Следовательно, для такого тела не характерны волновые свойства, он является не микрообъектом, а макрочастицей.
Пример 4. Какова погрешность в определении координаты электрона x, движущегося в атоме со скоростью vx = 2,0107 м/с, если погрешность в определении его скорости vx составляет 1 %.
Р е ш е н и е
Из формулы (3)
![]() .
.
Так
как
![]() ,
то
,
то
![]() .
.
Следует отметить, что неопределенность в координате электрона по оси x больше размера самого электрона на 4,5 порядков, так как радиус электрона re = 2,8210-15 м.
З а д а ч и
1.
По символу изотопа элемента
![]() указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
2. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назовите элемент, изотопом которого является данный атом. Подберите к нему изобары и изотоны.
3. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Укажите число протонов и нейтронов в ядре и назовите элемент.
4.
Природный магний состоит из изотопов
![]() и
и
![]() .
Вычислите среднюю
атомную массу природного магния, если
содержание отдельных изотопов в атомных
% соответственно равно 78,6; 10,1 и 11,3.
.
Вычислите среднюю
атомную массу природного магния, если
содержание отдельных изотопов в атомных
% соответственно равно 78,6; 10,1 и 11,3.
5.
Природный галлий состоит из изотопов
![]() и
и
![]() .
Определите содержание отдельных изотопов
в атомных %, если средняя атомная масса
галлия равна 69,72.
.
Определите содержание отдельных изотопов
в атомных %, если средняя атомная масса
галлия равна 69,72.
6. Определите длину волны α–частицы массой 6,64 ·10-27 кг, перемещающейся со скоростью 1·104 м/с. Сравните диапазон рентгеновского излучения 5·10-3 нм с полученным результатом.
7. Какова погрешность в определении координаты протона Δx, движущегося со скоростью 2·104 м/с, если погрешность в определении его скорости Δvх составляет 2 %.
8. Вычислите длину волны де Бройля, которая соответствует электрону с массой 9,1·10-28 кг, движущемуся со скоростью 6·106 м/с.
9. Какова длина волны, соответствующая частице с массой 0,1 г, движущейся со скоростью 10 м/с?
10. Какое количество энергии несет один квант света с длиной волны 7,5·10-7 м?
11. Длина волны электрона 0,242·10-7 м. Вычислите скорость движения электрона.
12. Масса нейтрона 1,675·10-27 кг, а скорость движения его 4·102 м/с. Определите длину волны де Бройля.
13. Какую энергию надо сообщить невозбужденному атому водорода, чтобы он мог испускать излучение с длиной волны λ= 1500·10-10 м?
14. Какую энергию несет один квант света с длиной волны 6,7·10-7 м?
15. Длина волны микрочастицы равна 2,42 · 10-9м. Вычислите скорость движения этой частиц, если ее масса равна 2,3410-6 кг.
16. Определите длину волны, соответствующую частице с массой 0,1 мг, движущейся со скоростью 105 м/с.
17. Масса α-частицы 6,644 · 10-27кг. С какой скоростью движется эта α-частица, если длина волны де Бройля для нее равна 2 ·10-12м?
18. Вычислите длину волны протона, двигающегося со скоростью 5104 м/с, если масса протона равна 1,6710-27 кг.
19. Вычислите энергию возбуждения электрона в атоме натрия, если при его возбуждении поглощается фотон с длиной волны 4340·10-10 м. Массу фотона принять равной массе электрона.
20. Определите энергию перехода электрона атома водорода, которой соответствует красная ( = 656 нм) линия спектра испускания.
21. Определите энергию перехода электрона атома водорода, которой соответствует голубая ( = 486 нм) линия спектра испускания.
22. Экспериментально установлено, что в спектре испускания атомов натрия наибольшую интенсивность имеет линия, соответствующая излучению с длиной волны 589,2 нм. Какова энергия этого излучения?
23. Массовое число атома некоторого элемента равно 207, в электронной оболочке атома содержится 82 электрона. Укажите число протонов и нейтронов в ядре и назовите элемент.
24. Ядро атома некоторого элемента содержит 18 нейтронов, а электронная оболочка этого атома – 17 электронов. Назовите элемент, изотопом которого является данный атом. Подберите к нему изобары.
25. Ядро атома некоторого элемента содержит 35 нейтронов, а электронная оболочка этого атома – 30 электронов. Назовите элемент, изотопом которого является данный атом. Подберите к нему изотоны.
26. Природный бром состоит из двух стабильных изотопов 79Вr (50,56 % атом.) и 82Вr (49,44 % атом.). Определите среднюю атомную массу природного брома. Определите число нейтронов и протонов в ядре у изотопа 79Вr.
27. Природный азот состоит из смеси двух устойчивых изотопов с массовыми числами 14 и 15. Пользуясь значением средней атомной массы определите атомный % изотопа 15N в смеси.
28. Природный селен состоит из смеси шести устойчивых изотопов с массовыми числами 74, 76, 77, 78, 80 и 82. Массовая доля этих изотопов в смеси равна: 74Se – 0,0087; 76Se – 0,0902; 77Se – 0,0758; 78Se – 0,2352; 80Se – 0,4982; 82Se – 0,0919. Определите среднюю атомную массу природного селена.
29. Вычислите энергию возбуждения электрона в атоме лития, если при его возбуждении поглощается фотон с длиной волны 5440·10-10 м. Массу фотона принять равной массе электрона.
30.
По символу
изотопа элемента
![]() указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
указать название элемента, число протонов
и нейтронов в его ядре и число электронов,
содержащихся в электронной оболочке.
