
- •Интерференция световых волн. Условия минимума и максимума освещенности.
- •Методы получения интерференционных картин.
- •Временная и пространственная когерентность.
- •Интерференция в тонких пленках. Два вида интерференции в тонких пленках. Кольца Ньютона.
- •Интерференция света в тонких плёнках
- •2 Вида интерф. Картин в тонких пленках
- •Дифракция света. Принцип Гюйгенса – Френеля.
- •Метод зон Френеля.
- •Дифракция Френеля на простейших преградах.
- •Дифракция Фраунгофера на одной щели.
- •Дифракционные приборы.
- •Разрешающая способность оптических приборов [r]
- •Дифракция на многомерных структурах. (Фраунгофера)
- •Поляризация света. Поляризаторы и анализаторы. Закон Малюса. Степень поляризации.
- •Поляризация при отражении и преломлении света на поверхности диэлектрика. Закон Брюстера.
- •Оптически анизотропные вещества. Двойное лучепреломление. Эффекты Керра и Коттона-Мутона
- •Вращение плоскости поляризации
- •Тепловое излучение, его свойства и характеристики
- •Законы теплового излучения.
- •Формула Релея – Джинса. «Ультрафиолетовая катастрофа»
- •Формула Планка и ее анализ. Пирометрия.
- •Внешний фотоэффект. Законы внешнего фотоэффекта.(свет, а не фото)
- •Эксперимент. Установка
- •Фотонная теория света. Уравнение Эйнштейна для фотоэффекта.
- •Внутренний фотоэффект. Вентильный фотоэффект.
- •Эффект Комптона.
- •Давление света и его объяснение.
- •Опыты Резерфорда по рассеянию альфа-частиц. Планетарная модель атома. Постулаты Бора. Энергетический спектр атома водорода. Спектральные серии.
- •Теория водородоподобных атомов. Затруднения теории.
- •28. Корпускулярно-волновой дуализм микрочастиц и его опытное обоснование. Волновая функция микрочастицы и ее свойства.
- •Основные идеи квантовой механики. Соотношение неопределенностей.
- •Временное и стационарное уравнения Шредингера и их решения.
- •Микрочастица в бесконечно глубокой потенциальной яме и ее волновая функция.
- •Микрочастица в потенциальной яме конечной глубины. Туннельный эффект.
- •Атом водорода в квантовой механике.
- •Квантовые числа (главное, орбитальное и магнитное) и их смысл. Вырожденные состояния. S-, p-, d-, f-, … - состояния электрона в атоме. Электронные облака.
- •35. Эффекты Зеемана и Штарка. Мультиплетность энергетических уровней. Опыты Штерна-Герлаха. Спин электрона. Магнитное спиновое число.
- •Рентгеновское излучение. Тормозные и характеристические рентгеновские спектры.
- •Строение и свойства атомного ядра. Капельная и оболочечная модели ядра. Ядерные реакции. Закономерности протекания ядерных реакций
- •38.Радиоактивность. Виды радиоактивного распада. Закон радиоактивного распада. Активность радиоактивного вещества
- •39. Элементарные частицы и античастицы. Их классификация. Понятие о кварковой структуре адронов.
Теория водородоподобных атомов. Затруднения теории.
Бо́ровская
моде́ль а́тома—
полуклассическая модель атома,
предложенная Нильсом
Бором в
1913 г. За основу он взял планетарную
модель атома, выдвинутую Резерфордом.
Однако, с точки зрения классической
электродинамики, электрон в модели
Резерфорда, двигаясь вокруг ядра, должен
был бы излучать непрерывно,
и очень быстро, потеряв энергию, упасть
на ядро. Чтобы преодолеть эту проблему
Бор ввел допущение, суть которого
заключается в том, что электроны в атоме
могут двигаться только по определенным
(стационарным) орбитам, находясь на
которых они не излучают, а излучение
или поглощение происходит только в
момент перехода с одной орбиты на другую.
Причем стационарными являются лишь те
орбиты, при движении по которым момент
количества движения электрона равен
целому числу постоянных
Планка[1]: ![]() .
.
Используя
это допущение и законы классической
механики, а именно равенство силы
притяжения электрона со стороны ядра
и центробежной силы, действующей на
вращающийся электрон, он получил
следующие значения для радиуса
стационарной орбиты ![]() и
энергии
и
энергии ![]() находящегося
на этой орбите электрона:
находящегося
на этой орбите электрона:
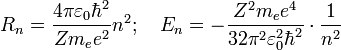
Здесь ![]() —
масса электрона, Z — количество
протонов в ядре,
—
масса электрона, Z — количество
протонов в ядре, ![]() — диэлектрическая
постоянная,
e — заряд электрона.
— диэлектрическая
постоянная,
e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.
Радиус
первой орбиты в
атоме водорода R0=5,2917720859(36)·10−11 м[2],
ныне называется боровским
радиусом,
либо атомной
единицей длины и
широко используется в современной
физике. Энергия первой орбиты ![]() эВ представляет
собой энергию
ионизации атома
водорода.
эВ представляет
собой энергию
ионизации атома
водорода.
Трудности т. Бора
отсутствие связи 1 постулата с общефизич. законами
непослед.хар-р теории: она и квантовая и классич.
отсутствие основ для объяснения интенсивности
отсутствие основ для трактовки спектров многоэл. атомов
28. Корпускулярно-волновой дуализм микрочастиц и его опытное обоснование. Волновая функция микрочастицы и ее свойства.
λв=h/p – длина волны де Бройля
Опыт Дэвиссона – джермера (1927 г., США)
длина волны по Брэггу и по де Бройлю практически совпали
Опыт Джорджа Томсона и П. Тартаковского
Опыт Бибермана, Сушкина, Фабриканта (появление электронографии)
Вывод: Де Бройль предположил, что волновые свойства микрочастиц должны описываться нек. волновой функцией
Ψ(r,t)=Ae–i(wt-kr)
в нек.направлениях вероятность (Р) нахождения е наибольшая
Интенсивность волн де Бройля определяет плотность вероятности попадания е в данную точку
|Ψ(x,y,z,t)|2=dP/dV
Волны де Бройля не относ. не к механическим, не ЭМ волнам – это волны вероятности
Свойства волн. функции:
Ψ= Ψ(x,y,z,t)
амплитуда вероятности нахождения микрочастиц в момент времени t в объеме dV
∫|Ψ|2dV=1
Однозначная, конечная и непрерывная ф-ия, также непрерывны ее частные производные
ф-я |Ψ|2 должна быть интегрируема
