
- •Раздел 3
- •Занятие 27
- •1. Построение градуировочного графика
- •Цель занятия
- •1. Что из перечисленного не используется в атомно-абсорбционной спектроскопии?
- •2. Что из перечисленного ниже верно?
- •3. При измерении оптической плотности раствора аскорбиновой кислоты при 245 нм:
- •4. Ниже приведены спектры поглощения двух органических соединений. Какие из перечисленных утверждений, касающихся данных спектров, истинные?
- •1. Построение градуировочного графика
- •2. Определение массы этония в пробе
- •1. Построение градуировочного графика
- •2. Определение массы новокаина в пробе
- •Занятие 29
- •Цель занятия
- •1. Что из перечисленного используется в аэс?
- •2. Что из перечисленного верно?
- •9. Эффект Шпольского - это:
- •10. Флуориметрия является более чувствительным методом анализа, чем фотометрия, потому что:
- •1. Построение градуировочного графика
- •2. Определение массы рибофлавина в пробе
- •Занятие 30
- •Цель занятия
- •1. Что из перечисленного ниже верно?
- •9. Исправленное время удерживания вещества а составляет 150 секунд, а вещества b - 100 секунд. Коэффициент разделения веществ а и в равен:
- •10. Для двух компонентов анализируемой смеси величина rs равна 1,8. Что из перечисленного ниже верно?
- •Занятие 31
- •Цель занятия
- •Занятие 32
- •Цель занятия
- •1. Ниже приведены значения Rf для пяти компонентов анализируемой смеси. Пятно, соответствующее какому компоненту, будет находиться ближе всего к линии фронта растворителя?
- •2. Ниже приведены значения коэффициентов распределения для пяти компонентов анализируемой смеси. Пятно, соответствующее какому компоненту, будет находиться ближе всего к линии старта?
- •3. Найдите выражения, в которых имеются ошибки:
- •4. Двухмерная тсх отличается от одномерной тем, что:
- •Цель занятия
- •1. Настройка прибора и измерение рН раствора
- •2. Потенциометрическое титрование смеси фосфата и гидрофосфата натрия
- •Цель занятия
10. Флуориметрия является более чувствительным методом анализа, чем фотометрия, потому что:
явление флуоресценции является вторичным по отношению к процессу поглощения;
процесс флуоресценции продолжается более длительное время, чем процесс поглощения;
число флуоресцирующих веществ меньше, чем число поглощающих;
измерить абсолютную величину малого сигнала проще, чем незначительную разность между двумя сигналами большой интенсивности;
измерение флуоресцентного излучения проводится под углом 90 по отношению к возбуждающему свету.
Количественное определение тиамина бромида (витамина B1) в поливитаминном драже «Ревит» проводили экстракционно-флуориметрическим методом. Навеску порошка растёртых драже массой 0,0800 г растворили в 0,01 М HCl, получив 100,0 мл раствора, который затем количественно разбавили водой в 10 раз. С 1,00 мл раствора, полученного после разбавления, провели реакцию окисления гексацианоферратом (III) калия. Образовавшийся в процессе реакции флуоресцирующий продукт экстрагировали изобутиловым спиртом. Интенсивность флуоресценции полученного экстракта, измеренная относительно контрольного опыта, оказалась равной 257. Рассчитайте массу тиамина бромида в 1 драже, если известно, что экстракт, полученный при проведении реакции окисления с 1,00 мл стандартного раствора с концентрацией тиамина бромида 1,00 мкг/мл, имеет в аналогичных условиях интенсивность флуоресценции 225. Масса 10 драже данной серии равна 1,0263 г.
В данной задаче приведён пример экстракционно-флуориметрического определения органического вещества. Для определения концентрации использован метод одного стандартного раствора. Расчёт массы тиамина бромида, содержащегося в 1 драже, можно провести следующим образом. Вначале рассчитаем концентрацию тиамина бромида в конечном растворе:
![]() мкг/мл
мкг/мл
С учётом разбавлений масса (г) тиамина бромида, содержавшегося в исходной навеске порошка растёртых драже, равна
![]() г
г
Следовательно, масса тиамина бромида в 1 драже равна
![]() г
г
Раствор лекарственного вещества дипиридамола в этиловом спирте с неизвестной концентрацией растворённого вещества имеет интенсивность флуоресценции 50,0 ед, а стандартный раствор с концентрацией данного вещества 0,20 мкг/мл - 43,0 ед. Рассчитайте концентрацию дипиридамола в анализируемом растворе, если интенсивность флуоресценции контрольного опыта равна 5,0 ед. Ответ: 0,24 мкг/мл.
Раствор хинина в 0,05 М H2SO4 с концентрацией растворённого вещества 0,40 мкг/мл имеет интенсивность флуоресценции 120 ед., а раствор с концентрацией этого вещества 0,60 мкг/мл - 170 ед. Какова масса (мкг) хинина, содержащегося в 100,0 мл раствора, который в таких же условиях имеет интенсивность флуоресценции 140 ед? Ответ: 48 мкг.
Раствор с неизвестной концентрацией фолиевой кислоты имеет интенсивность флуоресценции 100 ед, при добавлении к данному раствору 10,0 мкг фолиевой кислоты интенсивность флуоресценции раствора стала равной 150 ед. Рассчитайте массу фолиевой кислоты, содержащейся в исходном растворе. Ответ: 20,0 мкг.
При измерении в одинаковых условиях интенсивности флуоресценции растворов с различной концентрацией рибофлавина (мкг/мл) были получены следующие результаты:
С, мкг/мл |
0,08 |
0,16 |
0,24 |
0,32 |
I |
46 |
97 |
148 |
189 |
Рассчитайте величину углового коэффициента b в уравнении зависимости I = bC и определите концентрацию рибофлавина в растворе, интенсивность флуоресценции которого равна 120. Ответ b = 600, C = 0,20 мкг/мл.
Пробу объёмом 1,00 мл раствора, содержащего этоний и хлорид натрия, разбавили водой до 100,0 мл. К 1,00 мл полученного раствора прибавили необходимое количество этанола, раствора эозина, буферного раствора и довели водой до 10,0 мл. Образовавшийся ионный ассоциат этония и эозина экстрагировали 10,0 мл CHCl3, интенсивность флуоресценции полученного хлороформного экстракта оказалась равной 60,0 единиц (среднее значение для трёх измерений). Определите концентрацию этония в исходном растворе (г/100 мл), если зависимость интенсивности флуоресценции хлороформных экстрактов от концентрации этония в водной фазе (мкг/мл) описывается уравнением I = 63,0C -3,0. Ответ: 0,100г/100 мл.
Раствор с неизвестной концентрацией хинидина имеет интенсивность флуоресценции 80 ед, после того как к 5,00 мл раствора данного вещества прибавили 1,00 мл стандартного раствора с концентрацией хинидина 1,00 мкг/мл интенсивность флуоресценции полученной смеси стала равной 150 ед. Рассчитайте массу хинидина, содержавшегося в 100,0 мл анализируемого раствора.
Навеску порошка растёртых таблеток рибофлавина массой 0,2000 г растворили в горячей воде. Полученный раствор количественно перенесли в мерную колбу вместимостью 500,0 мл, довели водой до метки, перемешали и профильтровали. Затем 10,0 мл фильтрата разбавили водой до 100,0 мл. Интенсивность флуоресценции полученного при этом раствора оказалась равной 120 ед. Интенсивность флуоресценции стандартного раствора с концентрацией рибофлавина 0,40 мкг/мл оказалась при таких же условиях измерения равной 110 ед. Затем к 10,0 мл исследуемого и стандартного растворов добавили по 0,1 г NaHCO3 и NaHSO3 и перемешали (рибофлавин при этом был превращён в нефлуоресцирующее соединение). После проведения данной операции интенсивность флуоресценции исследуемого раствора уменьшилась до 10 ед, а стандартного раствора -до 3 ед. Рассчитайте массу рибофлавина в расчёте на среднюю массу 1 таблетки, если масса 20 анализируемых таблеток была равна 3,9900 г.
Навеску массой 0,4020 г образца мази, содержащей декамин - лекарственное вещество противогрибкового действия, поместили в коническую колбу, прибавили 70 мл 1% раствора CaCl2 и нагрели на кипящей водяной бане до расплавления основы. После охлаждения полученный раствор количественно перенесли в мерную колбу вместимостью 100,0 мл и довели 1% раствором CaCl2 до метки. К 0,50 мл полученного раствора добавили необходимое количество этанола, раствора эозина, буферного раствора и довели водой до 10,0 мл. Затем провели экстракцию флуоресцирующего ионного ассоциата декамина с эозином 10,0 мл хлороформа. Рассчитайте массовую долю декамина в мази, если среднее значение 5 измерений интенсивности флуоресценции хлороформных экстрактов оказалось равным 92,0 ед. Зависимость интенсивности флуоресценции хлороформного экстракта от концентрации декамина (мкг/мл) в водной фазе (до экстракции) описывается уравнением: I = 83,8C + 8,0.
ФЛУОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ РИБОФЛАВИНА»
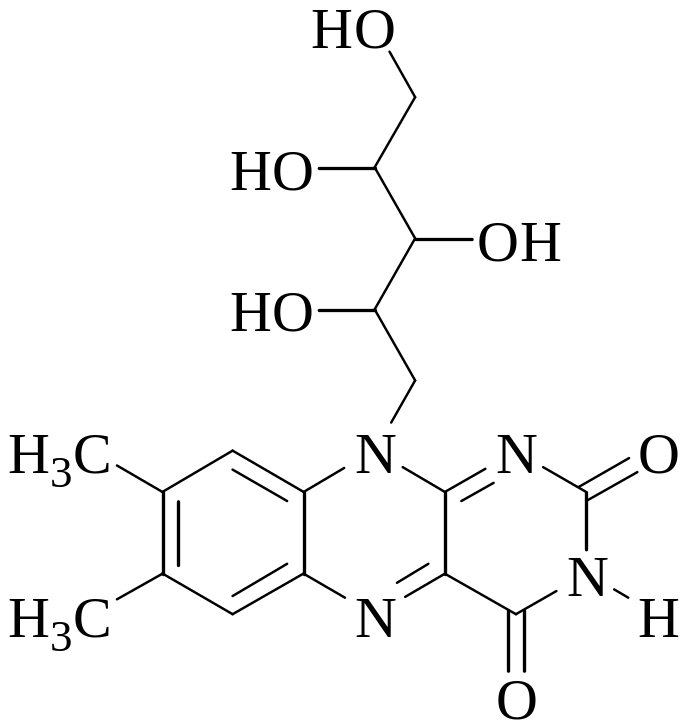
Интенсивность флуоресценции рибофлавина зависит от рН (рис. 29.1.). Она достигает максимального значения при рН 3-9 и значительно уменьшается при рН<3 и рН > 9. Флуоресценция исчезает также и при восстановлении молекулы рибофлавина.
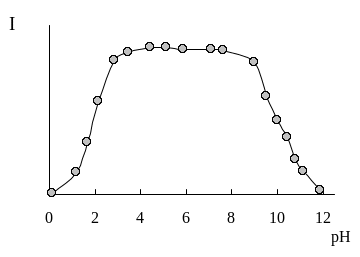
Рис. 29.1. Влияние рН на флуоресценцию рибофлавина
Одним из приборов, которые можно использовать для измерения флуоресценции рибофлавина и других веществ, флуоресцирующих в видимой области, является флуориметр БИАН-130. Данный прибор выполнен в виде отдельных блоков: измерителя, флуориметрического преобразователя и блока питания флуориметра.
Рис.
29.2.
Оптическая
схема флуориметрического преобразователя
флуориметра БИАН-130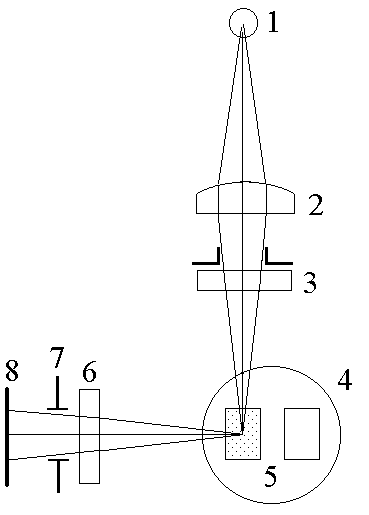
Измерение интенсивности флуоресценции рибофлавина с помощью флуориметра БИАН-130 проводится следующим образом.
Включают флуориметр и измеритель, поставив выключатели блока питания и измерителя в положение СЕТЬ. Через 30 минут флуориметр готов к работе. В готовом к работе приборе стрелка микроамперметра РЕЖИМ ИЗМЕРИТЕЛЯ должна стоять в положении 10 мкА. Переключатель УСТАНОВКА КОНЦА ШКАЛЫ рекомендуется установить в положение х10. Оптимальным первичным светофильтром для измерения интенсифности флуоресценции рибовлавина является светофильтр с максимумом пропускания при 365 нм, вторичным - 470 нм.
В кювету наливают (до риски) раствор с самой большой концентрацией рибофлавина. Устанавливают кюветодержатель в положение Р. Открывают крышку кюветодержателя и устанавливают эту кювету в положение Р и затем закрывают крышку кюветодержателя.
Нажимают на ручку ОБЛУЧЕНИЕ КЮВЕТЫ и, не отпуская её, поворотом ручки УСТАНОВКА КОНЦА ШКАЛЫ устанавливают указатель измерителя на последнее деление шкалы, после чего отпускают ручку ОБЛУЧЕНИЕ КЮВЕТЫ.
Выливают из кюветы раствор с наибольшей концентрацией рибофлавина, ополаскивают её водой, а затем раствором с наименьшей концентрацией рибофлавина. Наливают в кювету раствор с наименьшей концентрацией рибофлавина, помещают её в положение Р, закрывают крышку кюветодержателя, нажимают на ручку ОБЛУЧЕНИЕ КЮВЕТЫ и снимают отсчёт интенсивности флуоресценции (в условных единицах) по шкале измерителя. Отсчёт рекомендуется повторить несколько раз и найти среднее арифметическое значение интенсивности флуоресценции раствора.
Раствор выливают из кюветы, ополаскивают её следующим и раствором и повторяют операции, описанные в п.4, для следующего раствора.
