
- •Раздел 3
- •Занятие 27
- •1. Построение градуировочного графика
- •Цель занятия
- •1. Что из перечисленного не используется в атомно-абсорбционной спектроскопии?
- •2. Что из перечисленного ниже верно?
- •3. При измерении оптической плотности раствора аскорбиновой кислоты при 245 нм:
- •4. Ниже приведены спектры поглощения двух органических соединений. Какие из перечисленных утверждений, касающихся данных спектров, истинные?
- •1. Построение градуировочного графика
- •2. Определение массы этония в пробе
- •1. Построение градуировочного графика
- •2. Определение массы новокаина в пробе
- •Занятие 29
- •Цель занятия
- •1. Что из перечисленного используется в аэс?
- •2. Что из перечисленного верно?
- •9. Эффект Шпольского - это:
- •10. Флуориметрия является более чувствительным методом анализа, чем фотометрия, потому что:
- •1. Построение градуировочного графика
- •2. Определение массы рибофлавина в пробе
- •Занятие 30
- •Цель занятия
- •1. Что из перечисленного ниже верно?
- •9. Исправленное время удерживания вещества а составляет 150 секунд, а вещества b - 100 секунд. Коэффициент разделения веществ а и в равен:
- •10. Для двух компонентов анализируемой смеси величина rs равна 1,8. Что из перечисленного ниже верно?
- •Занятие 31
- •Цель занятия
- •Занятие 32
- •Цель занятия
- •1. Ниже приведены значения Rf для пяти компонентов анализируемой смеси. Пятно, соответствующее какому компоненту, будет находиться ближе всего к линии фронта растворителя?
- •2. Ниже приведены значения коэффициентов распределения для пяти компонентов анализируемой смеси. Пятно, соответствующее какому компоненту, будет находиться ближе всего к линии старта?
- •3. Найдите выражения, в которых имеются ошибки:
- •4. Двухмерная тсх отличается от одномерной тем, что:
- •Цель занятия
- •1. Настройка прибора и измерение рН раствора
- •2. Потенциометрическое титрование смеси фосфата и гидрофосфата натрия
- •Цель занятия
1. Построение градуировочного графика
В мерные колбы вместимостью 50,00 мл последовательно вносят 0,50; 1,00; 1,50; 2,00; 2,50 и 3,00 мл стандартного раствора железа с концентрацией Fe(III) 100,0 мкг/мл. В каждую колбу прибавляют по 5 мл 10% раствора KSCN, доводят водой до метки и перемешивают. Затем измеряют оптическую плотность каждого раствора на фотоэлектроколориметре (КФК-2, КФК-2МП) при светофильтре с максимумом пропускания 490 нм в кювете с толщиной слоя 1 см. Полученные результаты рекомендуется представить в виде следующей таблицы.
№ |
1 |
2 |
3 |
4 |
5 |
6 |
V (Fe3+), мл |
0,50 |
1,00 |
1,50 |
2,00 |
2,50 |
3,00 |
C(Fe3+), мкг/мл |
1,00 |
2,00 |
3,00 |
4,00 |
5,00 |
6,00 |
А |
|
|
|
|
|
|
По полученным данным методом наименьших квадратов рассчитывают уравнение зависимости С от А (обратное уравнение градуировочного графика).
Расчёт уравнения и графическую интерпретацию полученных данных рекомендуется проводить под руководством преподавателя с помощью электронных таблиц Excel или аналогичной компьютерной программы.
2. Определение массы Fe3+ в пробе
Полученную пробу количественно переносят в мерную колбу вместимостью 50,00 мл, прибавляют 5 мл 10% раствора KSCN, доводят водой до метки и перемешивают. Измеряют оптическую плотность полученного раствора в условиях, описанных выше. По рассчитанному обратному уравнению градуировочного графика определяют концентрацию Fe3+ в растворе (Сх, мкг/мл), а затем по формуле m = C50,00 - массу Fe3+ в анализируемой пробе.
ФОТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ЦИАНОКОБАЛАМИНА
Спектр поглощения цианокобаламина в видимой области показан на рис. 27.4. Оптимальным светофильтром для измерения оптической плотности растворов данного вещества является светофильтр с максимумом пропускания 364 нм (для прибора КФК-2) или 340 нм (КФК-2МП).
В предлагаемой методике количественное определение цианокобаламина проводится с использованием двух стандартных растворов
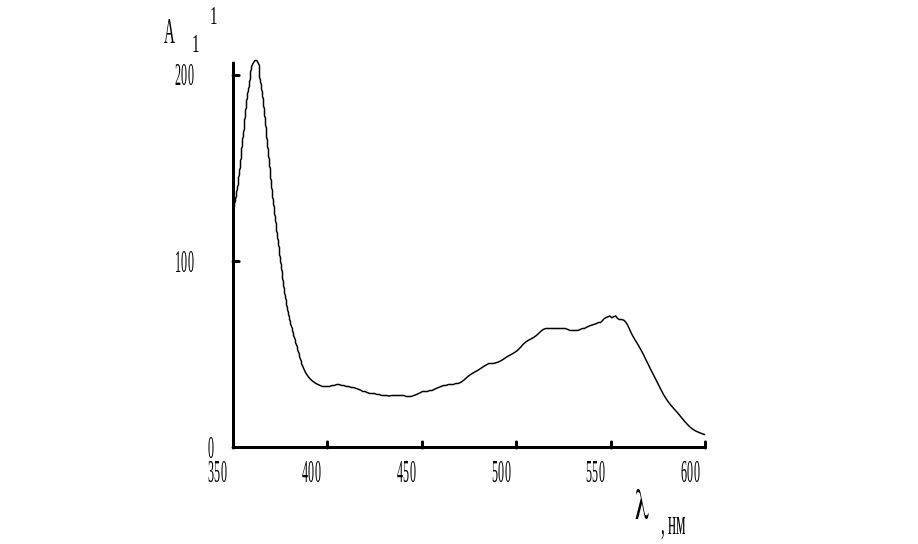
Рис. 27.4. Спектр поглощения цианкобаламина в видимой области
Содержимое ампулы раствора цианокобаламина для инъекций количественно переносят в мерную колбу вместимостью 25,00 мл и доводят водой до метки. Затем измеряют оптическую плотность трёх растворов: стандартного раствора цианокобаламина с концентрацией 15,0 мкг/мл - А1; раствора, полученного при разбавлении анализируемого раствора для инъекций - Ax и стандартного раствора с концентрацией цианокобаламина 25,0 мкг/мл - A2.
Массу цианокобаламина (мкг), содержащегося в 1 ампуле инъекционного раствора, рассчитывают по следующей формуле:
![]()
![]()
ЗАНЯТИЕ 28

Цель занятия
Знать:
основные принципы, положенные в основу атомно-абсорбционной спектроскопии, устройство и принцип работы приборов, используемых в данном методе анализа и область его практического применения;
устройство и принцип работы приборов, используемых в молекулярной абсорбционной спектроскопии в УФ- и ИК-области;
сущность основных приёмов, используемых в фотометрическом анализе;
основные принципы, положенные в основу ИК-спектроскопии, устройство и принцип работы приборов, используемых в данном методе анализа, особенности подготовки пробы, практическое применение ИК-спектроскопии.
Уметь:
проводить фотометрическое определение этония, основанное на реакции его взаимодействия с эозином, и новокаина, основанное на собственном поглощении данного вещества в УФ-области.
Атомно-абсорбционная спектроскопия. Принцип метода. Устройство и принцип работы используемых приборов. Практическое применение.
Молекулярная абсорбционная спектроскопия в УФ- и видимой области (спектрофотометрия, фотометрия). Принцип метода. Устройство и принцип работы используемых приборов.
Основные приёмы, используемые в спектрофотометрическом анализе: прямая спектрофотометрия, фотометрические реакции, экстракционная фотометрия, дифференциальная, производная и многоволновая спектрофотометрия, фотометрическое титрование.
ИК-спектроскопия. Принцип метода. Устройство и принцип работы используемых приборов. Практическое применение.

Почему атомные спектры поглощения в оптической области спектра линейчатые, а молекулярные состоят из широких полос?
Почему в качестве источника в ААС не используют обычные лампы, дающие непрерывный спектр испускания? Объясните принцип работы лампы с полым катодом.
Какую форму имеет пламя, используемое в качестве атомизатора в ААС? Почему такая форма пламени повышает чувствительность определения?
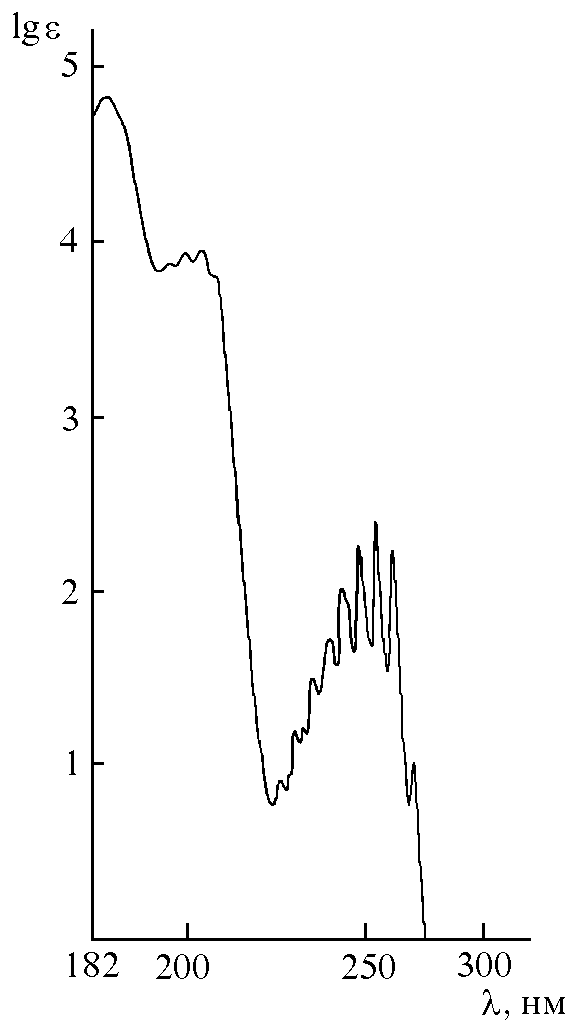
Рис. 28.1. УФ-спектр поглощения органического вещества
В чём разница между спектрофотометром и фотоэлектроколориметром? Какие задачи можно и какие нельзя решать с помощью фотоэлектроколориметра? Отличаются ли рабочие интервалы оптических плотностей для данных приборов?На рис. 28.1 приведен спектр поглощения органического вещества в УФ-области. Какому веществу - бензолу или циклогексану принадлежит данный спектр? Объясните Ваш выбор.
Что такое «фотометрическая реакция». Приведите примеры использования таких реакций для количественного определения неорганических и органических веществ.
Почему спектрофотометрия в УФ- и видимой области спектра обычно используется для количественного определения веществ, в то время как ИК-спектроскопия - для качественного?
Почему не все молекулы и химические связи поглощают ИК-излучение? От чего зависит, в какой области ИК-спектра будет находиться полоса поглощения той или иной связи? Почему волновое число для валентных колебаний больше, чем для деформационных; для колебаний связи С-H больше, чем для аналогичных колебаний С-С, а связи СС больше, чем С=С?
Что такое область “отпечатков пальцев” и область функциональных групп?
Почему в ИК-спектрометре монохроматор находится не перед кюветой с исследуемым образцом, а после неё?
