
- •Раздел 1. Квазистатические процессы Предварительное рассмотрение
- •Раздел 2. Первый закон термодинамики
- •Принцип эквивалентности для циклических процессов
- •Раздел 3. Математическое выражение первого закона термодинамики
- •Соотношения между изменениями u и н и теплотами процессов
- •Раздел 4. Второй закон термодинамики Введение
- •Физико-химические особенности обратимого процесса
- •Энтропия и неравновесные процессы. Некоторые особенности неравновесного процесса.
Раздел 2. Первый закон термодинамики
Первый закон термодинамики часто рассматривают как вариант закона сохранения энергии применительно к процессам, в которых изменение энергии происходит в форме работы и теплоты.
Закон сохранения энергии обычно выражают в таком виде: энергия не создается из ничего и не уничтожается, не исчезает бесследно. Она может лишь переходить из одной формы в другие в строго эквивалентных количествах. Термин эквивалентность используется в том случае, когда виды энергии имеют разную размерность. При одинаковых размерностях один вид энергии превращается в точно такое же количество другого вида.
В историческом плане процесс становления закона сохранения энергии и первого закона термодинамики проходил в противоположном направлении: сначала был сформулирован первый закон термодинамики, а затем на его основе в результате обобщения более обширных экспериментальных данных – закон сохранения энергии.
Исходным пунктом в развитии научных идей, которые привели к установлению первого закона термодинамики, явились работы немецкого физика Юлиуса Майера (1814-1878) и английского физика Джеймса Джоуля (1818-1889), проведенные независимо друг от друга в начале 40х гг IX столетия. Их целью было установить возможен ли переход работы в теплоту, и определить сколько можно получить теплоты при полном превращении в теплоту некоторого количества работы, если такой переход действительно возможен. Необычность этих исследований определялась тем, что в это время господствовало убеждение, что работа и теплота независимые физические величины. Теплоту рассматривали как некое невесомое вещество (теплород), способное проникать во все тела и переходить от одного тела к другому. При этом происходит понижение температуры одного тела и повышение температуры другого. При такой интерпретации сущности теплоты переход работы в некую невесомую субстанцию казался невозможным. И хотя к моменту начала работ Майера и Джоуля наука располагала фактами, которые говорили о возможности перехода работы в теплоту, они не носили убедительного и обобщающего характера.
В своих работах Майер и Джоуль связь между работой и теплотой выражали в виде отношения абсолютных значений затраченной работы и полученной теплоты. Величина такого отношения J, имеющая размерность, получила название механического эквивалента теплоты. Если в качестве единиц работы и теплоты использовать, такие в настоящее время внесистемные единицы как килограмм·сила·метр (кгс·м) и килокалории соответственно*, механический эквивалент теплоты можно представить в виде такого уравнения
![]()
В настоящее время значение J принимается равным 426,6 кгс·м/ккал.
J = 426,6 кгс·м/ккал (2)
Отметим, что кгс·м – это работа, совершаемая весом тела с массой 1 кг на пути 1 м. Поскольку вес тела G это сила притяжения тела с массой m к земле
![]()
и
1 кгс·м = 9,80665 Дж
В этом случае соотношение () принимает вид
J = 4183,52 Дж/ккал
или
J = 4,184 кДж/ккал (3)
Уравнения (1)-(3) называются уравнениями эквивалентности между работой и теплотой. Из них следует, что для получения одной калории теплоты необходимо затратить соответственно 426,6 кгс·м или 4,184 кДж работы.
1 ккал (кал) = 4,184 кДж (Дж)
В соотношении (2) имеется в виду термохимическая калория. По определению это количество теплоты, которое надо сообщить одному кубическому сантиметру _______________________
* Именно такие единицы работы и теплоты использовали Майер и Джоуль
воды, чтобы повысить ее температуру на один градус в интервале температур от 19,5 до 20,50С.*
Для обратной величины механического эквивалента имеем
![]()
Обратная
величина ![]() называется тепловым коэффициентом
работы. Уравнение показывает, что для
получения одного кДж работы необходимо
затратить 0,239 ккалории теплоты.
называется тепловым коэффициентом
работы. Уравнение показывает, что для
получения одного кДж работы необходимо
затратить 0,239 ккалории теплоты.
В системе СИ работа и теплота измеряются в одинаковых единицах, джоулях, поэтому принцип эквивалентности выглядит особенно просто: работа численно равна теплоте
![]() (5)
(5)
Впервые значение J (в размерности кгс·м/ккал) вычислил Майер, но оно оказалось очень не точным.
Работа была опубликована в 1842 г, но прошла незамеченной, не вызвав никаких откликов. Тем не менее, учитывая важность и значение для развития науки принципа эквивалентности работы и теплоты, некоторые ученые считают этот год – годом зарождения закона сохранения энергии. Так в 1942 г Планк опубликовал работу «Юлиус Роберт Майер. К столетию открытия закона сохранения энергии»
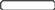
Схема одного из устройств, использованных Джоулем для определения механического эквивалента теплоты, показана на рис.1.
____________________
* В системе единиц СИ калория сохраняется как внесистемная единица, для которой принято соотношение
1 кал = 4,1868 Дж
Но в этом случае калория равна количеству теплоты, которая необходима для повышения температуры с 14,5 до 15,50С.








1

2






3

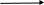
Груз
Рис. 1 Схема устройства для определения механического эквивалента теплоты
1 – неподвижные выступы, повышающие сопротивление воды; 2 – вращающиеся лопатки; 3 – материал теплоизоляции.
В сосуде с адиабатическими стенками находилась вода, которая перемешивалась мешалкой с лопатками. Работа по перемешиванию воды, равная работе падающего груза, приводила к повышению температуры воды. При этом происходило нагревание лопаток мешалки и неподвижных выступов. Поэтому необходимо было провести предварительное градуирование устройства, используя прибор, позволяющий точно определять теплоту, подводимую к системе, и вызывающее этой теплотой повышение температуры.
Эквивалент J определялся в виде отношения работы, произведенной падающим грузом, к теплоте, определяемой по градуировочному графику.
Устройства и процессы, которые вначале использовали Джоуль и Майер не позволяли определить J с высокой точностью. Главным образом, это было связано с тем, что работа, получаемая в опытах Майера и Джоуля, в принципе могла приводить лишь к очень незначительным изменениям температуры. Как следует из уравнения (1) при полном переходе работы, совершаемой телом массой 1 кг, находящегося на высоте 42,66 см, температура одного литра воды может повыситься лишь на 0,00010С. Но непрерывные и настойчивые усилия Джоуля по совершенствованию экспериментальных устройств позволили ему получить значение J, равное 424 кгс·м/ккал, которое менее чем на 1% отличается от современного значения.
Для определения J использовались различные приборы и установки, и во всех изученных процессах значение механического эквивалента в пределах погрешности оставалось постоянным. Постепенно зрело убеждение, что закон эквивалентности должен выполняться и в более сложных явлениях и процессах с участием всех известных к тому времени физических сил. По этому поводу немецкий физик Рудольф Клаузиус в 1850 году писал: «Во всех случаях, когда из теплоты появляется работа, тратиться количество теплоты пропорциональное полученной работе и наоборот, при затрате той же работы получается то же количество тепла». Принцип эквивалентности между работой и теплотой Клаузиус предложил рассматривать как формулировку первого закона термодинамики.
Развитие идей, заложенных в законе эквивалентности, привело, в конечном счете, к пониманию, что он является частным случаем более широкого и всеобщего закона – закона сохранения энергии. Особенно большую роль в осмыслении, что принцип эквивалентности ведет к более фундаментальному обобщению, сыграли работы и публичные выступления Гельмгольца. В 1847 г он опубликовал работу «О сохранении силы», в которой, применив закон эквивалентности к анализу механических, тепловых, электрических и физиологических процессов, обосновал закон сохранения энергии и показал его универсальность и всеобщее значение.
При описании процессов, которые использовались для определения J, пока, не обращалось внимание на их главную особенность, которой они должны удовлетворять. Суть в том, что эквивалентность работы и теплоты справедливо не для любого процесса, а только для тех, в которых система, совершив процесс, возвращается в исходное состояние. Процесс, в котором система, совершив процесс, возвращается в исходное состояние, называется циклическим или круговым. При этом параметры системы в конце циклического процесса принимают такие же значения, какие были в начале процесса.
