
- •Раздел 1. Квазистатические процессы Предварительное рассмотрение
- •Раздел 2. Первый закон термодинамики
- •Принцип эквивалентности для циклических процессов
- •Раздел 3. Математическое выражение первого закона термодинамики
- •Соотношения между изменениями u и н и теплотами процессов
- •Раздел 4. Второй закон термодинамики Введение
- •Физико-химические особенности обратимого процесса
- •Энтропия и неравновесные процессы. Некоторые особенности неравновесного процесса.
Раздел 1. Квазистатические процессы Предварительное рассмотрение
В обычном понимании процесс состоит в изменении состояния системы под действием некоторых факторов, играющих роль движущих сил. Например, подвод тепла к веществу, находящемуся в некоторой емкости, которая отделяет его от окружающей среды, вызывает повышение температуры, что определяет его как процесс нагревания. Предположим, что в цилиндре с поршнем находится газ, давление которого превышает внешнее давление. Движение поршня ограничено фиксатором, который удерживает поршень в определенном состоянии. После удаления ограничительного устройства произойдет процесс расширения газа до состояния, когда движущая сила процесса в виде давления не будет уравновешена внешним давлением, например, атмосферным. Назовем такого рода процессы естественными. В термодинамике их называют особым термином – необратимые процессы. Название связано с тем, что естественные процессы нельзя провести в обратном направлении через те же самые состояния, которые имели место в прямом процессе. В этом смысле их нельзя обратить. Причина заключается в том, что хотя естественный процесс проявляется через изменения системы они неповторимы, индивидуальны, на каждом этапе его осуществления как в прямом, так и в обратном направлениях. В первом процессе температура тела, во втором давление газа в каждой элементарно малой части системы по ходу процесса имеют свои индивидуальные значения. Поэтому выражения, что в первом процессе температура повышается, во втором – давление понижается, являются всего лишь качественной характеристикой процесса.
Естественные процессы нельзя достоверно описать физико-химическими методами с помощью функций или выражений, зависящих от конкретных параметров, поскольку в естественном процессе они не имеют физического смысла для системы в целом.
Для теоретического описания процессов их надо проводить таким образом, чтобы система в течение процесса находилась в состоянии внутреннего равновесия с характерными для данного процесса параметрами. Такое возможно если система в свою очередь находится в определенном равновесии с окружающей средой.
Рассмотрим процесс, который совершает тело (система), преодолевая действие каких-либо внешних сил, например, внешнее давление.
Д
Pгр
V2

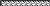

Pгр
Т
V2
Р2


V1
Т
V1
Р1




а б
Рис.1 Схема устройства, в котором идеальный газ совершает процесс расширения:
а) начальное состояние; б) конечное состояние.
Предположим, что роль внешних сил играет атмосферное давление, вес поршня Gп и вес груза Gгр, отнесенные к единице поверхности поршня. Все устройство находится в термостате, поддерживающем температуру системы постоянной, и равной Т. Состояние газа как индивидуального вещества задается двумя параметрами, в данном случае, объемом и давлением газа. Пусть в исходном состоянии они равны V1, Р1. Проведем процесс расширения газа, подводя к воде в термостате и идеальному газу в цилиндре теплоту от внешнего теплоисточника. Передачу тепла будем проводить чрезвычайно медленно, с тем, чтобы давление газа в процессе расширения имело смысл параметра газа. Примем далее, что теплота, подводимая к идеальному газу, полностью расходуется на производимую работу. В этом случае, несмотря на поступающую теплоту, температура в процессе расширения будет постоянной и равной Т. Через какой-то период времени за счет подводимой теплоты система перейдет из начального состояния 1 в состояние 2 с параметрами V2, Т. При этом давление понижается с Р1 до Р2. При расширении газ за счет теплоты, поступающей от теплоисточника, совершает работу против внешних сил
![]()
количество, которой в координатах Р, V равно заштрихованной площади на рис.2.
Р
Р
Р1
Р1



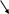




изотерма
(1)
потерянная
работа
Р(внеш

Р2
Рвнеш
(2)




V
V
V2
V1
V2
V1
Vf

а б
Рис.2 а) Работа квазистатического расширения идеального газа при Т = const, б) работа необратимого процесса
Подинтегральная
функция в интеграле (1) выражается
уравнением ![]() ,
которое при Т = const
представляет собой обратную функцию.
В координатах Р – V
она называется изотермой, которая как
видно из рис. отображает путь 1
изотермического расширения идеального
газа.
,
которое при Т = const
представляет собой обратную функцию.
В координатах Р – V
она называется изотермой, которая как
видно из рис. отображает путь 1
изотермического расширения идеального
газа.
_______________________
* Равенство W = Qтеплоист = RTlnV2/V1 следует из первого закона термодинамики, когда системой является идеальный газ
Зададимся
вопросом, а как собственно совершается
процесс, работа которого равна
заштрихованной площади? Если в один
прием снять часть груза произойдет
очень быстрое необратимое расширение
газа от V1
до Vf,
при этом давление будет неопределенным
образом уменьшаться. Когда давление
газа приблизится к значению ![]() ,
поршень после некоторых колебаний
остановится в положении
,
V
=
,
поршень после некоторых колебаний
остановится в положении
,
V
= ![]() .
При необратимом расширении газа от V1
до
Vf
производится работа против внешнего
давления
.
При необратимом расширении газа от V1
до
Vf
производится работа против внешнего
давления ![]() ,
количество которой
,
количество которой
![]()
равно
заштрихованной площади А. Заметим, что
это один из немногих примеров, когда
работа
неравновесного процесса
вычисляется точно. Это связано с самой
сутью объемной работы при Р = const.
В состоянии, когда газ имеет объем Vf,
снова в один прием уменьшим вес груза
до ![]() .
Вновь произойдет необратимое расширение
газа до конечного объема V2,
при этом будет произведена работа.
.
Вновь произойдет необратимое расширение
газа до конечного объема V2,
при этом будет произведена работа.
![]() (площадь В)
(площадь В)
Суммарная работа необратимых процессов меньше чем вычисленная по уравнению, поскольку с точки зрения получения работы часть движущей силы* потрачена неэффективно. Как увеличить количество работы? Очевидно, для этого необходимо уменьшать разность между давлением газа и внешним давлением пути. В итоге ступенчатый путь будет постепенно трансформироваться в более плавную кривую, которая при условии Рг = Рвнеш на протяжении всего пути сольется с изотермой. Но условие Рг = Рвнеш – это условие механического равновесия. Другими словами для получения максимальной работы процесс необходимо проводить через последовательность состояний равновесия. Процесс, проходящий через непрерывную совокупность состояний равновесия, называется равновесным. При его физической интерпретации допускается незначительное, _______________________
* В данном случае движущей силой является подводимая теплота
исчезающее малое различие движущих сил системы и противодействующих сил окружающей среды. Иначе говоря, равновесный процесс представляют в виде скачкообразного пути между предельно близкими состояниями равновесия. По этой причине равновесный процесс называют также квазистатическим. На рис. а он представлен в виде изотермы, где смежные состояния обозначены квадратами предельно малого размера.
При чрезвычайно малом превышении сил внешней среды по отношению к движущим силам системы равновесный процесс на каждом этапе можно направить в противоположную сторону. В этом смысле равновесный процесс, в отличие от естественного, обратим, поскольку его можно провести в строго обратном направлении.
Как следует из хода изложения, расширение газа направлено на преодоление сил внешнего сопротивления, которые синхронно уменьшаются с понижением давления газа (рис.2). В принципе его можно провести таким образом, если предположить, что груз состоит из частиц очень малого размера. Если груз уменьшать, снимая частицу за частицей, расширение газа практически не будет отличаться от равновесного. В пределе, когда вес частиц будет бесконечно малой величиной, процесс перейдет в бесконечно медленный квазистатический процесс.
Работа равновесного процесса не только превышает работу любого необратимого процесса, она максимальна по своему значению. Получить работу выше работы равновесного процесса в принципе нельзя. Это положение не зависит от типа процесса и вида работы. Доказательство этой важной закономерности базируется на соотношении, объединяющем первый и второй законы термодинамики.
