
Лабораторная работа №2 «Белки»
1.Теоретическая часть
а) Структура пептидов и белков
Пептиды — это цепочечные молекулы, содержащие от двух до ста остатков аминокислот, соединенных между собой амидными (пептидными) связями.
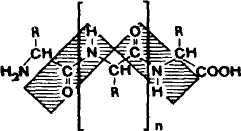
Пептидная связь имеет св-ва частично двойной связи. Это проявляется в уменьшении длины этой связи (0,132 нм)по сравнению с длиной простой связи C N (0,147 нм). Частично двоесвязный характер пептидной связи делает невозможным своб. вращение заместителей вокруг нее. поэтому пептидная группировка является плоской и имеет обычно транс-конфигурацию (ф-ла I). T. обр., остов пептидной цепи представляет собой ряд жестких плоскостей с подвижным ("шарнирным") сочленением в месте, где расположены асимметрич. атомы С (в ф-ле I обозначены звездочкой).
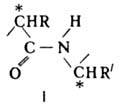
В р-рах пептидов наблюдается предпочтительное образование определенных конформе-ров. С удлинением цепи более выраженную устойчивость приобретают (аналогично белкам) упорядоченные элементы вторичной структуры (a-спираль и b-струк-тура). Образование вторичной структуры особенно характерно для регулярных пептидов, в частности для полиаминокислот.
Белки́ -высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот
Структура белка
![]()
![]()
Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — рибосоме
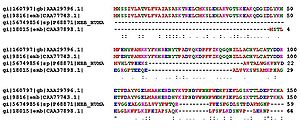
Сравнение аминокислотных последовательностей белков (в данном случае — гемоглобинов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда,модификации происходят уже после синтеза белка на рибосоме). При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Уровни организации
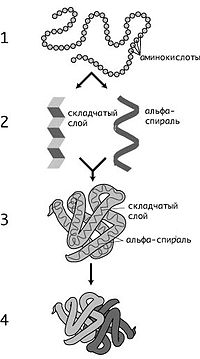
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[15] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина,серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали.
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
π-спирали;
310-спирали;
неупорядоченные фрагменты.
Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
б) Синтез пептидов
Хим. синтез пептидов заключается в создании пептидной связи между группой COOH одной аминокислоты и NH2 др. аминокислоты или пептида. В соответствии с этим различают карбоксильную и аминную компоненты р-ции пептидного синтеза.
в) Химические реакции белков
