
|
Нижегородский государственный технический университет им. Р.Е. Алексеева |
|
Лабораторная работа №6 |
|
Электрохимические процессы. |
|
|
|
Выполнил: студент |
|
группы С11-АЭ ИЯЭ и ТФ |
Поздеев Е.Д. Проверил: Кутьин А.П.
|
Нижний Новгород , 2011г. |
Теоретическая часть
-
Электродные потенциалы.
Каждая окислительно-восстановителельная реакция состоит из двух полуреакций: реакции окисления и полуреакции восстановления. Например, Реакция
2KI+Br2=2KBr + I2
слагается из двух полуреакций
Br2+2е = 2Br- ,
2I-=I2+2e.
Полуреакция содержит окисленную и восстановленную форму вещества. Окисленная форма содержит элемент с более высокой степенью окисления, восстановления – с более низкой. В рассмотренных полуреакциях Br2 и I2 - окисленная форма; Br – и I - - восстановленная форма веществ.
Любая полуреакция характеризуется определённым электродным потенциалом φ, величина которого зависит от природы веществ – участников электродного процесса, их концентрации (точнее активности) и температуры. Эта зависимость выражается уравнением Нернста:
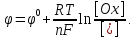
В этом
уравнении
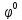 – стандартный
электродный потенциал, R
– универсальная газовая постоянная, Т
– абсолютная температура, F
– число Фарадея, n
– число электронов, участвующих в
электродном процессе,
– стандартный
электродный потенциал, R
– универсальная газовая постоянная, Т
– абсолютная температура, F
– число Фарадея, n
– число электронов, участвующих в
электродном процессе,
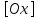 и
и
 - концентрации (активности) соответственно
окисленной и восстановленной форм
вещества.
- концентрации (активности) соответственно
окисленной и восстановленной форм
вещества.
Если в уравнение Нернста подставить значения постоянных величин ( R = 8,314 Дж/моль*К, F = 96500 Кл/моль, Т = 298 К) и перевести натуральные логарифмы в десятичные, оно примет вид:
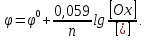
Первое слагаемое в этом уравнении учитывает влияние природы веществ на величину электродного потенциала, второе – их концентраций. Кроме того, оба члена изменяются с температурой. Если концентрация (активность) каждого вещества, участвующего в реакции, равна единице, то логарифмический член уравнения Нернста обращается в ноль и φ = φ0. Следовательно, стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях (точнее активностях) всех участвующих в нём веществ, равных единице.
Если компоненты электродного процесса не содержат металлической фазы, то электрод, на котором протекает электродный процесс, изготавливается из инертного материала – платины, графита. В этом случае материал электрода не претерпевает изменения в ходе электродного процесса, а участвует лишь в передаче электронов от восстановленной формы вещества к его окисленной форме. К таким электродам относятся, например водородный, кислородный, хлорный.
Схема водородного электрода может быть записана в виде Pt, H2 | H+. Равновесие на этом электроде выражается уравнением 2 H++2e = H2. Ионы H+ являются окисленной формой, а H2 – восстановленной формой вещества. Уравнение Нернста для водородного электрода принимает вид:
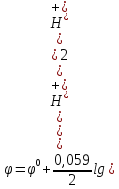 ,
,
где
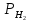 - парциальное давление водорода.
- парциальное давление водорода.
При парциальном давлении
водорода, равном нормальному атмосферному
давлению, условно принимаемому за
единицу,
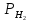 = 1(101кПа) , учитывая,
что lg
= 1(101кПа) , учитывая,
что lg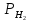 =0,
lg[
H+]
= -pH,
φ0=0,
получим:
=0,
lg[
H+]
= -pH,
φ0=0,
получим:
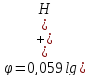
Пользуясь эти уравнением, можно рассчитать потенциал водородного электрода при любых значениях pH. Например, при pH=0 φ=0; при pH=7 φ=-0,41B; при pH=14 φ=-0,83B.
Кислородный
электрод схематически изображается в
форме Pt,
O2|
H2O.
В кислой среде равновесие на этом
электроде определяется уравнением
O2+4H++4e
= 2H2O.
Следовательно, n=4,
[Ox]=[O2][H+]4,
[Red]=[H2O]2.
Так как в разбавленных растворах
концентрацию воды можно считать
постоянной, то, обозначив парциальное
давление кислорода через ,
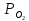 ,
можно выразить
уравнение Нернста для кислородного
электрода соотношением:
,
можно выразить
уравнение Нернста для кислородного
электрода соотношением:
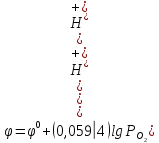
При парциальном давлении
кислорода, равном нормальному атмосферному
давлению, условно принимаемому за
единицу, учитывая, что
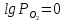 ,
,
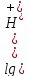 ,
,
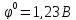 , уравнение Нернста
для кислородного электрода примет вид:
, уравнение Нернста
для кислородного электрода примет вид:
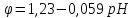
Пользуясь этим уравнением, можно рассчитать потенциал кислородного электрода при любых значениях pH/ Например, при pH=0 φ=1,23B; при pH=7 φ=0,82B; при pH=14 φ=0,40B.
Схема хлорного электрода может быть записана в виде Pt, Cl2| Cl-. Ионы Cl- являются восстановленной формой, а Cl2 – окисленной формой вещества. Уравнение Нернста для этого электрода выражается соотношением:
,
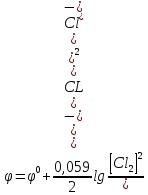
где
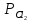 – парциальное
давление хлора.
– парциальное
давление хлора.
При
парциальном давлении хлора, равном
нормальному атмосферному давлению,
условно принимаемому за единицу,
учитывая, что
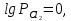
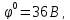 уравнение
Нернста для хлорного электрода примет
вид:
уравнение
Нернста для хлорного электрода примет
вид:
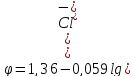
Следовательно, потенциал хлорного электрода уменьшается с увеличением ионов Cl-.
В некоторых случаях кроме концентрации окисленной и восстановленной форм вещества на величину электродного потенциала оказывает влияние концентрация ионов H+. Например, для электродного процесса MnO-4+8H++5e = Mn2++4H2O, где ионы MnO-4 являются окисленной формой, а ионы Mn2+ восстановленной формой вещество, уравнение Нернста выражается соотношением:
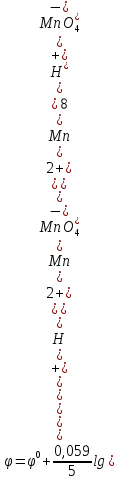
Как видно, электродный потенциал данного процесса возрастает с увеличением концентрации ионов H+.
-
Гальванические элементы
В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. Химическая энергия в этих реакциях превращается в тепловую и не используется. Если отделить пространственно процесс окисления от процесса восстановления и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное движение электронов – электрический ток.
Устройства (приборы), в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую, используемую для совершения полезной работы, называются гальваническими элементами. В гальваническом элементе может быть осуществлена только межмолекулярная самопроизвольно протекающая окислительно-восстановительная реакция, энергия Гиббса которой меньше нуля (ΔG<0). Любой гальванический элемент состоит из двух электродов-металлов, погруженных в растворы электролитов, разделённых пористой перегородкой (диафрагмой) или соединённых с помощью трубки, заполненной токопроводящим раствором (так называемого солевого мостика). При таких условиях становится возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном электроде, а восстановление – на другом. Электроны передаются от восстановителя к окислителю по внешней цепи.
В электрохимии электрод, на котором в ходе реакции происходит процесс окисления, называется анодом, электрод, на котором осуществляется восстановление, - катодом.
В гальваническом элементе электрод с меньшим значением электродного потенциала является отрицательным электродом, на это электроде протекает процесс окисления (анод); электрод с большим значением электродного потенциала – положительным электродом, на котором протекает процесс восстановления (катод). Электроны при замыкании внешней цепи движутся от отрицательного электрода к положительному.
Гальванический элемент может быть составлен не только из двух различных электродов, но и из двух одинаковых, погруженных в растворы одного и того же электролита. Однако в этом случае они должны быть помещены в растворы с различной концентрацией (активностью) ионов, так как необходимым условием работы гальванического элемента является наличие разности потенциалов его электродов. При этом электрод с меньшим значением электродного потенциала выполняет функцию отрицательного электрода, электрод с большим значением электродного потенциала – положительного электрода. Такой гальванический элемент называется концентрационным.
В принципе электрическую энергию может дать любая межмолекулярная самопроизвольно протекающая окислительно-восстановительная реакция. Однако, число реакций, практически используемых в химических источниках электроэнергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент обладающий технически ценными свойствами (высокая и практически постоянна э.д.с., длительная сохранность и др.). Кроме того, многие окислительно-восстановительные реакции требую расхода дорогостоящих веществ.
-
Электролиз.
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор электролита или его расплав. Электролиз рассматривает окислительно-восстановительные реакции, энергия Гиббса которых больше нуля (ΔG>0). Такие процессы самопроизвольно протекать не могут, энергия, необходимая для их осуществления, поступает от внешнего источника тока. Следовательно, если в гальваническом элементе энергия химической реакции преобразуется в электрический ток, то при электролизе идёт обратный процесс – преобразование электрической энергии в химическую.
При электролизе, как и в гальваническом элементе, на аноде происходит окисление, а на катоде – восстановление. Однако, при этом анодом является положительный электрод, а катодом – отрицательный. Знаки зарядов электродов при электролизе противоположны тем, которые имеются в гальваническом элементе, так как процессы, протекающие при электролизе, обратны процессам, протекающим в гальваническом элементе.
Для проведения электролиза электроды погружают в раствор или расплав электролита и соединяют их источником постоянного тока. Процессы, протекающие при электролизе на аноде и катоде, определяются свойствами электролита, растворителя и материала электродов.
Различают два вида анодов – инертные (нерастворимые) и активные (растворимые). Инертные аноды не принимают участия в процессе окисления, а служат только поверхностью, на которой протекает окисление. В качестве материалов для инертных анодов обычно применяют графит, уголь, платину, иридий. Растворимые аноды принимают участие в процессе окисления, они разрушаются, то есть переходят в раствор в виде ионов. При определённых условиях растворимыми анодами могут быть аноды из меди, цинка, кадмия, никеля, серебра и т.д.
На основании сравнения значений электродных потенциалов возможных процессов окисления и восстановления можно предсказывать образующиеся в процессе электролиза продукты.
